Transfer-messenger RNA - Transfer-messenger RNA
| transfer-messenger RNA | |
|---|---|
 | |
| Identifikátory | |
| Symbol | tmRNA |
| Rfam | RF00023 |
| Další údaje | |
| RNA typ | gen |
| PDB struktur | PDBe |
Transfer-messenger RNA (zkráceně tmRNA, také známý jako 10 Sa RNA a jeho genetickým názvem SsrA) je bakteriální RNA molekula s duálním tRNA -jako a messenger RNA -jako vlastnosti. TmRNA tvoří a ribonukleoprotein komplex (tmRNP) společně s malým proteinem B (SmpB ), Faktor prodloužení Tu (EF-Tu ), a ribozomální protein S1. v trans-translace, tmRNA a její asociované proteiny se vážou na bakteriální ribozomy které se zastavily uprostřed roku biosyntéza bílkovin, například při dosažení konce a messenger RNA který ztratil svůj stop kodon. TmRNA je pozoruhodně univerzální: recykluje zastavený ribozom, dodává a proteolýza -indukující značku nedokončenému polypeptid a usnadňuje degradaci aberantu messenger RNA.[1] U většiny bakterií jsou tyto funkce prováděny standardně jednodílné tmRNA. U jiných bakteriálních druhů je permutovaný ssrA gen produkuje a dvoudílná tmRNA ve kterém jsou dva oddělené řetězce RNA spojeny párováním bází.
Objev a raná práce
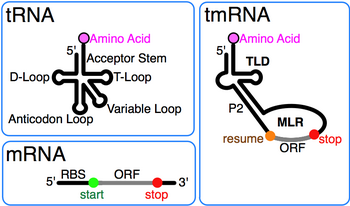
tmRNA byla nejprve označena 10Sa RNA po smíšené "10S" elektroforetické frakci Escherichia coli RNA byla dále rozdělena na tmRNA a podobně velké RNáza P RNA (10Sb).[2] Přítomnost někoho pseudouridin ve smíšené 10S RNA naznačil, že tmRNA má modifikované báze nalezené také v tRNA. Podobnost na 3 'konci tmRNA s T kmenovou smyčkou tRNA byl poprvé rozpoznán při sekvenování ssrA z Mycobacterium tuberculosis.[3] Následné srovnání sekvencí odhalilo úplnou doménu podobnou tRNA (TLD) tvořenou 5' a 3' konce tmRNA, včetně akceptorového kmene s prvky, jako jsou ty v alaninové tRNA, které podporují jeho aminoacylaci alanin-tRNA ligáza.[4] Rovněž odhalilo rozdíly od tRNA: antikodon rameno chybí v tmRNA a D rameno region je smyčka bez párů bází.
Struktura
Sekundární struktura standardních jednodílných tmRNA

Kompletní E-coli tmRNA sekundární struktura bylo objasněno komparativní sekvenční analýza a strukturální sondování.[5][6] Watson-Crick a G-U základní páry byly identifikovány porovnáním bakteriálních tmRNA sekvencí pomocí automatizovaných výpočetních metod v kombinaci s manuálními zarovnání postupy.[7][8] Na doprovodném obrázku je ukázán vzor párování bází této prototypické tmRNA, která je uspořádána do 12 fylogeneticky podporované šroubovice (nazývané také párování P1 až P12), některé rozdělené do spirálových segmentů.
Výrazným rysem každé tmRNA je konzervovaný doména podobná tRNA (TLD), složená ze šroubovic 1, 12 a 2a (analogů kmene akceptoru tRNA, T-kmene a variabilního kmene), a obsahující 5 'monofosfátové a alanylatovatelné 3' CCA konce. Oblast podobná mRNA (MLR) je ve standardní tmRNA velká smyčka obsahující pseudoknoty a kódující sekvenci (CDS) pro značku peptid, označeno životopisem kodon a stop kodon. Kódovaný tag peptid (ANDENYALAA v E-coli) se liší mezi bakteriemi, možná v závislosti na sadě dostupných proteáz a adaptérů.[9]
tmRNA obvykle obsahují čtyři pseudoknoty jeden (pk1) upstream od značkového peptidu CDS a další tři pseudoknoty (pk2 až pk4) downstream od CDS. Oblasti pseudoknotu, i když jsou obecně konzervované, jsou evolučně plastické. Například v (jednodílných) tmRNA z sinice, pk4 je nahrazen dvěma tandemově uspořádanými menšími pseudoknoty. To naznačuje, že tmRNA skládání mimo TLD může být důležité, přesto v oblasti pseudoknotů chybí konzervované zbytky a pseudoknoty jsou mezi prvními strukturami, které se ztratí, protože ssrA sekvence se rozcházejí v liniích plastidů a endosymbiontů. Párování bází v oblasti tří pseudoknotů E-coli tmRNA je narušena během trans-překlad.[7][10]
Dvoudílné tmRNA
Kruhově permutovaný ssrA byla hlášena ve třech hlavních liniích: i) všechny alfaproteobakterie a primitivní mitochondrie jakobidských protistů, ii) dvě disjunktní skupiny sinice (Gloeobacter a clade obsahující Prochlorococcus a mnoho Synechococcus) a iii) někteří členové betaproteobakterií (Cupriavidus a některé rhodocykly).[11][12] Všechny produkují stejnou celkovou dvoudílnou (akceptorovou a kódovací část) podobu, která je ekvivalentní standardní formě prořezané za čtecím rámcem. Žádný nezachovává více než dva pseudoknoty ve srovnání se čtyřmi (nebo více) standardní tmRNA.
Alphaproteobacteria mají dvě signální sekvence: nahrazení typické sekvence T-smyčky TΨCRANY GGCRGUA a sekvence AACAGAA ve velké smyčce 3´-terminálního pseudoknotu. V mitochondriích byla MLR ztracena a došlo k pozoruhodné re-permutaci mitochondrií ssrA má za následek malý jednodílný produkt v Jakoba libera.[13]
The sinice poskytují nejpravděpodobnější případ evoluce permutovaného genu ze standardního genu kvůli pozoruhodným sekvenčním podobnostem mezi těmito dvěma typy genů, které se vyskytují v různých genech Synechococcus kmeny.
Zpracování tmRNA
Většina tmRNA se přepisuje jako větší prekurzory, které se zpracovávají podobně tRNA. Štěpení na 5´ konci je ribonukleáza P.[4] Na zpracování 3´ konce tmRNA se však může podílet více exonukleáz RNase T a RNase PH jsou nejúčinnější.[14][15] V závislosti na druhu bakterií je 3'-CCA buď kódován, nebo přidán tRNA nukleotidyltransferáza.
Podobné zpracování na interních místech permutovaného prekurzoru tmRNA vysvětluje jeho fyzické rozdělení na dva kusy. Dvoudílné tmRNA mají dva další konce, jejichž zpracování musí být zváženo. U alphaproteobacteria je jeden 5´ konec nezpracovaným počátečním místem transkripce.[16] Vzdálený konec 3´ může být v některých případech výsledkem rho-nezávislého ukončení.
Trojrozměrné struktury
Struktury úplných molekul tmRNA s vysokým rozlišením jsou v současné době nedostupné a může být obtížné je získat kvůli inherentní flexibilitě MLR. V roce 2007 byla krystalová struktura Thermus thermophilus TLD vázán na SmpB protein byl získán při rozlišení 3 Á. Tato struktura ukazuje, že SmpB napodobuje D kmen a antikodon kanonické tRNA, zatímco spirálovitý úsek 2a tmRNA odpovídá variabilnímu rameni tRNA.[18]A kryo-elektronová mikroskopie studium tmRNA v rané fázi trans-překlad ukazuje prostorový vztah mezi ribozom a tmRNP (tmRNA vázaná na EF-Tu protein). TLD se nachází v blízkosti centra spojeného s GTPázou v 50S ribozomální podjednotce; spirála 5 a pseudoknoty pk2 až pk4 tvoří oblouk kolem zobáku 30S ribozomální podjednotky.[19]
Trans-překlad

Kódování pomocí tmRNA bylo objeveno v roce 1995[20] když Simpson a spolupracovníci nadměrně exprimovali myší cytokin IL-6 E-coli a našli několik zkrácených cytokin -odvozený peptidy každý označený na karboxylových koncích stejným prodloužením 11-aminokyselinového zbytku (A) ANDENYALAA. S výjimkou N-terminálu alanin, který pochází ze 3 'konce samotné tmRNA, byla tato sekvence tagu vysledována do krátkého otevřeného čtecího rámce v E-coli tmRNA. Uznáváme, že peptid značky se uděluje proteolýza, trans- byl navržen překladový model pro akci tmRNA.[21]
Zatímco podrobnosti o trans- mechanismus překladu je předmětem šetření, obecně se souhlasí s tím, že tmRNA nejprve obsadí prázdné místo A zastaveného ribozom. Následně se ribozom pohybuje od 3 'konce zkráceného messenger RNA na kodon obnovení MLR, následovaný fází náchylnou k sklouznutí, odkud překlad pokračuje normálně až do tmRNA v rámci stop kodon došlo. Překlad je nezbytný u některých bakteriálních druhů, zatímco jiné bakterie vyžadují tmRNA k přežití, když jsou vystaveny stresujícím podmínkám růstu.[22] V závislosti na organismu může být peptid značky rozpoznán řadou proteázy nebo proteázové adaptéry.[9]
Mobilní genetické prvky a gen tmRNA

ssrA je cílem pro některé mobilní DNA a cestujícím pro jiné. Bylo zjištěno, že je přerušen třemi typy mobilních prvků. Podle různých strategií žádná z těchto funkcí nenaruší genovou funkci: skupina I introny samy se spojují, rickettsiální palindromické prvky (RPE) vložte do neškodných míst a kódujte integrázu genomové ostrovy rozdělit jejich cíl ssrA přesto obnovte oddělovací část.[23][24][25][26]
Nechromozomální ssrA byl poprvé detekován v genomickém průzkumu mykobakteriofágů (u 10% fágů).[27] jiný mobilní prvky včetně plazmidů a genomových ostrovů bylo zjištěno, že nesou ssrA. Jeden zajímavý případ je Rhodobacter sphaeroides ATCC 17025, jehož nativní gen tmRNA je narušen genomovým ostrovem; na rozdíl od všech ostatních genomové ostrovy v genech tmRNA (nebo tRNA) tento ostrov deaktivoval nativní cílový gen bez obnovení, přesto to kompenzuje nesením vlastního genu tmRNA. Velmi neobvyklý příbuzný ssrA se nachází v lytickém mykobakteriofágu DS6A, který kóduje o něco více než TLD.
Mitochondriální tmRNA (ssrA gen)
Mitochondrie kódovaná strukturně redukovaná forma tmRNA (mt-tmRNA) byla nejprve postulována pro jakobid bičíkatý Reclinomonas americana.[11] Následně přítomnost mitochondriálního genu (ssrA) kódující tmRNA, stejně jako transkripci a RNA zpracovatelská místa byla potvrzena pro všechny členy kromě jednoho člena jakobids.[28][13] Funkční důkaz, tj. Mt-tmRNA Aminoacylace s alanin, je k dispozici pro Jakoba libera.[13] Poslední dobou, ssrA byl také identifikován v mitochondriálních genomech oomycety.[29] Jako v α-Proteobakteriích (předchůdci mitochondrie ), mt-tmRNA jsou kruhově permutované dvoudílné molekuly RNA, s výjimkou Jakoba libera kde se gen vrátil ke kódování jednodílné konformace tmRNA.[13]
Identifikace ssrA v mitochondriálních genomech

Geny mitochondriální tmRNA byly zpočátku rozpoznávány jako krátké sekvence, které jsou mezi nimi konzervovány jakobids a které mají potenciál se složit do odlišné sekundární struktury podobné tRNA. S dostupností devíti kompletních jakobid mtDNA sekvence,[28] a výrazně vylepšený nástroj pro vyhledávání kovariancí (Infernal;[30][31][32]), kovarianční model byl vyvinut na základě jakobid mitochondriální tmRNA, které identifikovaly mitochondriální ssrA geny také v oomycete. V současné době bylo v šesti rodech detekováno celkem 34 oomycete mt-tmRNA: Albugo, Bremia, Phytophthora, Pseudoperonospora, Pythium a Saprolegnia. Kovarianční model vytvořený s oběma jakobid a oomycete sekvence je nyní k dispozici na Rfam pod názvem „mt-tmRNA“.[29]
Struktura mt-tmRNA
Standardní bakteriální tmRNA se skládá z domény podobné tRNA (Ala) (umožňující přidání nekódovaného alaninu k mRNA, které postrádají stop kódování) a domény podobné mRNA kódující proteinovou značku, která určuje polypeptid pro proteolýza. Doména podobná mRNA byla ztracena v mt-tmRNA. Srovnávací sekvenční analýza naznačuje vlastnosti typické pro mt-tmRNA.[29] Nejzachovalejší je primární sekvence stonku aminoacyl akceptoru. Tato část molekuly má neměnný zbytek A v diskriminační poloze a pár G-U v poloze 3 (kromě Seculamonas ecuadoriensis, který má pár G-C); tato pozice je rozpoznávacím místem pro alanyl tRNA syntázu. P2 je šroubovice proměnné délky (3 až 10 párů bází) a odpovídá antikodonovému kmeni tRNA, přesto bez antikodonové smyčky (jak není vyžadováno pro funkci tmRNA). P2 stabilizuje strukturu podobnou tRNA, ale čtyři nukleotidy invariantní přes oomycety a jakobidy naznačují další, v současné době neidentifikovanou funkci. P3 má pět párů bází a odpovídá T-ramenu tRNA, ale s různými konsensuálními nukleotidy jak v párové oblasti, tak ve smyčce. Sekvence T-smyčky je zachována napříč oomycety a jakobid, pouze s několika odchylkami (např. Saprolegnia ferax). Nakonec místo tRNA podobného D-kmene se zkrácenou charakteristikou tří nukleotidů D-smyčky pro bakteriální tmRNA mají mitochondriální protějšky vysoce variabilní 5 až 14-nt dlouhou smyčku. Intervenční sekvence (Int.) Dvoudílných mt-tmRNA je bohatá na A + U a nepravidelné délky (4-34 nt). ). Pro modely sekundární struktury jedno- a dvoudílných mt-tmRNA viz obrázek 1.
Zpracování a exprese mt-tmRNA

Data RNA-Seq Phytophthora sojae vykazují úroveň exprese podobnou úrovni sousedních mitochondrií tRNA a čtyři hlavní zpracovatelská místa potvrzují předpokládané konce zralé mt-tmRNA.[29] Molekula prekurzoru tmRNA je pravděpodobně zpracována RNáza P a tRNA 3 'zpracovávající endonukleázu (viz obrázek 2); předpokládá se, že druhá aktivita vede k odstranění intervenující sekvence. Po přidání CCA k 3 'diskriminačnímu nukleotidu může být tmRNA nabitá alanyl-tRNA syntetázou s alaninem.
Viz také
Reference
- ^ Keiler KC (2008). „Biology of trans-translation“. Výroční přehled mikrobiologie. 62: 133–51. doi:10.1146 / annurev.micro.62.081307.162948. PMID 18557701.
- ^ Ray BK, Apirion D (červenec 1979). "Charakterizace 10S RNA: nová stabilní molekula rna z Escherichia coli". Molekulární a obecná genetika. 174 (1): 25–32. doi:10.1007 / BF00433301. PMID 384159.
- ^ Tyagi JS, Kinger AK (leden 1992). „Identifikace strukturního genu 10Sa RNA Mycobacterium tuberculosis“. Výzkum nukleových kyselin. 20 (1): 138. doi:10.1093 / nar / 20.1.138. PMC 310338. PMID 1371186.
- ^ A b Komine Y, Kitabatake M, Yokogawa T, Nishikawa K, Inokuchi H (září 1994). „Struktura podobná tRNA je přítomna v 10Sa RNA, malé stabilní RNA z Escherichia coli“. Sborník Národní akademie věd Spojených států amerických. 91 (20): 9223–7. doi:10.1073 / pnas.91.20.9223. PMC 44784. PMID 7524073.
- ^ Williams KP, Bartel DP (prosinec 1996). "Fylogenetická analýza sekundární struktury tmRNA". RNA. 2 (12): 1306–10. PMC 1369456. PMID 8972778.
- ^ Felden B, Himeno H, Muto A, McCutcheon JP, Atkins JF, Gesteland RF (leden 1997). "Sondování struktury Escherichia coli 10Sa RNA (tmRNA)". RNA. 3 (1): 89–103. PMC 1369465. PMID 8990402.
- ^ A b Zwieb C, Wower I, Wower J (květen 1999). "Srovnávací sekvenční analýza tmRNA". Výzkum nukleových kyselin. 27 (10): 2063–71. doi:10.1093 / nar / 27.10.2063. PMC 148424. PMID 10219077.
- ^ Andersen ES, Lind-Thomsen A, Knudsen B, Kristensen SE, Havgaard JH, Torarinsson E, Larsen N, Zwieb C, Sestoft P, Kjems J, Gorodkin J (listopad 2007). „Poloautomatické vylepšení uspořádání RNA“. RNA. 13 (11): 1850–9. doi:10,1261 / rna.215407. PMC 2040093. PMID 17804647.
- ^ A b Gur E, Sauer RT (říjen 2008). „Vývoj značky degradace ssrA v Mycoplasma: přepnutí specificity na jinou proteázu“. Sborník Národní akademie věd Spojených států amerických. 105 (42): 16113–8. doi:10.1073 / pnas.0808802105. PMC 2570983. PMID 18852454.
- ^ Wower IK, Zwieb C, Wower J (květen 2005). „Transfer-messenger RNA se odvíjí, jak prochází ribozomem“. RNA. 11 (5): 668–73. doi:10,1261 / rna.7269305. PMC 1370753. PMID 15811920.
- ^ A b Keiler KC, Shapiro L, Williams KP (červenec 2000). „tmRNA, které kódují značky vyvolávající proteolýzu, se nacházejí ve všech známých bakteriálních genomech: Dvoudílná tmRNA funguje v Caulobacter“. Sborník Národní akademie věd Spojených států amerických. 97 (14): 7778–83. doi:10.1073 / pnas.97.14.7778. PMC 16621. PMID 10884408.
- ^ Sharkady SM, Williams KP (2004). „Třetí linie s dvoudílnou tmRNA“. Výzkum nukleových kyselin. 32 (15): 4531–8. doi:10.1093 / nar / gkh795. PMC 516066. PMID 15326226.
- ^ A b C d Jacob Y, Seif E, Paquet PO, Lang BF (duben 2004). "Ztráta oblasti podobné mRNA v mitochondriálních tmRNA jakobidů". RNA. 10 (4): 605–14. doi:10,1261 / rna.5227904. PMC 1370551. PMID 15037770.
- ^ Srivastava RA, Srivastava N, Apirion D (květen 1992). "Charakterizace RNA zpracovávajícího enzymu RNázy III z divokého typu a nadměrně exprimujícího buňky Escherichia coli při zpracování přírodních substrátů RNA". International Journal of Biochemistry. 24 (5): 737–49. doi:10.1016 / 0020-711X (92) 90007-N. PMID 1375563.
- ^ Li Z, Pandit S, Deutscher MP (březen 1998). „Exoribonukleolytické ořezávání 3 'je běžným rysem zrání malých, stabilních RNA v Escherichia coli.“. Sborník Národní akademie věd Spojených států amerických. 95 (6): 2856–61. doi:10.1073 / pnas.95.6.2856. PMC 19659. PMID 9501180.
- ^ Mao C, Bhardwaj K, Sharkady SM, Fish RI, Driscoll T, Wower J, Zwieb C, Sobral BW, Williams KP (2009). „Variace genu tmRNA“. RNA Biology. 6 (4): 355–61. doi:10,4161 / rna.6.4.9172. PMID 19617710.
- ^ Someya T, Nameki N, Hosoi H, Suzuki S, Hatanaka H, Fujii M, Terada T, Shirouzu M, Inoue Y, Shibata T, Kuramitsu S, Yokoyama S, Kawai G (leden 2003). "Struktura roztoku proteinu vázajícího tmRNA, SmpB, z Thermus thermophilus". FEBS Dopisy. 535 (1–3): 94–100. doi:10.1016 / S0014-5793 (02) 03880-2. PMID 12560085.
- ^ A b Bessho Y, Shibata R, Sekine S, Murayama K, Higashijima K, Hori-Takemoto C, Shirouzu M, Kuramitsu S, Yokoyama S (květen 2007). "Strukturální základ pro funkční mimikry tRNA s dlouhým variabilním ramenem pomocí RNA přenosu". Sborník Národní akademie věd Spojených států amerických. 104 (20): 8293–8. doi:10.1073 / pnas.0700402104. PMC 1895943. PMID 17488812.
- ^ Valle M, Gillet R, Kaur S, Henne A, Ramakrishnan V, Frank J (duben 2003). "Vizualizace vstupu tmRNA do zablokovaného ribozomu". Věda. 300 (5616): 127–30. doi:10.1126 / science.1081798. PMID 12677067.
- ^ Tu GF, Reid GE, Zhang JG, Moritz RL, Simpson RJ (duben 1995). "C-terminální prodloužení zkrácených rekombinantních proteinů v Escherichia coli s 10Sa RNA dekapeptidem". The Journal of Biological Chemistry. 270 (16): 9322–6. doi:10.1074 / jbc.270.16.9322. PMID 7536743.
- ^ Keiler KC, Waller PR, Sauer RT (únor 1996). "Úloha systému značení peptidů při degradaci proteinů syntetizovaných z poškozené messengerové RNA". Věda. 271 (5251): 990–3. doi:10.1126 / science.271.5251.990. PMID 8584937.
- ^ Thibonnier M, Thiberge JM, De Reuse H (2008). Ahmed N (ed.). „Trans-translation in Helicobacter pylori: essentiality of ribosome rescue and požadavek of protein tagging for stress resistance and competence“. PLOS ONE. 3 (11): e3810. doi:10.1371 / journal.pone.0003810. PMC 2584231. PMID 19043582.
- ^ Kirby JE, Trempy JE, Gottesman S (duben 1994). „Vyříznutí kryptického proroka podobného P4 vede k expresi Alp proteázy v Escherichia coli“. Journal of Bacteriology. 176 (7): 2068–81. doi:10.1128 / jb.176.7.2068-2081.1994. PMC 205313. PMID 7511583.
- ^ Williams KP (leden 2002). „Web tmRNA: invaze intronem“. Výzkum nukleových kyselin. 30 (1): 179–82. doi:10.1093 / nar / 30.1.179. PMC 99078. PMID 11752287.
- ^ Dwyer DS (leden 2001). "Sobecká DNA a původ genů". Věda. 291 (5502): 252–3. doi:10.1126 / science.291.5502.252. PMID 11253208.
- ^ Williams KP (únor 2003). „Provoz na genu tmRNA“. Journal of Bacteriology. 185 (3): 1059–70. doi:10.1128 / JB.185.3.1059-1070.2003. PMC 142792. PMID 12533482.
- ^ Hatfull GF, Pedulla ML, Jacobs-Sera D, Cichon PM, Foley A, Ford ME, Gonda RM, Houtz JM, Hryckowian AJ, Kelchner VA, Namburi S, Pajcini KV, Popovich MG, Schleicher DT, Simanek BZ, Smith AL, Zdanowicz GM, Kumar V, Peebles CL, Jacobs WR, Lawrence JG, Hendrix RW (červen 2006). „Zkoumání metaproteomu mykobakteriofága: fágová genomika jako vzdělávací platforma“. PLoS Genetics. 2 (6): e92. doi:10.1371 / journal.pgen.0020092. PMC 1475703. PMID 16789831.
- ^ A b Burger G, Gray MW, Forget L, Lang BF (2013). „Pozoruhodné bakteriální a genově bohaté mitochondriální genomy v jakobidských protistech“. Biologie genomu a evoluce. 5 (2): 418–38. doi:10.1093 / gbe / evt008. PMC 3590771. PMID 23335123.
- ^ A b C d Hafez M, Burger G, Steinberg SV, Lang BF (červenec 2013). „Druhá eukaryotická skupina s tmRNA kódovanou mitochondriemi: identifikace in silico a experimentální potvrzení“. RNA Biology. 10 (7): 1117–24. doi:10,4161 / rna.25376. PMC 3849159. PMID 23823571. Archivovány od originál dne 2014-02-21. Citováno 2014-02-13.
- ^ Eddy, S. „Infernal website“. Citováno 14. srpna 2016.
- ^ Eddy SR, Durbin R (červen 1994). „Analýza sekvence RNA pomocí kovariančních modelů“. Výzkum nukleových kyselin. 22 (11): 2079–88. doi:10.1093 / nar / 22.11.2079. PMC 308124. PMID 8029015.
- ^ Nawrocki EP, Kolbe DL, Eddy SR (květen 2009). „Infernal 1.0: inference of RNA alignments“. Bioinformatika. 25 (10): 1335–7. doi:10.1093 / bioinformatika / btp157. PMC 2732312. PMID 19307242.
Další čtení
- Hong SJ, Tran QA, Keiler KC (červenec 2005). „Odbourávání tmRNA regulované buněčným cyklem je řízeno RNázou R a SmpB“. Molekulární mikrobiologie. 57 (2): 565–75. doi:10.1111 / j.1365-2958.2005.04709.x. PMC 3776457. PMID 15978085.


