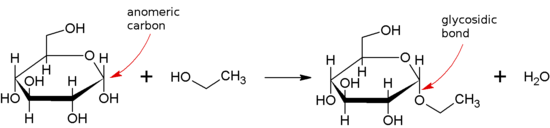
Glykosidová vazba - Glycosidic bond
tento článek potřebuje další citace pro ověření. (Květen 2014) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
A glykosidová vazba nebo glykosidová vazba je typ kovalentní vazba který se připojí k uhlohydrát (cukr) molekuly do jiné skupiny, kterou může nebo nemusí být jiný uhlohydrát.
Mezi. Se vytvoří glykosidická vazba poloacetal nebo hemiketal skupina a sacharid (nebo molekula odvozená od sacharidu) a hydroxylová skupina nějaké sloučeniny, jako je alkohol. Látka obsahující glykosidovou vazbu je a glykosid.
Termín „glykosid“ je nyní rozšířen také na sloučeniny s vazbami vytvořenými mezi hemiacetalovými (nebo hemiketálními) skupinami cukrů a několika chemickými skupinami jinými než hydroxyly, jako jsou -SR (thioglykosidy), -SeR (selenoglykosidy), -NR1R2 (N-glykosidy) nebo dokonce -CR1R2R3 (C-glykosidy).
Zejména v přirozeně se vyskytujících glykosidech se sloučenina ROH, ze které byl odstraněn sacharidový zbytek, často nazývána aglykon a samotný sacharidový zbytek se někdy označuje jako „glykon“.
S-, N-, C- a O-glykosidové vazby
Glykosidové vazby formy diskutované výše jsou známé jako O-glykosidové vazby, s odkazem na glykosidovou kyslík který spojuje glykosid s aglykonem nebo redukuje koncový cukr. Analogicky se také uvažuje S-glykosidové vazby (který formulář thioglykosidy), kde je kyslík glykosidové vazby nahrazen a síra atom. Stejně, N-glykosidové vazby, nechte glykosidovou vazbu kyslíkem nahradit dusík. Látky obsahující N-glykosidové vazby jsou také známé jako glykosylaminy. C-glykosyl vazby mají glykosidový kyslík nahrazený a uhlík; termín "C-glykosid" je považován za nesprávné pojmenování IUPAC a nedoporučuje se.[1] Všechny tyto modifikované glykosidové vazby mají různou náchylnost k hydrolýze a v případě C-glykosylových struktur jsou obvykle odolnější vůči hydrolýze.
Číslování a rozlišení α / β glykosidických vazeb

Jeden rozlišuje mezi α- a β-glykosidové vazby relativní stereochemií anomerní polohy a stereocentra nejdále od C1 v sacharidu.[2] Α-glykosidová vazba se vytvoří, když mají oba uhlíky stejnou stereochemii, zatímco β-glykosidová vazba nastane, když mají dva uhlíky odlišnou stereochemii. Jedním z komplikujících problémů je, že konformace alfa a beta byly původně definovány na základě relativní orientace hlavních složek v Haworthově projekci. V tomto případě pro D-cukry, konformace beta by viděla hlavní složku na každém uhlíku nakresleném nad rovinou kruhu (nominálně stejná konformace), zatímco alfa by viděla anomerní složku pod kruhem (nominálně opačné konformace). Pro L-cukry, definice by se pak nutně obrátila. To stojí za zmínku, protože tyto starší definice stále prostupují literaturou a mohou vést ke zmatku.
Farmakologové se k látkám často připojují kyselina glukuronová prostřednictvím glykosidových vazeb, aby se zvýšila jejich voda rozpustnost; toto je známé jako glukuronidace. Mnoho jiných glykosidy mají důležité fyziologické funkce.
Chemické přístupy
Nüchter et al. (2001) prokázali nový přístup k Fischerova glykosidace.[3][4][5] Zaměstnávání a mikrovlnná trouba trouba vybavená refluxní zařízení v rotorovém reaktoru s tlakové bomby, Nüchter et al. (2001) byli schopni dosáhnout 100% výtěžku a- a β-D-glukosidů. Tuto metodu lze provádět na vícekilogramovém měřítku.
- Metoda Vishal Y Joshi
Joshi et al. (2006) [6] navrhnout metodu Koenigs-Knorr ve stereoselektivní syntéze alkyl-D-glukopyranosidů pomocí glykosylace, s výjimkou použití uhličitan lithný což je levnější a toxičtější než konvenční způsob použití stříbrný nebo rtuť soli. D-glukóza je nejprve chráněna tvorbou peracetát přidáním anhydrid kyseliny octové v octová kyselina a poté přidání bromovodík který bromuje v poloze 5. Po přidání alkoholu ROH a uhličitanu lithného nahradí OR brom a po deprotekci acetylovaných hydroxylových skupin se produkt syntetizuje v relativně vysoké čistotě. Navrhl to Joshi et al. (2001), že lithium působí jako nukleofil, který útočí na uhlík v poloze 5 a v přechodném stavu je alkohol nahrazen skupinou bromu. Mezi výhody této metody, jakož i její stereoselektivita a nízké náklady na lithnou sůl patří to, že ji lze provádět při teplotě místnosti a její výtěžek je relativně dobrý s konvenční metodou Koenigs-Knorr.[7]
Glykosidové hydrolázy
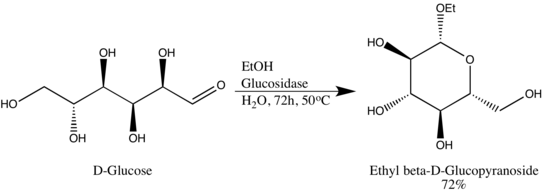
Glykosidové hydrolázy (nebo glykosidázy), jsou enzymy které porušují glykosidické vazby. Glykosidové hydrolázy mohou typicky působit buď na α- nebo na β-glykosidové vazby, ale ne na obě. Tato specificita umožňuje vědcům získat glykosidy ve vysokém epimerním přebytku, jedním příkladem je Wen-Ya Luova přeměna D-glukózy na ethyl-β-D-glukopyranosid pomocí přirozeně odvozené glukosidázy. Stojí za zmínku, že Wen-Ya Lu využila glukosidázu opačným způsobem, než je biologická funkce enzymu:[8]
Glykosyltransferázy
Před začleněním monosacharidových jednotek do glykoproteinů, polysacharidů nebo lipidy v živých organismech jsou obvykle nejprve "aktivovány" spojením prostřednictvím glykosidové vazby k fosfát skupina a nukleotid jako uridin difosfát (UDP), guanosin difosfát (HDP), thymidindifosfát (TDP) nebo cytidin monofosfát (CMP). Tyto aktivované biochemické meziprodukty jsou známé jako cukrové nukleotidy nebo dárci cukru. Mnoho biosyntetických drah používá mono- nebo oligosacharidy aktivované difosfátovou vazbou na lipidy, jako je dolichol. Tito aktivovaní dárci jsou potom substráty pro enzymy známé jako glykosyltransferázy, které převádějí jednotku cukru z aktivovaného dárce na přijímající nukleofil (akceptorový substrát).

Disacharidové fosforylázy
V posledních desetiletích byly vyvinuty různé biokatalytické přístupy k syntéze glykosidů, které pomocí „glykosyltransferáz“ a „glykosid hydroláz“ patří mezi nejběžnější katalýzu. První z nich často potřebuje drahé materiály a druhý často vykazuje nízké výtěžky, De Winter a kol.[9]zkoumané použití celobióza fosforyláza (CP) směrem k syntéze alfa-glykosidů v iontových kapalinách. Nejlepší podmínkou pro použití CP byla přítomnost IL AMMOENG 101 a ethylacetátu.
Směrované glykosylace
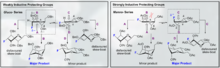
Existuje několik chemických přístupů, které podporují selektivitu α- a β-glykosidové vazby. Vysoce substrátově specifická povaha selektivity a celková aktivita pyranosidu může poskytnout hlavní syntetické potíže. Celková specificita glykosylace může být zlepšena využitím přístupů, které berou v úvahu relativní přechodové stavy, kterým může anomerní uhlík projít během typické glykosylace. Nejpozoruhodnější je, že rozpoznání a začlenění Felkin-Ahn-Eisensteinových modelů do racionálního chemického designu může obecně poskytnout spolehlivé výsledky za předpokladu, že transformace může podstoupit tento typ konformační kontroly v přechodovém stavu.
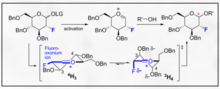
Glykosylace zaměřené na fluor představují povzbudivou manipulaci jak pro B selektivitu, tak pro zavedení nepřirozené biomimetické funkce C2 na sacharid. Jeden inovativní příklad poskytnutý Bucherem a kol. poskytuje způsob, jak využít fluoroxoniový iont a trichloracetimidát k podpoře stereoselektivity B prostřednictvím gauche efektu. Tato rozumná stereoselektivita je jasná prostřednictvím vizualizace Felkin-Ahnových modelů možných forem židlí.
Tato metoda představuje povzbudivý způsob k selektivní inkorporaci B-ethylu, isopropylu a dalších glykosidů s typickou chemií trichloracetimidátu.
O-vázané glykopeptidy; farmaceutické použití O-glykosylovaných peptidů
Nedávno bylo prokázáno, že O-vázané glykopeptidy vykazují vynikající propustnost a účinnost pro CNS na mnoha zvířecích modelech s chorobnými stavy. Navíc jedním z nejzajímavějších aspektů je schopnost O-glykosylace prodloužit poločas, snížit clearance a zlepšit její PK / PD aktivní peptid nad rámec zvýšení penetrace CNS. Vrozené využití cukrů jako solubilizujících skupin v metabolismu fáze II a III (kyseliny glukuronové) pozoruhodně umožnilo evoluční výhodu v tom, že savčí enzymy nejsou přímo vyvíjeny k degradaci O glykosylovaných produktů na větších skupinách.
Zvláštní povahou O vázaných glykopeptidů je, že existuje řada příkladů, které jsou penetrantem CNS. Předpokládá se, že základním základem tohoto účinku je „skákání membrány“ nebo „difúze chmele“. Předpokládá se, že proces „chmelové difúze“ poháněný jiným než Brownovým pohybem nastává v důsledku diskontinuity plazmatické membrány. „Chmelová difúze“ zejména kombinuje volnou difúzi a mezikomparmentální přechody. Nedávné příklady zejména zahrnují vysokou permeabilitu analogů met-enkefalinu mezi jinými peptidy. Plný agonista mOR pentapeptid DAMGO je také penetrantem CNS po zavedení glykosylace.[10][11][12][13]
Reference
- ^ „Nomenklatura sacharidů (doporučení 1996)“. Department of Chemistry, Queen Mary University of London.
- ^ Bertozzi, Carolyn; Rabuka, David (2009). „Strukturální základ rozmanitosti glykanu“. Základy glykobiologie. 2. vydání. NCBI. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna. ISBN 9780879697709.
- ^ Fischer, Emil (1893). „Ueber die Glucoside der Alkohole“. Berichte der deutschen chemischen Gesellschaft. 26 (3): 2400–2412. doi:10,1002 / cber.18930260327.
- ^ Fischer, Emil (1895). „Ueber die Verbindungen der Zucker mit den Alkoholen und Ketonen“. Berichte der Deutschen Chemischen Gesellschaft. 28 (1): 1145–1167. doi:10,1002 / cber.189502801248. ISSN 1099-0682.
- ^ Nüchter, Matthias; Ondruschka, Bernd; Lautenschläger, Werner (2001). „Mikrovlnná syntéza alkylglykosidů“. Syntetická komunikace. 31 (9): 1277–1283. doi:10.1081 / scc-100104035. ISSN 0039-7911.
- ^ Vishal Y Joshi, Manohar R Sawant (2006). "Pohodlná stereoselektivní syntéza β-D-glukopyranosidů". Indian Journal of Chemistry. 45B: 461–465.
- ^ Wilhelm Koenigs a Edward Knorr (1901). „Ueber einige Derivate des Traubenzuckers und der Galactose (p)“. Berichte der deutschen chemischen Gesellschaft 34 (1): 957–981.
- ^ A b Wen-Ya Lu, Guo-Qiang Lin, Hui-Lei Yu, Ai-Ming Tong, Jian-He Xu (2009-12-09). Whittall J, Sutton PW (eds.). Praktické metody pro biokatalýzu a biotransformace. John Wiley & Sons. 236–239. ISBN 978-0-470-74859-6.
- ^ De Winter, Karel; Van Renterghem, Lisa; Wuyts, Kathleen; Pelantová, Helena; Křen, Vladimír; Soetaert, Wim; Desmet, Tom (2015). „Chemoenzymatic Synthesis of β-D Glucosides using Cellobiose Phosphorylase from Clostridium thermocellum“. Pokročilá syntéza a katalýza. 357 (8): 1961–1969. doi:10.1002 / adsc.201500077. ISSN 1615-4150.
- ^ Egleton, Richard D; Mitchell, Scott A; Huber, Jason D; Janders, Jaqueline; Stropová, Dagmar; Polt, Robin; Yamamura, Henry I; Hruby, Victor J; Davis, Thomas P (2000-10-20). "Vylepšená biologická dostupnost glykosylovaných analogů Met-enkefalinu pro mozek". Výzkum mozku. 881 (1): 37–46. doi:10.1016 / S0006-8993 (00) 02794-3. PMID 11033091.
- ^ Polt, Robin; Dhanasekaran, Muthu; Keyari, Charles M. (01.09.2005). „Glykosylované neuropeptidy: nový pohled na neuropsychofarmakologii?“. Recenze lékařského výzkumu. 25 (5): 557–585. doi:10.1002 / med.20039. ISSN 0198-6325. PMID 16075406.
- ^ Polt, Robin; Dhanasekaran, Muthu; Keyari, Charles M. (01.09.2005). „Glykosylované neuropeptidy: nový pohled na neuropsychofarmakologii?“. Recenze lékařského výzkumu. 25 (5): 557–585. doi:10.1002 / med.20039. ISSN 1098-1128. PMID 16075406.
- ^ Egleton, Richard D .; Bilsky, Edward J .; Tollin, Gordon; Dhanasekaran, Muthu; Lowery, John; Alves, Isabel; Davis, Peg; Porreca, Frank; Yamamura, Henry I. (10.01.2005). „Biaziánské glykopeptidy pronikají hematoencefalickou bariérou“. Čtyřstěn: Asymetrie. Věda o sacharidech. Část 1. 16 (1): 65–75. doi:10.1016 / j.tetasy.2004.11.038.
- Marco Brito-Arias, „Syntéza a charakterizace glykosidů“, druhé vydání, Editorial Springer 2016.
externí odkazy
- Definice glykosidů, od IUPAC Kompendium chemické terminologie, „Zlatá kniha "
- Varki A et al. Základy glykobiologie. Cold Spring Harbor Laboratory Press; 1999. Prohledávatelné online