Uzamčená nukleová kyselina - Locked nucleic acid
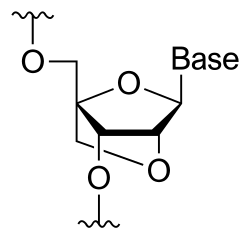
A uzamčená nukleová kyselina (LNA), také známý jako přemostěná nukleová kyselina (BNA),[1] a často označované jako nepřístupná RNA, je upravený RNA nukleotid ve kterém je ribózová část modifikována zvláštním můstkem spojujícím 2 'kyslík a 4' uhlík. Most „uzamkne“ ribózu ve 3'-endo (Severní) konformace, která se často vyskytuje v Formulář A. duplexy. Tuto strukturu lze připsat zvýšené stabilitě proti enzymatické degradaci;[2][3][4][5] navíc struktura LNA má zlepšenou specificitu a afinitu jako monomer nebo složka oligonukleotidu.[6] LNA nukleotidy mohou být smíchány se zbytky DNA nebo RNA v oligonukleotidu, ve skutečnosti hybridizují s DNA nebo RNA podle pravidel párování bází Watson-Crick.
Syntéza
Obika a kol. byli první, kdo chemicky syntetizovali LNA v roce 1997,[7] nezávisle na tom následovala skupina Jespera Wengela v roce 1998.[8] To bylo možné poté, co Zamecnick a Stephenson položili základy možnosti oligonukleotidy jako skvělí agenti pro řízení genové exprese v roce 1978.[9] Do dnešního dne se ukázalo, že dva různé přístupy, lineární a konvergentní strategie, produkují vysoký výtěžek a efektivní LNA. Lineární strategie syntézy byla poprvé podrobně popsána v pracích Obika et al.[7] V tomto přístupu uridin (nebo jakákoli snadno dostupná RNA nukleosid ) lze použít jako výchozí materiál. Konvergentní strategie vyžaduje syntézu meziproduktu cukru, který slouží a glykosyl dárce nezbytný pro spojení s nukleové báze. Běžně D-glukóza se používá k výrobě meziproduktu cukru, který se následně nechá reagovat s nukleovými bázemi za použití modifikovaného Vorbrügenova postupu umožňujícího stereoselektivní kopulaci.[10]
Přidání různých skupin zůstalo možností při zachování klíčových fyzikálně-chemických vlastností, jako je vysoká afinita a specificita evidentní v původně syntetizované LNA.[8] Takové oligomery jsou syntetizovány chemicky a jsou komerčně dostupné.
LNAzymy (LNA-Modified DNAzymy )
LNAzymy jsou obecně endonukleázy které se vážou na specifické cílové sekvence RNA a štěpí fosfodiesterová vazba který existuje mezi nukleotidy.[11] Díky své biologické stabilitě ve srovnání s biologickou se staly prominentní metodou pro terapeutické a biotechnologické aplikace nukleové kyseliny. Běžně označované jako LNAzymy, vědci vyvinuli oligonukleotidy modifikované LNA a prokázali pozoruhodnou hybridizaci s RNA, ssDNA, a dsDNA a usnadňuje opravu nesouladu v přirozené DNA.[12] Pokud jde o katalytickou aktivitu LNAzymů, efektivnější štěpení fosfodiesterové vazby v substrátech RNA byl zaznamenán ve srovnání s DNAzymy.[13] Úprava ramen pro rozpoznávání substrátu DNAzymy s LNA monomery získá LNAzym, který rozpozná coxsackievirus A21 (CAV-21) a štěpí svůj RNA cílová sekvence podobná sekvenci v 5 'nepřekládaná oblast (5 'UTR) člověka rhinovirus -14 (HRV-14); sekvence nerozpoznaná nemodifikovanými DNAzymy.[14]
Aplikace v terapeutice a biotechnologii
Oligonukleotidy modifikované LNA jsou slibnou volbou ve vývoji terapeutik díky své vysoké stabilitě v biologickém prostředí a preferenční hybridizaci. Pomocí LNA založené oligonukleotidy terapeuticky je rozvíjející se pole v biotechnologie.[15] Byla hodnocena řada LNA oligonukleotidů z hlediska jejich farmakokinetických a toxických profilů. Studie dospěly k závěru, že toxicita LNA je obecně nezávislá na oligonukleotidové sekvenci a vykazuje preferenční bezpečnostní profil pro translatovatelné terapeutické aplikace.[8] Alelově specifická PCR pomocí LNA umožňuje návrh kratších primerů, aniž by byla ohrožena vazebná specificita.[16] LNA byla navíc začleněna do fluorescence in situ hybridizace (FISH).[17] FISH je běžná technika používaná k vizualizaci genetického materiálu v různých buňkách, avšak předchozí studie poznamenávají, že tato technika byla omezena nízkou účinností hybridizace sondy. Naopak sondy začleněné do LNA prokázaly zvýšenou účinnost hybridizace u obou DNA a RNA. Vylepšená účinnost FISH začleněného do LNA vedla k úspěšné analýze FISH lidského chromozomu, několika typů buněk jiných než člověk a mikročipů. Byly provedeny také testy genotypování LNA, konkrétně pro detekci mutace v apolipoprotein B.[17] LNA byla zkoumána pro své terapeutické vlastnosti při léčbě rakoviny a infekčních onemocnění. Byla vyvinuta nová uzamčená molekula fosforothioátu nukleové kyseliny antisense, označovaná jako SPC2996, zaměřená na mRNA kódující onkoprotein Bcl-2, protein, který inhibuje apoptózu v buňkách chronické lymfocytární leukémie (CLL). Klinické studie fáze I a II prokázaly na dávce závislé snížení cirkulujících CLL buněk u přibližně 30% populace vzorku, nicméně omezení a náklady na tuto studii vyzývají k dalšímu zkoumání SPC2996.[18] LNA byla také použita pro Miravirsen, experimentální léčivo určené k léčbě Hepatitida C., tvořící 15-nukleotidovou fosforothioátovou sekvenci s vazebnou specificitou pro MiR-122 (A miRNA vyjádřen v hepatocyty ).[19][20] Nové aplikace LNA by mohly vylepšit mnoho forem DNA a ve skutečnosti se přidávají k enzymům nebo lékům jako regulační mechanismus. LNA prokázala slib v genová terapie pro jeho potenciál regulovat genovou expresi, ale ukázaly smíšené výsledky v antisense studiích.[15] Vzhledem ke své vysoké afinitě k diskriminaci nesouladu byla LNA studována pro její aplikace v diagnostických nástrojích. Imobilizované sondy LNA byly úspěšně zavedeny v multiplexu Genotypizace SNP test, indikace, že se v budoucnu může na trhu objevit diagnostika zabudovaná do LNA.[15]
Reference
- ^ Elayadi, Anissa N .; Braasch, Dwaine A .; Corey, David R. (srpen 2002). „Důsledky vysokoafinitní hybridizace blokovanými oligomery nukleových kyselin pro inhibici lidské telomerázy †“. Biochemie. 41 (31): 9973–9981. doi:10.1021 / bi025907j. ISSN 0006-2960.
- ^ Kurreck, J. (01.05.2002). "Návrh antisense oligonukleotidů stabilizovaných uzamčenými nukleovými kyselinami". Výzkum nukleových kyselin. 30 (9): 1911–1918. doi:10.1093 / nar / 30.9.1911. PMC 113840. PMID 11972327.
- ^ Frieden, M. (01.11.2003). „Rozšíření horizontu antisense oligonukleotidů o alfa-L-LNA“. Výzkum nukleových kyselin. 31 (21): 6365–6372. doi:10.1093 / nar / gkg820. ISSN 1362-4962. PMC 275462. PMID 14576324.
- ^ Frieden, Miriam; Hansen, Henrik F .; Koch, Troels (říjen 2003). "Nukleázová stabilita LNA oligonukleotidů a LNA-DNA chimér". Nukleosidy, nukleotidy a nukleové kyseliny. 22 (5–8): 1041–1043. doi:10.1081 / NCN-120022731. ISSN 1525-7770.
- ^ Morita, K .; Hasegawa, C .; Kaneko, M .; Tsutsumi, S .; Sone, J .; Ishikawa, T .; Imanishi, T .; Koizumi, M. (2001-11-01). „2'-O, 4'-C-ethylenem přemostěné nukleové kyseliny (ENA) s odolností vůči nukleázám a vysokou afinitou k RNA“. Série sympozií o nukleových kyselinách. 1 (1): 241–242. doi:10.1093 / nass / 1.1.241. ISSN 0261-3166.
- ^ Veedu, Rakesh; Wengel, Jesper (2011). Léčivá chemie nukleových kyselin. John Wiley & Sons, Inc. str. 335–337. ISBN 0470596686.
- ^ A b Obika, Satoshi; Nanbu, Daishu; Hari, Yoshiyuki; Morio, Ken-ichiro; In, Yasuko; Ishida, Toshimasa; Imanishi, Takeshi (1997-12-15). "Syntéza 2'-O, 4'-C-methylenuridinu a -cytidinu. Nové bicyklické nukleosidy s pevným svraštěním C3, -endo cukru". Čtyřstěn dopisy. 38 (50): 8735–8738. doi:10.1016 / S0040-4039 (97) 10322-7. ISSN 0040-4039.
- ^ A b C Orum, Miriam Frieden a Henrik (2008-03-31). „Uzamčená nukleová kyselina má příslib v léčbě rakoviny“. Současný farmaceutický design. doi:10.2174/138161208784246234. Citováno 2020-10-06.
- ^ Zamecnik, P. C .; Stephenson, M. L. (01.01.1978). „Inhibice replikace viru Rousova sarkomu a transformace buněk specifickým oligodeoxynukleotidem“. Sborník Národní akademie věd. 75 (1): 280–284. doi:10.1073 / pnas.75.1.280. ISSN 0027-8424. PMC 411230. PMID 75545.
- ^ Koshkin, Alexei A .; Fensholdt, Jef; Pfundheller, Henrik M .; Lomholt, Christian (2001-12-01). „Zjednodušená a efektivní cesta k 2'-O, 4'-C-methylenovým vázaným cyklickým ribonukleosidům (uzavřená nukleová kyselina)". The Journal of Organic Chemistry. 66 (25): 8504–8512. doi:10.1021 / jo010732p. ISSN 0022-3263.
- ^ Breaker, R. R .; Joyce, G. F. (prosinec 1994). „Enzym DNA, který štěpí RNA“. Chemie a biologie. 1 (4): 223–229. doi:10.1016/1074-5521(94)90014-0. ISSN 1074-5521. PMID 9383394.
- ^ Veedu, Rakesh N .; Vester, Birte; Wengel, Jesper (2007-03-26). „Enzymatické zabudování LNA nukleotidů do pramenů DNA“. ChemBioChem. 8 (5): 490–492. doi:10.1002 / cbic.200600501.
- ^ Vester, Birte; Lundberg, Lars Bo; Sørensen, Mads D .; Babu, B. Ravindra; Douthwaite, Stephen; Wengel, Jesper (listopad 2002). „LNAzymy: Začlenění monomerů typu LNA do DNAzymů výrazně zvyšuje štěpení RNA“. Journal of the American Chemical Society. 124 (46): 13682–13683. doi:10.1021 / ja0276220. ISSN 0002-7863.
- ^ Schubert, Steffen; Fürste, Jens P; Werk, Denise; Grunert, Hans-Peter; Zeichhardt, Heinz; Erdmann, Volker A; Kurreck, Jens (květen 2004). „Získání cílového přístupu pro deoxyribozymy“. Journal of Molecular Biology. 339 (2): 355–363. doi:10.1016 / j.jmb.2004.03.064.
- ^ A b C Petersen M, Wengel J (únor 2003). „LNA: univerzální nástroj pro terapeutiku a genomiku“. Trendy v biotechnologii. 21 (2): 74–81. doi:10.1016 / S0167-7799 (02) 00038-0. PMID 12573856.
- ^ Bonetta L (2005). "Hlavní čas pro PCR v reálném čase". Nat. Metody. 2 (4): 305–312. doi:10.1038 / nmeth0405-305.
- ^ A b Kubota, Kengo; Ohashi, Akiyoshi; Imachi, Hiroyuki; Harada, Hideki (srpen 2006). „Vylepšená účinnost hybridizace in situ pomocí DNA sond zabudovaných pomocí nukleové kyseliny“. Aplikovaná a environmentální mikrobiologie. 72 (8): 5311–5317. doi:10.1128 / AEM.03039-05. ISSN 0099-2240. PMC 1538721. PMID 16885281.
- ^ Dürig, J .; Dührsen, U .; Klein-Hitpass, L .; Worm, J .; Hansen, J. B. Rode; Ørum, H .; Wissenbach, M. (duben 2011). „Nový antisense inhibitor Bcl-2 SPC2996 způsobuje rychlou clearance leukemických buněk a imunitní aktivaci u chronické lymfocytární leukémie“. Leukémie. 25 (4): 638–647. doi:10.1038 / leu.2010.322. ISSN 1476-5551.
- ^ Gebert, Luca F. R .; Rebhan, Mario A. E .; Crivelli, Silvia E. M .; Denzler, Rémy; Stoffel, Markus; Hall, Jonathan (01.01.2014). „Miravirsen (SPC3649) může inhibovat biogenezi miR-122“. Výzkum nukleových kyselin. 42 (1): 609–621. doi:10.1093 / nar / gkt852. ISSN 0305-1048. PMC 3874169. PMID 24068553.
- ^ Bonneau, E .; Neveu, B .; Kostantin, E .; Tsongalis, G.J .; De Guire, V. (2019-06-24). „Jak blízko jsou miRNA z klinické praxe? Pohled na diagnostický a terapeutický trh“. EJIFCC. 30 (2): 114–127. ISSN 1650-3414. PMC 6599191. PMID 31263388.
