Abakavir - Abacavir - Wikipedia
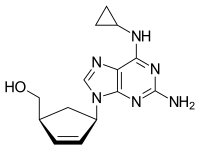 | |
 Chemická struktura abakaviru | |
| Klinické údaje | |
|---|---|
| Výslovnost | /əˈb…kəproti.r/ ( |
| Obchodní názvy | Ziagen, další[1] |
| AHFS /Drugs.com | Monografie |
| MedlinePlus | a699012 |
| Licenční údaje | |
| Těhotenství kategorie |
|
| Trasy z správa | Ústy (roztok nebo tablety) |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Biologická dostupnost | 83% |
| Metabolismus | Játra |
| Odstranění poločas rozpadu | 1,54 ± 0,63 h |
| Vylučování | Ledviny (1,2% abakaviru, 30% metabolitu kyseliny 5'-karboxylové, 36% metabolitu 5'-glukuronidu, 15% neidentifikovaných minoritních metabolitů). Fekální (16%) |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| NIAID ChemDB | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.149.341 |
| Chemické a fyzikální údaje | |
| Vzorec | C14H18N6Ó |
| Molární hmotnost | 286.339 g · mol−1 |
| 3D model (JSmol ) | |
| Bod tání | 165 ° C (329 ° F) |
| |
| |
| (ověřit) | |
Abakavir, prodávané pod značkou Ziagen, je léky používá se k prevenci a léčbě HIV / AIDS.[1][2] Podobně jako ostatní nukleosidový analog inhibitory reverzní transkriptázy (NRTI), abakavir se používá společně s dalšími Léky na HIV, a sám o sobě se nedoporučuje.[3] Užívá se ústy jako tableta nebo roztok a lze jej použít u dětí starších tří měsíců.[1][4]
Abakavir je obecně dobře snášen.[4] Mezi časté nežádoucí účinky patří zvracení, problémové spaní horečka a pocit únavy.[1] Mezi závažnější nežádoucí účinky patří přecitlivělost, poškození jater, a laktátová acidóza.[1] Genetické testování může naznačovat, zda je u osoby vyšší riziko vzniku přecitlivělosti.[1] Mezi příznaky přecitlivělosti patří vyrážka, zvracení a dušnost.[4] Abakavir patří do skupiny léků NRTI, které působí blokováním reverzní transkriptáza, enzym potřebný pro Virus HIV replikace.[5] Ve třídě NRTI je abakavir a karbocyklický nukleosid.[1]
Abakavir byl patentován v roce 1988 a pro použití ve Spojených státech schválen v roce 1998.[6][7] Je na Seznam základních léčivých přípravků Světové zdravotnické organizace.[8] Je k dispozici jako generické léky.[1] Abakavir se běžně používá spolu s dalšími léky proti HIV, jako je abakavir / lamivudin / zidovudin, abakavir / dolutegravir / lamivudin, a abakavir / lamivudin.[4][5] Kombinace abakavir / lamivudin je také nezbytným lékem.[8]
Lékařské použití
Tablety a perorální roztok abakaviru v kombinaci s jinými antiretrovirovými látkami jsou indikovány k léčbě infekce HIV-1.
Abakavir by měl být vždy používán v kombinaci s jinými antiretrovirovými látkami. Abakavir by neměl být přidáván jako monoterapie, pokud jsou antiretrovirové režimy změněny kvůli ztrátě virologické odpovědi.
Vedlejší efekty
Mezi běžné nežádoucí účinky patří nevolnost, bolest hlavy, únava, zvracení, průjem, ztráta chuti k jídlu a potíže se spánkem. Vzácné, ale závažné nežádoucí účinky zahrnují hypersenzitivní reakce, jako je vyrážka, zvýšené AST a ALT, deprese, úzkost, horečka / zimnice, URI, laktátová acidóza, hypertriglyceridémie a lipodystrofie.[9][10]
Lidé s onemocněním jater by měli být při používání abakaviru opatrní, protože to může zhoršit jejich stav. Mezi příznaky problémů s játry patří nevolnost a zvracení, bolesti břicha, tmavě zbarvená moč, zežloutnutí kůže a zežloutnutí očního bělma. Použití nukleosid léky, jako je abakavir, mohou velmi zřídka způsobit laktátová acidóza. Mezi příznaky laktátové acidózy patří rychlý nebo nepravidelný srdeční rytmus, neobvyklá bolest svalů, únava, potíže s dýcháním a bolesti žaludku s nevolností a zvracením.[11] Abakavir může také vést k imunitní rekonstituci zánětlivého syndromu, ke změně tělesného tuku a ke zvýšenému riziku infarktu.[nutná lékařská citace ]
Rezistence na abakavir se vyvinula v laboratorních verzích HIV, které jsou také rezistentní na další antiretrovirotika specifická pro HIV, jako je lamivudin, didanosin, a zalcitabin. Kmeny HIV, které jsou rezistentní na inhibitory proteázy není pravděpodobné, že budou rezistentní na abakavir.[nutná lékařská citace ]
Abakavir je kontraindikován pro použití u kojenců mladších tří měsíců.[nutná lékařská citace ]
O účincích předávkování abakavirem je známo málo. Oběti předávkování by měly být převezeny na ošetřovnu do nemocnice.[nutná lékařská citace ]
Syndrom přecitlivělosti
Přecitlivělost abakavir je silně spojen se specifickou alelou v lidský leukocytový antigen B místo a to HLA-B * 5701.[12][13][14] Existuje prevalence mezi prevalencí HLA-B * 5701 a předky. Prevalence alela se odhaduje na průměrně 3,4 až 5,8 procenta v populacích evropských předků, 17,6 procent v roce Indičtí Američané, 3,0 procenta u hispánských Američanů a 1,2 procenta v USA Čínští Američané.[15][16] Existuje významná variabilita prevalence HLA-B * 5701 mezi africkými populacemi. v afro Američané, prevalence se odhaduje na průměrně 1,0 procenta, v Yoruba z Nigérie, 3,3 procenta v EU Luhya z Keňa a 13,6 procenta v EU Masai z Keni, i když průměrné hodnoty jsou odvozeny z vysoce variabilních frekvencí v rámci skupin vzorků.[17]
Mezi běžné příznaky syndromu přecitlivělosti na abakavir patří horečka, nevolnost, nevolnost, a průjem. U některých pacientů se může také vyvinout a vyrážka.[18] Příznaky AHS se obvykle projeví během šesti týdnů léčby abakavirem, i když mohou být zaměněny s příznaky HIV, syndrom imunitní rekonstituce, syndromy přecitlivělosti spojené s jinými léky nebo infekce.[19] Spojené státy. Úřad pro kontrolu potravin a léčiv (FDA) zveřejnila dne 24. července 2008 varování týkající se abakaviru a léčivých přípravků obsahujících abakavir,[20] a štítek léku schválený FDA pro abakavir doporučuje pre-terapeutický screening na alelu HLA-B * 5701 a použití alternativní terapie u subjektů s touto alelou.[21] Konsorcium pro implementaci klinické farmakogenetiky a nizozemská pracovní skupina pro farmakogenetiku dále doporučují použití alternativní terapie u jedinců s alelou HLA-B * 5701.[22][23]
Testování kožních náplastí lze také použít k určení, zda u jedince dojde k reakci přecitlivělosti na abakavir, ačkoli někteří pacienti náchylní k rozvoji AHS nemusí reagovat na test náplasti.[24]
Vývoj podezření na hypersenzitivní reakce na abakavir vyžaduje okamžité a trvalé přerušení léčby abakavirem u všech pacientů, včetně pacientů, kteří nemají alelu HLA-B * 5701. Dne 1. března 2011 informovala FDA veřejnost o probíhajícím přezkumu bezpečnosti abakaviru a možném zvýšeném riziku srdečního záchvatu spojeného s touto drogou.[25] A metaanalýza z 26 studií provedených FDA však nenalezlo žádnou souvislost mezi užíváním abakaviru a infarktem [26][27]
Imunopatogeneze
Mechanismus, který je základem syndromu přecitlivělosti na abakavir, souvisí se změnou HLA-B * 5701 protein produkt. Abakavir se váže s vysokou specificitou na protein HLA-B * 5701 a mění tvar a chemii štěrbiny vázající antigen. To má za následek změnu v imunologická tolerance a následná aktivace specifická pro abakavir cytotoxické T buňky, které vyvolávají systémovou reakci známou jako syndrom přecitlivělosti na abakavir.[28]
Interakce
Abakavir a obecně NRTI nepodléhají jaternímu metabolismu, a proto mají velmi omezenou (žádnou) interakci s enzymy CYP a léky, které tyto enzymy ovlivňují. Jak již bylo řečeno, stále existuje několik interakcí, které mohou ovlivnit absorpci nebo dostupnost abakaviru. Níže uvádíme několik běžně zavedených interakcí s léky a potravinami, ke kterým může dojít při současném podávání abakaviru:
- Inhibitory proteázy jako tipranavir nebo ritonovir může snížit sérovou koncentraci abakaviru indukcí glukuronidace. Abakavir je metabolizován oběma alkohol dehydrogenáza a glukuronidace.[29][30]
- Ethanol může mít za následek zvýšené hladiny abakaviru inhibicí alkohol dehydrogenázy. Abakavir je metabolizován jak alkoholdehydrogenázou, tak glukuronidací.[29][31]
- Metadon může snížit terapeutický účinek abakaviru. Abakavir může snižovat sérovou koncentraci metadonu.[32][33]
- Orlistat může snížit sérovou koncentraci antiretrovirových léků. Mechanismus této interakce není plně stanoven, ale existuje podezření, že je způsobena sníženou absorpcí abakaviru orlistatem.[34]
- Kabozantinib: Léky z rodiny inhibitorů MPR2 (inhibitory proteinu 2 spojené s rezistencí na více léků), jako je abakavir, mohou zvyšovat sérovou koncentraci kabozantinibu.[35]
Mechanismus účinku
Abakavir je a inhibitor nukleosidové reverzní transkriptázy který inhibuje virová replikace. Je to guanosin analog, který je fosforylován na karbovir trifosfát (CBV-TP). CBV-TP soutěží s virovými molekulami a je zabudován do viru DNA. Jakmile je CBV-TP integrován do virové DNA, transkripce a HIV reverzní transkriptáza je potlačen.[36]
Farmakokinetika
Abakavir se podává perorálně a rychle se vstřebává biologická dostupnost 83%. Roztok a tableta mají srovnatelné koncentrace a biologickou dostupnost. Abakavir lze užívat s jídlem nebo bez jídla.[nutná lékařská citace ]
Abakavir může procházet přes hematoencefalická bariéra. Abakavir je metabolizován primárně prostřednictvím enzymů alkohol dehydrogenáza a glukuronyltransferáza na neaktivní karboxylát a glukuronid metabolity. Má to poločas rozpadu přibližně 1,5 - 2,0 hodiny. Pokud osoba má selhání jater, poločas abakaviru se zvýšil o 58%.[nutná lékařská citace ]
Abakavir je vylučován vylučováním močí (83%) a stolicí (16%). Není jasné, zda lze abakavir odstranit hemodialýza nebo peritoneální dialýza.[36]
Dějiny
Robert Vince a Susan Daluge spolu s hostujícím vědcem z Číny Mei Hua vyvinuli lék v 80. letech.[37][38][39]
Abakavir byl schválen USA Úřad pro kontrolu potravin a léčiv (FDA) dne 18. prosince 1998, a je tak patnáctým schváleným antiretrovirovým lékem ve Spojených státech.[Citace je zapotřebí ] Jeho patent vypršel ve Spojených státech dne 26. prosince 2009.[Citace je zapotřebí ]
Syntéza

Reference
- ^ A b C d E F G h "Abacavir Sulfate". Americká společnost farmaceutů zdravotnického systému. Archivováno z původního dne 21. srpna 2017. Citováno 31. července 2015.
- ^ „Zkratky názvu léku Pokyny pro ARV pro dospělé a dospívající“. AIDSinfo. Archivováno z původního dne 9. listopadu 2016. Citováno 8. listopadu 2016.
- ^ „Co nepoužívat pokyny ARV pro dospělé a dospívající“. AIDSinfo. Archivováno z původního dne 9. listopadu 2016. Citováno 8. listopadu 2016.
- ^ A b C d Yuen GJ, Weller S, Pakes GE (2008). „Přehled farmakokinetiky abakaviru“. Klinická farmakokinetika. 47 (6): 351–71. doi:10.2165/00003088-200847060-00001. PMID 18479171. S2CID 31107341.
- ^ A b „Nukleosidové inhibitory reverzní transkriptázy (NRTI nebo„ atomovky “) - HIV / AIDS“. www.hiv.va.gov. Archivováno z původního dne 9. listopadu 2016. Citováno 8. listopadu 2016.
- ^ Fischer, Janos; Ganellin, C. Robin (2006). Analogový objev drog. John Wiley & Sons. p. 505. ISBN 9783527607495. Archivováno z původního dne 8. září 2017.
- ^ Kane, Brigid M. (2008). Léky na léčbu HIV / AIDS. Publikování na Infobase. p. 56. ISBN 9781438102078. Archivováno z původního dne 8. září 2017.
- ^ A b Světová zdravotnická organizace (2019). Seznam základních léků Světové zdravotnické organizace: 21. seznam 2019. Ženeva: Světová zdravotnická organizace. hdl:10665/325771. WHO / MVP / EMP / IAU / 2019.06. Licence: CC BY-NC-SA 3.0 IGO.
- ^ „Nežádoucí účinky abakaviru“. Epocrates online.
- ^ Profesionální drogová fakta
- ^ "Abakavir". AIDSinfo. Archivováno z původního dne 6. března 2017. Citováno 8. listopadu 2016.
- ^ Mallal S, Phillips E, Carosi G a kol. (2008). „Screening HLA-B * 5701 na přecitlivělost na abakavir“. New England Journal of Medicine. 358 (6): 568–579. doi:10.1056 / nejmoa0706135. PMID 18256392.
- ^ Rauch A, Nolan D, Martin A a kol. (2006). „Prospektivní genetický screening snižuje výskyt hypersenzitivních reakcí na abakavir ve studii kohorty HIV v západní Austrálii“. Klinické infekční nemoci. 43 (1): 99–102. doi:10.1086/504874. PMID 16758424.
- ^ Dean L (2015). „Terapie abakavirem a genotyp HLA-B * 57: 01“. In Pratt VM, McLeod HL, Rubinstein WS, et al. (eds.). Shrnutí lékařské genetiky. Národní centrum pro biotechnologické informace (NCBI). PMID 28520363. ID police: NBK315783. Citováno 14. ledna 2019.
- ^ Hetherington S, Hughes AR, Mosteller M a kol. (2002). „Genetické variace v oblasti HLA-B a reakce přecitlivělosti na abakavir“. Lanceta. 359 (9312): 1121–1122. doi:10.1016 / s0140-6736 (02) 08158-8. PMID 11943262. S2CID 9434238.
- ^ Mallal S, Nolan D, Witt C a kol. (2002). „Souvislost mezi přítomností HLA * B5701, HLA-DR7 a HLA-DQ3 a přecitlivělostí na inhibitor abakaviru HIV-1 s reverzní transkriptázou“. Lanceta. 359 (9308): 727–732. doi:10.1016 / s0140-6736 (02) 07873-x. PMID 11888582. S2CID 12923232.
- ^ Rotimi CN, Jorde LB (2010). „Předky a nemoci ve věku genomické medicíny“. New England Journal of Medicine. 363 (16): 1551–1558. doi:10.1056 / nejmra0911564. PMID 20942671.
- ^ Phillips E, Mallal S (2009). "Úspěšný překlad farmakogenetiky na kliniku: příklad abakaviru". Molekulární diagnostika a terapie. 13 (1): 1–9. doi:10.1007 / bf03256308. ISSN 1177-1062. PMID 19351209. S2CID 45896364.
- ^ Phillips E, Mallal S (2007). "Přecitlivělost na HIV u HIV". Aktuální názor na alergii a klinickou imunologii. 7 (4): 324–330. doi:10.1097 / aci.0b013e32825ea68a. PMID 17620824. S2CID 37549824.
- ^ „Informace pro zdravotnické pracovníky: Abakavir (prodávaný jako Ziagen) a léky obsahující abakavir“. Úřad pro kontrolu potravin a léčiv (FDA). 24. července 2008. Archivovány od originál dne 11. prosince 2013. Citováno 29. listopadu 2013.
- ^ „Tableta ziagen- abacavir sulfátu, potahovaná etiketa“. DailyMed. 30. září 2015. Archivováno z původního dne 11. ledna 2017. Citováno 9. září 2019.
- ^ Swen JJ, Nijenhuis M, de Boer A, et al. (Květen 2011). "Farmakogenetika: od bench k bajtu - aktualizace pokynů". Clin Pharmacol Ther. 89 (5): 662–73. doi:10.1038 / clpt.2011.34. PMID 21412232. S2CID 2475005.
- ^ Martin MA, Hoffman JM, Freimuth RR a kol. (Květen 2014). „Pokyny konsorcia pro implementaci klinické farmakogenetiky pro dávkování genotypu HLA-B a abakaviru: aktualizace z roku 2014“. Clin Pharmacol Ther. 95 (5): 499–500. doi:10.1038 / clpt.2014.38. PMC 3994233. PMID 24561393.
- ^ Shear NH, Milpied B, Bruynzeel DP a kol. (2008). „Přehled testování náplasti na léky a důsledky pro klinické lékaře s HIV“. AIDS. 22 (9): 999–1007. doi:10.1097 / qad.0b013e3282f7cb60. PMID 18520343. S2CID 2972984.
- ^ „Sdělení FDA o bezpečnosti léčiv: Aktualizace hodnocení bezpečnosti abakaviru a možné zvýšené riziko srdečního záchvatu“. Úřad pro kontrolu potravin a léčiv (FDA). 1. března 2011. Citováno 9. září 2019.
- ^ „Upozornění FDA: Abacavir - Probíhající bezpečnostní kontrola: Možné zvýšené riziko infarktu“. Drugs.com. Archivováno z původního dne 10. prosince 2013. Citováno 29. listopadu 2013.
- ^ Ding X, Andraca-Carrera E, Cooper C a kol. (Prosinec 2012). „Žádná souvislost užívání abakaviru s infarktem myokardu: nálezy metaanalýzy FDA“. J Acquir Immune Defic Syndr. 61 (4): 441–7. doi:10.1097 / QAI.0b013e31826f993c. PMID 22932321. S2CID 7997822.
- ^ Illing PT, Vivian JP, Dudek NL a kol. (2012). „Imunní auto-reaktivita vyvolaná repertoárem HLA-peptidu modifikovaným léčivem“. Příroda. 486 (7404): 554–8. Bibcode:2012Natur.486..554I. doi:10.1038 / příroda11147. PMID 22722860. S2CID 4408811.
- ^ A b Informace o předepisování. Ziagen (abakavir). Research Triangle Park, NC: GlaxoSmithKline, červenec 2002
- ^ Vourvahis M, Kashuba AD (2007). "Mechanismy farmakokinetických a farmakodynamických lékových interakcí spojených s tipranavirem obohaceným o ritonavir". Farmakoterapie. 27 (6): 888–909. doi:10,1592 / phco.27.6.888. PMID 17542771. S2CID 23591048.
- ^ McDowell JA, Chittick GE, Stevens CP a kol. (2000). ""„Farmakokinetická interakce abakaviru (1592U89) a ethanolu u dospělých infikovaných virem lidské imunodeficience“. Antimikrobní látky Chemother. 44 (6): 1686–90. doi:10.1128 / aac.44.6.1686-1690.2000. PMC 89933. PMID 10817729.
- ^ Berenguer J, Pérez-Elías MJ, Bellón JM a kol. (2006). „Účinnost a bezpečnost abakaviru, lamivudinu a zidovudinu u pacientů dosud neinfikovaných HIV infikovaných antiretrovirovou léčbou: výsledky velké multicentrické observační kohorty“. J Acquir Immune Defic Syndr. 41 (2): 154–159. doi:10.1097 / 01.qai.0000194231.08207.8a. PMID 16394846. S2CID 17609676.
- ^ Dolofin (metadon) [informace o předepisování]. Columbus, OH: Roxane Laboratories, Inc .; Březen 2015.
- ^ Gervasoni C, Cattaneo D, Di Cristo V a kol. (2016). „Orlistat: ztráta hmotnosti za cenu oživení HIV“. J Antimicrob Chemother. 71 (6): 1739–1741. doi:10.1093 / jac / dkw033. PMID 26945709.
- ^ Cometriq (cabozantinib) [informace o předepisování]. South San Francisco, CA: Exelixis, Inc .; Květen 2016.
- ^ A b Informace o produktu: ZIAGEN® tablety pro perorální podání, perorální roztok, tablety pro perorální podání abakaviru, perorální roztok. ViiV Healthcare (na výrobce), Research Triangle Park, NC, 2015.
- ^ „Dr. Robert Vince - 2010 Inductee“. Síň slávy vynálezců v Minnesotě. Archivovány od originál dne 15. února 2016. Citováno 10. února 2016.
- ^ „Robert Vince, PhD (seznam fakult)“. University of Minnesota. Archivováno z původního dne 17. února 2016.
- ^ Daluge SM, Good SS, Faletto MB, et al. (Květen 1997). „1592U89, nový karbocyklický nukleosidový analog se silnou, selektivní aktivitou viru proti lidské imunodeficienci“. Antimikrobiální látky a chemoterapie. 41 (5): 1082–1093. doi:10.1128 / AAC.41.5.1082. PMC 163855. PMID 9145874.
- ^ Crimmins MT, King BW (1996). „Efektivní asymetrický přístup ke karbocyklickým nukleosidům: asymetrická syntéza látky 1592U89, silného inhibitoru reverzní transkriptázy HIV“. The Journal of Organic Chemistry. 61 (13): 4192–4193. doi:10.1021 / jo960708p. PMID 11667311.
Další čtení
- Dean L (duben 2018). „Terapie abakavirem a genotyp HLA-B * 57: 01“. In Pratt VM, McLeod HL, Rubinstein WS, et al. (eds.). Shrnutí lékařské genetiky. Národní centrum pro biotechnologické informace (NCBI). PMID 28520363.
externí odkazy
- "Abakavir". Informační portál o drogách. Americká národní lékařská knihovna.
- Cesta abakaviru na PharmGKB
- Pokyny pro dávkování abakaviru od Konsorcia pro implementaci klinické farmakogenetiky (CPIC)
- Pokyny pro dávkování abakaviru od Nizozemské pracovní skupiny pro farmakogenetiku (DPWG)

