Karboxylát - Carboxylate


A karboxylát je konjugovaná báze a karboxylová kyselina.
Karboxylátové soli jsou soli které mají obecný vzorec M (RCOO)n, kde M je kov a n je 1, 2, ...; estery karboxylátu mají obecný vzorec RCOOR '(nebo RCO2R '). R a R 'jsou organické skupiny; R ′ ≠ H.
A karboxylátový ion je konjugovaná báze karboxylové kyseliny, RCOO− (nebo (nebo RCO2−). Je to ion s záporný náboj.
Syntéza
Karboxylátové ionty mohou vznikat deprotonací karboxylových kyselin. Takové kyseliny mají obvykle pKA přibližně <5, což znamená, že mohou být deprotonovány mnoha bázemi, jako je např hydroxid sodný nebo hydrogenuhličitan sodný.
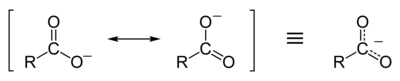
Rezonanční stabilizace karboxylátového iontu
Karboxylové kyseliny se snadno disociují na karboxylátový anion a kladně nabitý vodíkový ion (proton), mnohem snadněji než alkoholy (na alkoxid ion a proton), protože karboxylátový ion je stabilizován rezonance. Záporný náboj, který zbyl po deprotonace karboxylové skupiny se delokalizuje mezi těmito dvěma skupinami elektronegativní atomy kyslíku v rezonanční struktuře. Pokud je skupina R skupina odebírající elektrony (např -CF3 ), bazicita karboxylátu bude dále oslabena.
Tento delokalizace elektronového mraku znamená, že oba atomy kyslíku jsou méně silně záporně nabité; pozitivní proton je proto méně silně přitahován zpět ke karboxylátové skupině, jakmile opustí; karboxylátový iont je tedy stabilnější a méně bazický v důsledku rezonanční stabilizace záporného náboje. Naproti tomu an alkoxid iont, jakmile se vytvoří, bude mít na svém osamělém atomu kyslíku lokalizovaný silný záporný náboj, který by silně přitahoval všechny blízké protony (ve skutečnosti jsou alkoxidy velmi silné báze). Kvůli stabilizaci rezonance mají karboxylové kyseliny mnohem nižší pKa hodnoty (a jsou tedy silnějšími kyselinami) než alkoholy. Například hodnota pKa kyseliny octové je 4,9, zatímco ethanol má pKa 16. Kyselina octová je tedy mnohem silnější kyselinou než ethanol. To zase znamená, že pro ekvimolární roztoky karboxylové kyseliny a alkoholu by měla karboxylová kyselina mnohem nižší pH.
Reakce
Nukleofilní substituce
Karboxylátové ionty jsou dobré nukleofily. Reagují s alkylhalogenidy tvořit ester. Následující reakce ukazuje mechanismus reakce.
Nukleofilita karboxylátových iontů je mnohem slabší než nukleofilita hydroxid a alkoxid ionty, ale silnější než halogenid anionty (v a polární aprotické rozpouštědlo, i když existují i jiné efekty, jako je rozpustnost iontu).
Snížení
Na rozdíl od redukce esteru je redukce karboxylátu odlišná, kvůli nedostatku opouštějící skupina a atom uhlíku relativně bohatý na elektrony (kvůli negativnímu náboji na atomech kyslíku). S malým množstvím kyseliny dochází k reakci s lithiumaluminiumhydrid změnou LAH na a Lewisova kyselina, AlH3 v procesu, konverze oxyaniontu na 4 Al-O vazby.


Příklady
Tento seznam je určen pro případy, kdy existuje samostatný článek o aniontu nebo jeho derivátech. Všechny ostatní organické kyseliny by se měly nacházet v jejich mateřské karboxylové kyselině.
- Formát ion, HCOO−
- Acetát ion, CH3VRKAT−
- Butyrát ion, CH3(CH2)2VRKAT−
- Laktát ion, CH3CH (OH) COO−
- Methanetetrakarboxylát ion, C (COO−)4
- Šťavelan ion, (VRKAT)2−
2 - Jasmonate deriváty