Propionyl-CoA karboxyláza - Propionyl-CoA carboxylase - Wikipedia
| Propionyl-CoA karboxyláza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 6.4.1.3 | ||||||||
| Číslo CAS | 9023-94-3 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| Dekarboxyláza methylmalonyl-CoA | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 4.1.1.41 | ||||||||
| Číslo CAS | 37289-44-4 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Propionyl-CoA karboxyláza (PCC) katalyzuje karboxylace reakce propionyl CoA v mitochondriální matice. Enzym je biotin -závislý. Produktem reakce je (S) -methylmalonyl CoA. Propionyl CoA je konečným produktem metabolismu lichých řetězců mastných kyselin a je také metabolitem většiny methylových větví mastné kyseliny. Je také hlavním metabolitem valinu a společně s acetyl-CoA, je metabolit isoleucinu, stejně jako a methionin metabolit. Propionyl-CoA má tedy velký význam jako a glukóza předchůdce. (S) -methylmalonyl-CoA není zvířaty přímo využitelný; působí na něj racemáza za vzniku (R) -methylmalonyl-CoA. Ten je konvertován methylmalonyl-CoA mutázou (jedním z mála vitaminů B.12-závislé enzymy) sukcinyl-CoA. Ten se převede na oxaloacetát a pak malát v Krebsův cyklus. Export z malát do cytosolu vede k tvorbě oxaloacetát, fosfoenolpyruvát a další glukoneogenní meziprodukty.
- ATP + propionyl-CoA + HCO3− <=> ADP + fosfát + (S) -methylmalonyl-CoA
Byl klasifikován jako a ligáza[1] a a lyáza.[2]
Struktura enzymu
Propionyl-CoA karboxyláza (PCC) je 750 kDa alfa (6) -beta (6) -dodekamer. (Pouze přibližně 540 kDa je nativní enzym.[3] ) Alfa podjednotky jsou uspořádány jako monomery, které zdobí centrální beta-6 hexamerické jádro. Uvedené jádro je orientováno jako krátký válec s otvorem podél jeho osy.
Alfa podjednotka PCC obsahuje biotin karboxyláza (BC) a biotin domény karboxylového nosného proteinu (BCCP). Doména známá jako BT doména se také nachází na alfa podjednotce a je nezbytná pro interakce s beta podjednotkou. 8vláknová antiparalelní beta barel záhyb této domény je obzvláště zajímavý. Beta podjednotka obsahuje aktivitu karboxyltransferázy (CT).[4]

Místa BC a CT jsou od sebe vzdálena přibližně 55 Å, což svědčí o translokaci celé domény BCCP během katalýzy karboxylace z propionyl-CoA.[5] To poskytuje jasný důkaz o zásadní dimerní interakci mezi alfa a beta podjednotkami.
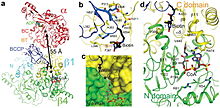
Kapsa na PCT vázající biotin je hydrofobní a vysoce konzervovaná. Biotin a propionyl-CoA se váží na sebe kolmo oxyanionový otvor -obsahující aktivní stránky. Bylo stanoveno, že poměr nativního enzymu k biotinu je jeden mol nativního enzymu ke 4 molům biotinu.[3] N1 biotinu je považována za aktivní místo báze.[4]
Místně zaměřená mutageneze na D422 ukazuje změnu substrátové specificity vazebného místa propionyl-CoA, což naznačuje důležitost tohoto zbytku v katalytické aktivitě PCC.[6] V roce 1979 inhibice fenylglyoxal stanoví, že fosfátová skupina buď z propionyl-CoA nebo ATP reaguje s esenciálním argininovým zbytkem v aktivním místě během katalýzy.[7] Později (2004) bylo navrženo, že Arginin-338 slouží k orientaci karboxyfosfátového meziproduktu pro optimální karboxylaci biotinu.[8]
The KM hodnoty pro ATP, propionyl-CoA a bikarbonát byly stanoveny jako 0,08 mM, 0,29 mM, respektive 3,0 mM. The izoelektrický bod klesá na pH 5,5. Strukturální integrita PCC je zachována v teplotním rozsahu -50 až 37 stupňů Celsia a rozmezí pH 6,2 až 8,8. Ukázalo se, že optimální pH je mezi 7,2 a 8,8 bez vazby na biotin.[3] S biotinem je optimální pH 8,0-8,5.[9]
Enzymový mechanismus
Normální mechanismus katalytické reakce zahrnuje a karbanion meziprodukt a nepostupuje ve vzájemné shodě.[10] Obrázek 3 ukazuje pravděpodobnou cestu.
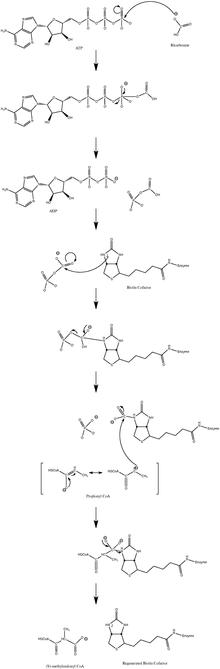
Ukázalo se, že reakce je mírně reverzibilní při nízkém toku propionyl-CoA.[11]
Isozymes
Lidé exprimují následující dvě propionyl-CoA karboxylázu isozymy:
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Patologie
Nedostatek je spojen s propionová acidemie.[12][13][14]
Aktivita PCC je dosud nejcitlivějším indikátorem stavu biotinu. V budoucích těhotenských studiích by se použití údajů o aktivitě PCC lymfocytů mělo ukázat jako cenné při hodnocení stavu biotinu.[15]
Intragenní komplementace
Když je více kopií polypeptidu kódovaných a gen tvoří agregát, je tato proteinová struktura označována jako multimer. Když se multimer vytvoří z polypeptidů produkovaných dvěma různými mutant alely konkrétního genu může smíšený multimer vykazovat větší funkční aktivitu než nemísené multimery vytvořené každou z mutantů samotných. V takovém případě je jev označován jako intragenní komplementace.
PCC je heteropolymer složený z podjednotek α a β v α6β6 struktura. Mutace v PCC může buď v podjednotce α (PCCα) nebo β podjednotce (PCCβ) způsobit propionová acidemie u lidí. Když různé mutantní kůže fibroblasty buněčné linie defektní v PCCp byly fúzovány v párových kombinacích, p heteromultimerní protein vytvořené jako výsledek často vykazovaly vyšší úroveň aktivity, než by se dalo očekávat na základě aktivit rodičovských enzymů.[16] Toto zjištění intragenní komplementace naznačil, že multimerní struktura PCC umožňuje kooperativní interakce mezi základními monomery PCCp, které mohou generovat funkčnější formu holoenzymu.
Nařízení
Propionyl-CoA karboxylázy
A. Karbamazepin (antiepileptikum): významně snižuje hladinu enzymů v játrech[17]
b. E-coli chaperonin proteiny groES a groEL: nezbytné pro skládání a sestavování lidských PCC heteromerních podjednotek[18]
C. Bikarbonát: negativní kooperativita[8]
d. Mg2+ a MgATP2−: alosterická aktivace[19]
Propionyl-CoA karboxylázou
A. 6-Deoxyerythronolid B: snížení hladin PCC vede ke zvýšené produkci [20]
b. Glukokináza v pankreatických beta buňkách: prekurzor beta-PCC prokazatelně snižuje KM a zvyšuje Vmax; aktivace [21]
Viz také
Reference
- ^ ES 6.4.1.3
- ^ ES 4.1.1.41
- ^ A b C Kalousek F, MD Darigo, Rosenberg LE (1980). "Izolace a charakterizace propionyl-CoA karboxylázy z normálních lidských jater. Důkaz protomerního tetrameru neidentických podjednotek". The Journal of Biological Chemistry. 255 (1): 60–65. PMID 6765947.
- ^ A b Diacovich L, Mitchell DL, Pham H, Gago G, Melgar MM, Khosla C, Gramajo H, Tsai SC (2004). „Krystalová struktura p-podjednotky Acyl-CoA karboxylázy: Strukturní inženýrství specificity substrátu †, ‡“. Biochemie. 43 (44): 14027–14036. doi:10.1021 / bi049065v. PMID 15518551.
- ^ A b C Huang CS, Sadre-Bazzaz K, Shen Y, Deng B, Zhou ZH, Tong L (2010). "Krystalová struktura α6β6 holoenzymu propionyl-koenzymu a karboxylázy". Příroda. 466 (7309): 1001–1005. doi:10.1038 / nature09302. PMC 2925307. PMID 20725044.
- ^ Arabolaza A, Shillito ME, Lin TW, Diacovich L, Melgar M, Pham H, Amick D, Gramajo H, Tsai SC (2010). "Krystalové struktury a mutační analýzy Acyl-CoA karboxylázy β podjednotky Streptomyces coelicolor". Biochemie. 49 (34): 7367–7376. doi:10.1021 / bi1005305. PMC 2927733. PMID 20690600.
- ^ Vlk B, Kalousek F, Rosenberg LE (1979). „Esenciální argininové zbytky v aktivních místech propionyl CoA karboxylázy a beta-methylkrotonyl CoA karboxylázy“. Enzym. 24 (5): 302–306. doi:10.1159/000458679. PMID 510274.
- ^ A b Sloane V, Waldrop GL (2004). „Kinetická charakterizace mutací nalezených v propionové acidemii a methylkrotonylglycinurii: důkazy o kooperativitě v biotinkarboxyláze“. Journal of Biological Chemistry. 279 (16): 15772–15778. doi:10,1074 / jbc.M311982200. PMID 14960587.
- ^ Hsia YE, Scully KJ, Rosenberg LE (1979). „Lidská propionyl CoA karboxyláza: Některé vlastnosti částečně vyčištěného enzymu ve fibroblastech od kontrol a pacientů s propionovou acidemií“. Pediatrický výzkum. 13 (6): 746–751. doi:10.1203/00006450-197906000-00005. PMID 481943.
- ^ Stubbe J, Fish S, Abeles RH (1980). "Jsou karboxylace zahrnující biotin ve vzájemné shodě nebo ne?" The Journal of Biological Chemistry. 255 (1): 236–242. PMID 7350155.
- ^ Reszko AE, Kasumov T, Pierce BA, David F, Hoppel CL, Stanley WC, Des Rosiers C, Brunengraber H (2003). „Posouzení reverzibility anaplerotických reakcí dráhy propionyl-CoA v srdci a játrech“. Journal of Biological Chemistry. 278 (37): 34959–34965. doi:10,1074 / jbc.M302013200. PMID 12824185.
- ^ Ugarte M, Pérez-Cerdá C, Rodríguez-Pombo P, Desviat LR, Pérez B, Richard E, Muro S, Campeau E, Ohura T, Gravel RA (1999). "Přehled mutací v genech thePCCA aPCCB způsobujících propionovou acidemii". Lidská mutace. 14 (4): 275–282. doi:10.1002 / (SICI) 1098-1004 (199910) 14: 4 <275 :: AID-HUMU1> 3.0.CO; 2-N. PMID 10502773.
- ^ Desviat LR, Pérez B, Pérez-Cerdá C, Rodríguez-Pombo P, Clavero S, Ugarte M (2004). „Propionová acidemie: aktualizace mutací a funkční a strukturní účinky variantních alel“. Molekulární genetika a metabolismus. 83 (1–2): 28–37. doi:10.1016 / j.ymgme.2004.08.001. PMID 15464417.
- ^ Deodato, F .; Boenzi, S .; Santorelli, F. M .; Dionisi-Vici, C. (2006). "Methylmalonová a propionová acidurie". American Journal of Medical Genetics Part C. 142C (2): 104–112. doi:10,1002 / ajmg.c.30090. PMID 16602092. S2CID 21114631.
- ^ Stratton SL, Bogusiewicz A, Mock MM, Mock NI, Wells AM, Mock DM (2006). „Lymfocytová propionyl-CoA karboxyláza a její aktivace biotinem jsou citlivými indikátory marginálního deficitu biotinu u lidí“. American Journal of Clinical Nutrition. 84 (2): 384–388. doi:10.1093 / ajcn / 84.1.384. PMC 1539098. PMID 16895887.
- ^ Rodríguez-Pombo P, Pérez-Cerdá C, Pérez B, Desviat LR, Sánchez-Pulido L, Ugarte M. Směrem k modelu vysvětlujícímu intragenní komplementaci v heteromultimerním proteinu propionyl-CoA karboxyláze. Biochim Biophys Acta. 2005; 1740 (3): 489-498. doi: 10.1016 / j.bbadis.2004.10.009
- ^ Rathman SC, Eisenschenk S, McMahon RJ (2002). „U potkanů chronicky podávaných karbamazepinem je sníženo množství a funkce enzymů závislých na biotinu.“ The Journal of Nutrition. 132 (11): 3405–3410. doi:10.1093 / jn / 132.11.3405. PMID 12421859.
- ^ Kelson TL, Ohura T, Kraus JP (1996). „Sestava divokého typu a mutantních podjednotek lidské propionyl-CoA karboxylázy zprostředkovaná chaperoninem exprimovaná v Escherichia coli“. Lidská molekulární genetika. 5 (3): 331–337. doi:10,1093 / hmg / 5,3,331. PMID 8852656.
- ^ McKeon C, Vlk B (1982). „Hořčík a hořečnatý adenosintrifosfát aktivace lidské propionyl CoA karboxylázy a beta-methylkrotonyl CoA karboxylázy“. Enzym. 28 (1): 76–81. doi:10.1159/000459088. PMID 6981505.
- ^ Zhang H, Boghigian BA, Pfeifer BA (2010). "Zkoumání role nativního propionyl-CoA a methylmalonyl-CoA metabolismu na produkci heterologních polyketidů v Escherichia coli". Biotechnologie a bioinženýrství. 105 (3): 567–573. doi:10,1002 / bit. 2260. PMID 19806677. S2CID 659042.
- ^ Shiraishi A, Yamada Y, Tsuura Y, Fijimoto S, Tsukiyama K, Mukai E, Toyoda Y, Miwa I, Seino Y (2000). „Nový regulátor glukokinázy v beta buňkách pankreatu: prekurzor beta podjednotky propionyl-CoA karboxylázy interaguje s glukokinázou a zvyšuje její aktivitu“. Journal of Biological Chemistry. 276 (4): 2325–2328. doi:10,1074 / jbc.C000530200. PMID 11085976.
externí odkazy
- Propionyl-CoA + karboxyláza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
