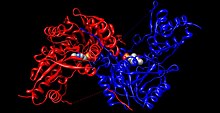
Tyrosinaminotransferáza - Tyrosine aminotransferase
| Tyrosin transamináza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Lidská tyrosinaminotransferáza (duhová barva, N-konec = modrá, C-konec = červená) v komplexu s pyridoxal fosfát (model vyplňování prostoru ).[1] | |||||||||
| Identifikátory | |||||||||
| EC číslo | 2.6.1.5 | ||||||||
| Číslo CAS | 9014-55-5 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Tyrosinaminotransferáza (nebo tyrosin transamináza) je enzym přítomný v játrech a katalyzuje přeměnu tyrosin na 4-hydroxyfenylpyruvát.[6]

U lidí je protein tyrosinaminotransferázy kódován TAT gen.[7] Nedostatek enzymu u lidí může vést k tomu, co je známé jako tyrosinemie typu II, kde je nadbytek tyrosinu v důsledku toho, že tyrosin nepodstoupil aminotransferázovou reakci za vzniku 4-hydroxyfenylpyruvátu.[8]
Mechanismus
Struktury tří hlavních molekul zapojených do chemické reakce katalyzované enzymem tyrosinaminotransferázy jsou uvedeny níže: aminokyselina tyrosin, protetická skupina pyridoxal fosfát a výsledný produkt 4-hydroxyfenylpyruvát.

Každá strana dimerového proteinu zahrnuje pyridoxal fosfát (PLP) navázaný na Lys280 zbytek molekuly tyrosinaminotransferázy. Aminová skupina tyrosinu napadá alfa uhlík iminu navázaného na Lys280, tvoří čtyřboký komplex a poté odstartuje LYS-ENZ. Tento proces je známý jako transiminaci aktem vypínání iminové skupiny navázané na PLP. Nově vytvořená molekula PLP-TYR je poté napadena základnou.
Možným kandidátem na bázi v mechanismu by mohl být Lys280, který byl právě vytlačen z PLP, který izoloval nově vytvořenou aminoskupinu molekuly PLP-TYR. V podobném mechanismu aspartát transamináza lysin, který tvoří počáteční imin k PLP, později působí jako báze, která při transiminaci útočí na tyrosin. Elektrony zanechané po ztrátě protonu se pohybují dolů a vytvářejí novou dvojnou vazbu k iminu, která zase tlačí již dvojně vázané elektrony přes PLP a končí jako osamocený pár na pozitivně nabitém dusíku v šestičlenném kruh molekuly. Voda útočí na alfa uhlík iminu PLP-TYR a skrz acylová substituce nastartuje dusík PLP a vytvoří pyridoxamin fosfát (PMP) a 4-hydroxyfenylpyruvát.
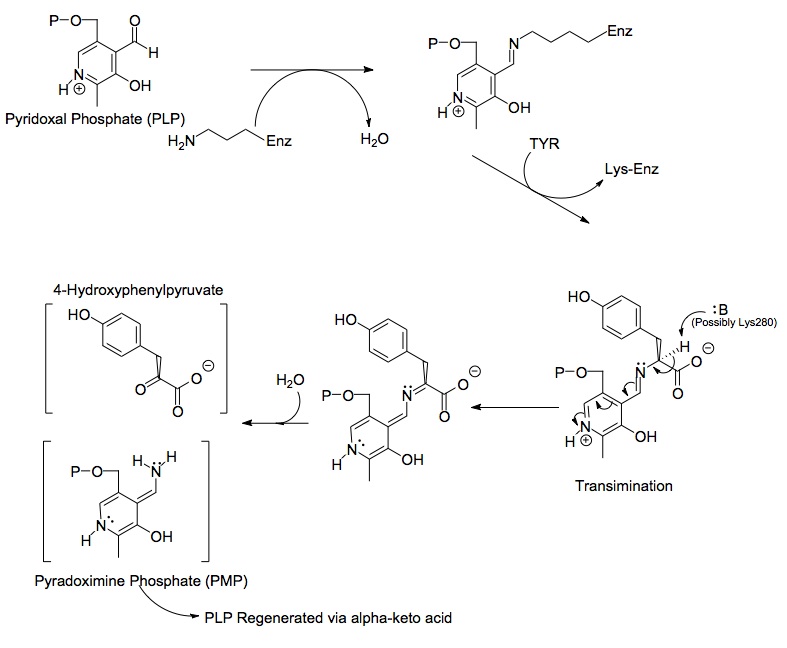
PMP se poté regeneruje na PLP převedením své aminové skupiny na alfa-ketoglutarát, čímž se reformuje její aldehydová funkční skupina. Poté následuje další substituční reakce se zbytkem Lys280 za účelem reformování jeho iminové vazby na enzym za vzniku ENZ-PLP.
Aktivní stránky

Tyrosinaminotransferáza jako dimer má dvě identická aktivní místa. Lys280 je připojen k PLP, který je udržován na místě prostřednictvím dvou nepolárních aminokyselinových postranních řetězců; fenylalanin a isoleucin (viz miniatura vpravo). PLP je také udržována na místě pomocí vodíkové vazby na okolní molekuly, zejména prostřednictvím své fosfátové skupiny.
Níže je zobrazeno jedno aktivní místo ve třech různých zvětšeních:
Patologie
Tyrosinemie je nejčastější metabolické onemocnění spojené s tyrosinaminotransferázou. Toto onemocnění je důsledkem nedostatku jaterní tyrosinaminotransferázy.[10] Tyrosinemie typu II (Richner-Hanhartův syndrom, RHS) je onemocnění autozomálně recesivní dědičnosti charakterizované keratitidou, palmoplantární hyperkeratózou, mentální retardací a zvýšenými hladinami tyrosinu v krvi.[10] Keratitida u pacientů s tyrosinemií typu II je způsobena ukládáním krystalů tyrosinu v rohovce a vede k zánětu rohovky.[11] Gen TAT je lokalizován na lidském chromozomu 16q22-24 a rozkládá se na více než 10,9 kilobázích (kb) obsahujících 12 exonů a jeho 3,0 kb mRNA kóduje protein o 454 aminokyselinách 50,4 kDa.[12] Bylo popsáno dvanáct různých mutací genu TAT.[12]
Reference
- ^ A b PDB: 3DYD; Karlberg T, Moche M, Andersson J a kol. (2008). "Lidská tyrosinaminotransferáza". Bude zveřejněno.
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000198650 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000001670 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Dietrich JB (duben 1992). „Tyrosinaminotransferáza: mimo jiné transamináza?“. Buněčná a molekulární biologie. 38 (2): 95–114. PMID 1349265.
- ^ Zea-Rey, Alexandra V .; Cruz-Camino, Héctor; Vazquez-Cantu, Diana L .; Gutiérrez-García, Valeria M .; Santos-Guzmán, Jesús; Cantú-Reyna, Consuelo (27. listopadu 2017). „Výskyt přechodné novorozenecké tyrosinémie u mexické populace“. Journal of Inborn Errors of Metabolism and Screening. 5: 232640981774423. doi:10.1177/2326409817744230.
- ^ Rettenmeier R, Natt E, Zentgraf H, Scherer G (červenec 1990). "Izolace a charakterizace genu lidské tyrosinaminotransferázy". Nucleic Acids Res. 18 (13): 3853–61. doi:10.1093 / nar / 18.13.3853. PMC 331086. PMID 1973834.
- ^ Pettersen, E.F .; Goddard, T.D .; Huang, C.C .; Couch, G.S .; Greenblatt, D.M .; Meng, E.C .; Ferrin, T.E. (2004). „UCSF Chimera - vizualizační systém pro průzkumný výzkum a analýzu“. Journal of Computational Chemistry. 25 (13): 1605–1612. CiteSeerX 10.1.1.456.9442. doi:10.1002 / jcc.20084. PMID 15264254. S2CID 8747218.
- ^ A b Natt E, Kida K, Odievre M, Di Rocco M, Scherer G (říjen 1992). „Bodové mutace v genu pro tyrosinaminotransferázu u tyrosinemie typu II“. Proc. Natl. Acad. Sci. USA. 89 (19): 9297–301. Bibcode:1992PNAS ... 89,9297N. doi:10.1073 / pnas.89.19.9297. PMC 50113. PMID 1357662.
- ^ al-Hemidan AI, al-Hazzaa SA (březen 1995). "Richner-Hanhartův syndrom (tyrosinemie typu II). Kazuistika a přehled literatury". Oční Genet. 16 (1): 21–6. doi:10.3109/13816819509057850. PMID 7648039.
- ^ A b Minami-Hori M, Ishida-Yamamoto A, Katoh N, Takahashi H, Iizuka H (leden 2006). „Richner-Hanhartův syndrom: zpráva o případu s novou mutací tyrosinaminotransferázy“. J. Dermatol. Sci. 41 (1): 82–4. doi:10.1016 / j.jdermsci.2005.10.007. PMID 16318910.
Molekulární grafické obrázky byly vytvořeny pomocí balíčku UCSF Chimera od Resource for Biocomputing, Visualization, and Informatics na University of California, San Francisco (podporováno NIH P41 RR-01081).
externí odkazy
- Tyrosin + aminotransferáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- PDBe-KB poskytuje přehled všech strukturních informací dostupných v PDB pro lidskou tyrosinaminotransferázu