Beta-ketoacyl-ACP syntáza - Beta-ketoacyl-ACP synthase
| 3-oxoacyl-ACP syntáza, mitochondriální | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | OXSM | ||||||
| Gen NCBI | 54995 | ||||||
| HGNC | 26063 | ||||||
| OMIM | 610324 | ||||||
| RefSeq | NM_017897 | ||||||
| UniProt | Q9NWU1 | ||||||
| Další údaje | |||||||
| EC číslo | 2.3.1.41 | ||||||
| Místo | Chr. 3 p24.2 | ||||||
| |||||||
| Beta-ketoacyl syntáza, N-terminální doména | |||||||||
|---|---|---|---|---|---|---|---|---|---|
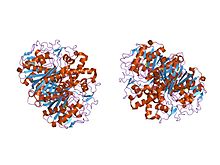 krystalová struktura beta-ketoacyl- [acylového nosného proteinu] syntázy II ze streptococcus pneumoniae, triklinická forma | |||||||||
| Identifikátory | |||||||||
| Symbol | ketoacyl-synt | ||||||||
| Pfam | PF00109 | ||||||||
| Pfam klan | CL0046 | ||||||||
| InterPro | IPR014030 | ||||||||
| STRÁNKA | PDOC00529 | ||||||||
| SCOP2 | 1 kas / Rozsah / SUPFAM | ||||||||
| |||||||||
| Beta-ketoacyl syntáza, C-terminální doména | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 arabidopsis thaliana mitochondriální komplex beta-ketoacyl acp syntázy s kyselinou hexanovou | |||||||||
| Identifikátory | |||||||||
| Symbol | Ketoacyl-synt_C | ||||||||
| Pfam | PF02801 | ||||||||
| Pfam klan | CL0046 | ||||||||
| InterPro | IPR014031 | ||||||||
| STRÁNKA | PDOC00529 | ||||||||
| SCOP2 | 1 kas / Rozsah / SUPFAM | ||||||||
| |||||||||
V molekulární biologii Beta-ketoacyl-ACP syntáza ES 2.3.1.41, je enzym zahrnutý do něčeho, zůčastnit se čeho syntéza mastných kyselin. Obvykle se používá malonyl-CoA jako zdroj uhlíku k prodloužení vazby na ACP acyl druhů, což vede k tvorbě β-keto vázaného na ACPacyl druhy jako acetoacetyl -AKT.[1]
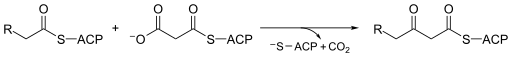
Beta-ketoacyl-ACP syntáza je vysoce konzervovaný enzym který se nachází téměř ve všem životě Země jako doména v syntáza mastných kyselin (FAS). FAS existuje ve dvou typech, příhodně pojmenovaných typ I a II. v zvířata, houby a nižší eukaryoty, Beta-ketoacyl-ACP syntázy tvoří jednu z katalytických domén větších multifunkčních proteinů (typ I), zatímco ve většině prokaryoty stejně jako v plastidy a mitochondrie Beta-ketoacyl-ACP syntázy jsou oddělené proteinové řetězce, které obvykle tvoří dimery (typ II).[1][2] Beta-ketoacyl-ACP syntáza III, možná nejznámější z této rodiny enzymů, katalyzuje A Claisenova kondenzace mezi acetyl CoA a malonyl AKT. Obrázek níže ukazuje, jak CoA zapadá do aktivního místa jako substrát syntázy III.

Beta-ketoacyl-ACP syntázy I a II pouze katalyzují acyl-ACP reakce s malonyl ACP. Syntázy I a II jsou schopné produkovat acyl-ACP s dlouhým řetězcem. Oba jsou účinné až do acyl-ACP s 14 uhlík řetězce, kdy je syntáza II účinnější volbou pro další přidávání uhlíku. FAS typu I katalyzuje všechny reakce nezbytné k vytvoření kyselina palmitová, což je u zvířat nezbytná funkce metabolické procesy, z nichž jeden zahrnuje vznik sfingosiny.[1]
Beta-ketoacyl-ACP syntáza se nalézá jako složka řady enzymatický systémy, včetně syntetáza mastných kyselin (FAS); multifunkční syntáza kyseliny 6-metysalicylové (MSAS) z plísně Penicillium patulum,[3] který je zapojen do biosyntéza a polyketid antibiotikum; systémy enzymů polyketidových antibiotik syntetázy; Emericella nidulans multifunkční protein Wa, který se podílí na biosyntéze konidiální zelená pigment; Rhizobium nodulační protein nodE, který pravděpodobně funguje jako beta-ketoacyl syntáza při syntéze nodulace Faktor kývnutí mastný acylový řetězec; a droždí mitochondriální protein CEM1.
Struktura

Beta-ketoacyl syntáza obsahuje dvě proteinové domény. The Aktivní stránky se nachází mezi N- a C-terminál domén. N-terminální doména obsahuje většinu struktur zapojených do dimer formace a také Aktivní stránky cystein. Zbytky z obou domén přispívají k Podklad vazba a katalýza[4]
U zvířat a u prokaryot je beta-ketoacyl-ACP syntáza doménou typu FAS typu I, což je velký enzymový komplex, který má více domén katalyzujících více různých reakcí. Analogicky se beta-ketoacyl-ACP syntáza v rostlinách vyskytuje u FAS typu II; Všimněte si, že syntázy v rostliny bylo dokumentováno, že mají řadu specificity substrátu.[1] Přítomnost podobných ketoacyl syntáz přítomných ve všech živých organismy přejděte na a společný předek.[5] Další vyšetření beta-ketoacyl-ACP syntáz I a II z E-coli odhalil, že oba jsou homodimerní, ale syntáza II je o něco větší. Nicméně, i když jsou oba zapojeni do metabolismus mastných kyselin, mají také velmi odlišné primární struktura.[6] V syntáze II se každá podjednotka skládá z pětřetězcových skládaný list beta obklopen více alfa helixy, zobrazené na obrázku vlevo. Aktivní stránky jsou relativně blízko, jen asi 25 angstromy od sebe, a skládají se většinou hydrofobní kapsa.[4] Určitý experimenty rovněž navrhli přítomnost „transportních tunelů mastných kyselin“ v doméně beta-ketoacyl-ACP syntázy, které vedou k jedné z mnoha „dutin mastných kyselin“, která v podstatě působí jako aktivní místo.[7]
Mechanismus
Beta-ketoacyl-syntáza mechanismus je předmětem debaty mezi chemici. Mnoho lidí s tím souhlasí Cys171 aktivního místa napadá acetyl ACP karbonyl, a jako většina enzymů stabilizuje středně pokročilí s ostatními zbytky na aktivním webu. AKT je následně vyloučen a deprotonuje His311 v průběhu. A thioester se poté regeneruje s cysteinem v aktivním místě. Dekarboxylace malonylového CoA, který je také na aktivním místě, zpočátku vytváří izolovat, který je stabilizován His311 a His345. Enolát tautomerizuje do a karbanion který napadá thioester komplexu acetyl-enzym.[8] Některé zdroje spekulují, že je aktivován molekula vody také se nachází v aktivním místě jako prostředek hydratace uvolněného CO2 nebo zaútočit na C3 malonyl CoA. Další navrhovaný mechanismus uvažuje o vytvoření a čtyřboká přechodový stav.[1] Hnací síla reakce pochází z dekarboxylace malonyl ACP; the energie zachycen v této vazbě technicky pochází ATP, na co se původně zvyklo karboxylát acetyl CoA na malonyl CoA.[9]

Biologická funkce
Hlavní funkcí beta-ketoacyl-ACP syntázy je produkce mastné kyseliny různých délek pro použití v organismu. Mezi tato použití patří zásobárna energie a tvorba buněčné membrány. Lze také použít mastné kyseliny syntetizovat prostaglandiny, fosfolipidy, a vitamíny, mezi mnoha jinými věcmi. Dále, kyselina palmitová, který je vytvářen beta-ketoacyl-syntázami na FAS typu I, se používá v řadě biologických kapacit. Je to předchůdce oba stearic a kyseliny palmitolejové. Palmitolejovou lze následně použít k vytvoření řady dalších mastných kyselin.[10] Kyselina palmitová se také používá k syntéze sfingosiny, které hrají roli v buněčných membránách.[1]
Klinický význam
Různé typy beta-ketoacyl-ACP syntáz ve FAS typu II se nazývají FabB, FabF a FabH syntázy. FabH katalyzuje klíčovou ketoacylsyntázovou reakci s malonyl ACP a acetyl CoA. FabB a FabF katalyzují další související reakce. Vzhledem k tomu, že jejich funkce je nezbytná pro správné obklopení biologických funkcí lipoprotein, fosfolipid, a lipopolysacharid syntézou se staly terčem antibakteriální lék rozvoj. Aby se přizpůsobili jejich životní prostředí, bakterie měnit fosfolipidové složení jejich membrán. Inhibující tento cesta může být tedy pákovým bodem při narušení množení bakterií.[11] Studiem Yersinia pestis, Který způsobuje dýmějový, pneumatické a septikemické rány vědci prokázali, že FabB, FabF a FabH mohou být teoreticky všechny inhibovány stejným lékem kvůli podobnosti jejich vazebná místa. Taková droga však dosud nebyla vyvinuta.[12] Cerulenin, molekula, která podle všeho inhibuje napodobením „kondenzačního přechodového stavu“, může inhibovat pouze B nebo F, ale nikoli H. Jiná molekula, thiolaktomycin, který napodobuje malonyl ACP v aktivním místě, může pouze inhibovat FabB.[13] Nakonec platensimycin má také možné použití antibiotik díky své inhibici FabF.[14]
Tyto typy drog jsou vysoce relevantní. Například Y. pestis byl hlavním agentem v Justiniánský mor, Černá smrt a moderní mor. I za posledních pět let Čína, Peru, a Madagaskar všichni zažili propuknutí infekce autor: Y. pestis. Pokud tomu tak není ošetřeno do 24 hodin to obvykle vede k smrt. Kromě toho existuje obava, že jej lze nyní použít jako možné biologická válka zbraň.[12]
Bohužel mnoho léků, které se zaměřují na prokaryotické beta-ketoacyl-syntázy, nese mnoho vedlejší efekty. Vzhledem k podobnostem mezi prokaryotickými ketoacylsyntázami a mitochondriálními mají tyto typy léčiv tendenci neúmyslně také působit na mitochondriální syntázy, což vede k mnoha biologické důsledky pro lidi.[2]
Průmyslové aplikace
Nedávné úsilí v bioinženýrství zahrnují inženýrství proteinů FAS, které zahrnuje domény beta-ketoacyl-ACP syntázy, za účelem podpory syntézy rozvětvené uhlíkové řetězce jako obnovitelná energie zdroj. Rozvětvené uhlíkové řetězce obsahují více energie a lze je použít nižší teploty kvůli jejich nižší bod mrazu. Použitím E. coli jako organismu volby, inženýři nahradili endogenní FabH doménu na FAS, která upřednostňuje nerozvětvené řetězy, s verzemi FabH, které upřednostňují větvení díky své vysoké substrátové specificitě pro rozvětvené acyl-ACP.[15]
Viz také
- Beta-ketoacyl-acyl-nosič-protein syntáza I
- Beta-ketoacyl-acyl-nosič-protein syntáza II
- 3-oxoacyl- (acyl-nosič-protein) reduktáza
Reference
- ^ A b C d E F Witkowski, Andrzej; Joshi, Anil K .; Smith, Stuart (2002). „Mechanismus reakce β-ketoacyl syntázy katalyzovaný živočišnou mastnou kyselinou syntázou †“. Biochemie. 41 (35): 10877–10887. doi:10.1021 / bi0259047. PMID 12196027.
- ^ A b Christensen, Caspar Elo; Kragelund, Birthe B .; von Wettstein-Knowles, Penny; Henriksen, Anette (01.02.2007). "Struktura lidské β-ketoacyl [ACP] syntázy z mitochondriální syntázy mastných kyselin typu II". Věda o bílkovinách. 16 (2): 261–272. doi:10.1110 / ps.062473707. ISSN 0961-8368. PMC 2203288. PMID 17242430.
- ^ Beck J, Ripka S, Siegner A, Schiltz E, Schweizer E (září 1990). „Multifunkční gen syntázy kyseliny 6-methylsalicylové z Penicillium patulum. Jeho genová struktura ve srovnání se strukturou jiných polyketidových syntáz“. European Journal of Biochemistry / FEBS. 192 (2): 487–98. doi:10.1111 / j.1432-1033.1990.tb19252.x. PMID 2209605.
- ^ A b Huang W, Jia J, Edwards P, Dehesh K, Schneider G, Lindqvist Y (březen 1998). „Krystalová struktura beta-ketoacyl-acylového nosného proteinu syntázy II z E. coli odhaluje molekulární architekturu kondenzujících enzymů“. Časopis EMBO. 17 (5): 1183–91. doi:10.1093 / emboj / 17.5.1183. PMC 1170466. PMID 9482715.
- ^ Beld, Joris; Blatti, Jillian L .; Behnke, Craig; Mendez, Michael; Burkart, Michael D. (01.08.2014). „Vývoj acyl-ACP-thioesteráz a β-ketoacyl-ACP-syntáz odhalený interakcemi protein-protein“. Journal of Applied Phycology. 26 (4): 1619–1629. doi:10.1007 / s10811-013-0203-4. ISSN 0921-8971. PMC 4125210. PMID 25110394.
- ^ Garwin, J. L .; Klages, A. L .; Cronan, J. E. (1980-12-25). „Strukturální, enzymatické a genetické studie beta-ketoacyl-acylových nosičových proteinových syntáz I a II Escherichia coli“. Journal of Biological Chemistry. 255 (24): 11949–11956. ISSN 0021-9258. PMID 7002930.
- ^ Cui, Wei; Liang, Yan; Tian, Weixi; Ji, Mingjuan; Ma, Xiaofeng (01.03.2016). „Regulační účinek domény β-ketoacyl syntázy syntázy mastných kyselin na délku mastného acylového řetězce při syntéze mastných kyselin de novo“. Biochimica et Biophysica Acta (BBA) - molekulární a buněčná biologie lipidů. 1861 (3): 149–155. doi:10.1016 / j.bbalip.2015.12.002. PMID 26680361.
- ^ Lee, Wook; Engels, Bernd (2014). „Protonační stav katalytických zbytků v klidovém stavu KasA Revisited: Podrobný mechanismus pro aktivaci KasA vlastním substrátem“. Biochemie. 53 (5): 919–931. doi:10.1021 / bi401308j. PMID 24479625.
- ^ Tymoczko, John; Berg; Stryer (2013). Biochemie Krátký kurz. Spojené státy americké: W.H. Freeman a společnost. ISBN 978-1-4292-8360-1.
- ^ „Kyselina palmitová, nasycená mastná kyselina, v buněčné kultuře“. Sigma-Aldrich. Citováno 2016-02-29.
- ^ Zhang, Yong-Mei; Rock, Charles O. (01.03.2008). "Homeostáza membránových lipidů v bakteriích". Příroda Recenze Mikrobiologie. 6 (3): 222–233. doi:10.1038 / nrmicro1839. ISSN 1740-1526. PMID 18264115. S2CID 7888484.
- ^ A b Nanson, Jeffrey D .; Himiari, Zainab; Swarbrick, Crystall M. D .; Forwood, Jade K. (2015-10-15). „Strukturní charakterizace proteinových syntáz beta-ketoacyl-acylového nosiče, FabF a FabH, z Yersinia pestis“. Vědecké zprávy. 5: 14797. Bibcode:2015NatSR ... 514797N. doi:10.1038 / srep14797. PMC 4606726. PMID 26469877.
- ^ Cena, Allen C .; Choi, Keum-Hwa; Heath, Richard J .; Li, Zhenmei; White, Stephen W .; Rock, Charles O. (03.03.2001). „Inhibice β-ketoacyl-acylových nosičových proteinových syntáz thiolaktomycinem a ceruleninem STRUKTURA A MECHANISMUS“. Journal of Biological Chemistry. 276 (9): 6551–6559. doi:10,1074 / jbc.M007101200. ISSN 0021-9258. PMID 11050088.
- ^ Wright, H Tonie; Reynolds, Kevin A (01.10.2007). "Antibakteriální cíle v biosyntéze mastných kyselin". Současný názor v mikrobiologii. Antimikrobiální látky / genomika. 10 (5): 447–453. doi:10.1016 / j.mib.2007.07.001. PMC 2271077. PMID 17707686.
- ^ Jiang, Wen; Jiang, Yanfang; Bentley, Gayle J .; Liu, Di; Xiao, Yi; Zhang, Fuzhong (01.08.2015). „Zvýšená produkce mastných kyselin s rozvětveným řetězcem nahrazením β-ketoacyl- (acyl-nosič-protein) syntázy III (FabH)“. Biotechnologie a bioinženýrství. 112 (8): 1613–1622. doi:10,1002 / bit. 2583. ISSN 1097-0290. PMID 25788017. S2CID 35469786.
externí odkazy
- beta + ketoacyl + ACP + syntáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
Další čtení
- Jiang W, Jiang Y, Bentley GJ, Liu D, Xiao Y, Zhang F (srpen 2015). „Zvýšená produkce mastných kyselin s rozvětveným řetězcem nahrazením β-ketoacyl- (acyl-nosič-protein) syntázy III (FabH)“. Biotechnologie a bioinženýrství. 112 (8): 1613–22. doi:10,1002 / bit. 2583. PMID 25788017. S2CID 35469786.
- Witkowski A, Joshi AK, Smith S (září 2002). „Mechanismus reakce beta-ketoacylsyntázy katalyzovaný syntetázou živočišných mastných kyselin“. Biochemie. 41 (35): 10877–87. doi:10.1021 / bi0259047. PMID 12196027.
- Christensen CE, Kragelund BB, von Wettstein-Knowles P, Henriksen A (únor 2007). "Struktura lidské beta-ketoacyl [ACP] syntázy z mitochondriální syntázy mastných kyselin typu II". Věda o bílkovinách. 16 (2): 261–72. doi:10.1110 / ps.062473707. PMC 2203288. PMID 17242430.
- Lee W, Engels B (únor 2014). „Stav protonace katalytických zbytků v klidovém stavu KasA se vrátil: podrobný mechanismus pro aktivaci KasA vlastním substrátem“. Biochemie. 53 (5): 919–31. doi:10.1021 / bi401308j. PMID 24479625.
