Methionin syntáza - Methionine synthase - Wikipedia
Methionin syntáza také známý jako SLEČNA, MeSe, MetH je zodpovědný za regeneraci methionin z homocystein. U lidí je kódován MTR gen (5-methyltetrahydrofolát-homocystein methyltransferáza).[5][6] Methionin syntáza je součástí S-adenosylmethionin (Stejný) biosyntéza a regenerace cyklus.[7] U zvířat tento enzym vyžaduje Vitamin B12 (kobalamin) jako a kofaktor zatímco forma nalezená v rostlinách je nezávislá na kobalaminu.[8] Mikroorganismy exprimují jak formy závislé na kobalaminu, tak formy nezávislé na kobalaminu.[8]
Mechanismus

Methionin syntáza katalyzuje poslední krok regenerace methionin (Setkal se) z homocystein (Hcy). Celková reakce se transformuje 5-methyltetrahydrofolát (N5-MeTHF) do tetrahydrofolát (THF) při přenosu methylové skupiny na homocystein za vzniku methioninu. Methionin syntáza je jediný savčí enzym, který metabolizuje dusík5-MeTHF k regeneraci aktivního kofaktoru THF. U forem enzymu závislých na kobalaminu probíhá reakce ve dvou krocích ping-pongovou reakcí. Enzym je nejprve připraven do reaktivního stavu přenosem methylové skupiny z N5-MeTHF na Co (I) ve vazbě na enzymy kobalamin (Cob), tvořící methyl-kobalamin (Me-Cob), který nyní obsahuje Me-Co (III), a aktivuje enzym. Potom Hcy, která se koordinovala s vazbou na enzym zinek za vzniku reaktivního thiolátu reaguje s Me-Cob. Aktivovaná methylová skupina se přenáší z Me-Cob na Hcy thiolát, který regeneruje Co (I) v klasu, a Met se uvolňuje z enzymu. Mechanismus nezávislý na klasu sleduje stejnou obecnou cestu, ale s přímou reakcí mezi thiolátem zinečnatým a N5-MeTHF.[9][10]

Mechanismus enzymu závisí na neustálé regeneraci Co (I) v klasu, ale to není vždy zaručeno. Místo toho může být každých 1–2 000 katalytických obratů oxidován Co (I) na Co (II), což by trvale ukončilo katalytickou aktivitu. Samostatný protein, Methionin syntáza reduktáza, katalyzuje regeneraci Co (I) a obnovení enzymatické aktivity. Protože oxidace cob-Co (I) nevyhnutelně vypíná aktivitu methioninsyntázy závislou na cob, byly u některých chorobných asociací pro nedostatek methioninsyntázy popsaných níže zahrnuty defekty nebo nedostatky methioninsynthasreduktázy. Tyto dva enzymy tvoří síť zachycovače, která je vidět vlevo dole.[11]
Struktura
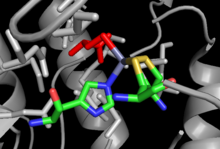
Byly vyřešeny krystalové struktury jak pro MetH nezávislé na klasu, tak pro klas závislé na klasu, s malou podobností v celkové struktuře navzdory identické síťové reakci prováděné každým z nich a podobnostem ve vazebných místech, jako je Hcy vazebné místo.[12] Cob-dependentní MetH je rozdělen do 4 samostatných domén: aktivace, vazba kobalaminu (doména Cob), vazba homocysteinu (doména Hcy) a N 5-methylTHF vazba (doména MeTHF). Aktivační doména je místem interakce s methionin syntázovou reduktázou a váže se SAM který se používá jako součást cyklu reaktivace enzymu. Cob doména obsahuje Cob vložený mezi několik velkých alfa šroubovic a navázaný na enzym, takže atom kobaltu skupiny je vystaven kontaktu s jinými doménami. Hcy doména obsahuje kritické místo vázající zinek, tvořené zbytky cysteinu nebo histidinu koordinované s iontem zinku, který může vázat Hcy, s příkladem z MetH nezávislého na Cob, zobrazeným vpravo. Pak5-MeTHF vazebná doména obsahuje konzervovanou hlaveň, ve které N5-MeTHF může vodíková vazba s asparagin, arginin, a kyselina asparagová zbytky. Celá struktura prochází během katalýzy dramatickým výkyvným pohybem, když se doména Cob pohybuje tam a zpět z domény Hcy do domény Fol a přenáší aktivní methylovou skupinu z domény Fol do Hcy.[13]
Funkce

Hlavním účelem methionin syntázy je regenerace Met v cyklu S-adenosyl methioninu, který při jediném obratu spotřebovává Met a ATP a generuje Hcy. Tento cyklus je kritický, protože S-adenosylmethionin se v biologii hojně používá jako zdroj aktivní methylové skupiny, a tak methioninsyntáza slouží základní funkci tím, že umožňuje udržovat cyklus SAM bez neustálého přílivu Met. Tímto způsobem slouží methionin syntáza také k udržení nízké hladiny Hcy a protože methionin syntáza je jedním z mála enzymů, které používaly N5-MeTHF jako substrát, pro nepřímé udržování hladin THF.
V rostlinách a mikroorganismech slouží methionin syntáza dvojímu účelu, a to jak k udržování cyklu SAM, tak k katalyzování závěrečného syntetického kroku v de novo syntéza Met. Zatímco reakce je přesně stejná pro oba procesy, celková funkce se liší od methioninsyntázy u lidí, protože Met je esenciální aminokyselina, která není v těle syntetizována de novo.[14]
Klinický význam
Mutace v genu MTR byly identifikovány jako základní příčina komplementační skupiny G s nedostatkem methylkobalaminu nebo typu cblG s nedostatkem methylkobalaminu.[5] Nedostatek nebo deregulace enzymu způsobená nedostatkem methioninsyntázy reduktázy může přímo vést ke zvýšeným hladinám homocysteinu (hyperhomocysteinémie ), který je spojen se slepotou, neurologickými příznaky a vrozenými vadami. Většina případů nedostatku methioninsyntázy je symptomatická do 2 let od narození, u mnoha pacientů se rychle rozvine těžká encefalopatie.[15] Jedním z důsledků snížené aktivity methioninsyntázy, které je měřitelné běžnými klinickými krevními testy, je megaloblastická anémie.
Genetika
Bylo identifikováno několik polymorfismů v genu MTR.[Citace je zapotřebí ]
- 2756D → G (Asp919Gly)
Viz také
- Methyltransferáza
- Arakawův syndrom II
- 5-Methyltetrahydrofolát (5-Me-THF, 5-Me-H4F, 5-MTHF)
- Betain - homocystein S-methyltransferáza
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000116984 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000021311 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b „MTR 5-methyltetrahydrofolát-homocystein methyltransferáza (Homo sapiens)". Entrez. 19. května 2009. Citováno 24. května 2009.
- ^ Li YN, Gulati S, Baker PJ, Brody LC, Banerjee R, Kruger WD (prosinec 1996). "Klonování, mapování a RNA analýza lidského genu pro methionin syntázu". Lidská molekulární genetika. 5 (12): 1851–8. doi:10,1093 / hmg / 5.12.1851. PMID 8968735.
- ^ Banerjee RV, Matthews RG (březen 1990). „Cobalamin-dependentní methionin syntáza“. FASEB Journal. 4 (5): 1450–9. doi:10.1096 / fasebj.4.5.2407589. hdl:2027.42/154369. PMID 2407589.
- ^ A b Zydowsky, T. M. (1986). „Stereochemická analýza přenosu methylu katalyzovaná methioninsyntázou závislou na kobalaminu z Escherichia coli B“. Journal of the American Chemical Society. 108 (11): 3152–3153. doi:10.1021 / ja00271a081.
- ^ Zhang Z, Tian C, Zhou S, Wang W, Guo Y, Xia J, Liu Z, Wang B, Wang X, Golding BT, Griff RJ, Du Y, Liu J (prosinec 2012). "Návrh založený na mechanismu, syntéza a biologické studie N-substituovaných analogů tetrahydrofolátu jako inhibitorů kobalamin-dependentní methioninsyntázy a potenciálních protinádorových látek". European Journal of Medicinal Chemistry. 58: 228–36. doi:10.1016 / j.ejmech.2012.09.027. PMID 23124219.
- ^ Matthews, R. G .; Smith, A.E .; Zhou, Z. S .; Taurog, R.E .; Bandarian, V .; Evans, J. C .; Ludwig, M. (2003). „Na kobalaminu závislé a na kobalaminu nezávislé methioninové syntázy: Existují dvě řešení stejného chemického problému?“. Helvetica Chimica Acta. 86 (12): 3939. doi:10.1002 / hlca.200390329.
- ^ Wolthers KR, Scrutton NS (červen 2007). „Proteinové interakce v komplexu lidské methioninsyntázy-methioninsyntázy reduktázy a důsledky pro mechanismus reaktivace enzymů“. Biochemie. 46 (23): 6696–709. doi:10.1021 / bi700339v. PMID 17477549.
- ^ Pejchal R, Ludwig ML (únor 2005). „Na kobalaminu nezávislá methionin syntáza (MetE): tváří v tvář dvojitá hlaveň, která se vyvinula duplikací genů“. PLOS Biology. 3 (2): e31. doi:10.1371 / journal.pbio.0030031. PMC 539065. PMID 15630480.
- ^ Evans JC, Huddler DP, Hilgers MT, Romanchuk G, Matthews RG, Ludwig ML (březen 2004). „Struktury N-terminálních modulů implikují pohyby velké domény během katalýzy methionin syntázou“. Sborník Národní akademie věd Spojených států amerických. 101 (11): 3729–36. Bibcode:2004PNAS..101.3729E. doi:10.1073 / pnas.0308082100. PMC 374312. PMID 14752199.
- ^ Hesse H, Hoefgen R (červen 2003). "Molekulární aspekty biosyntézy methioninu". Trendy ve vědě o rostlinách. 8 (6): 259–62. doi:10.1016 / S1360-1385 (03) 00107-9. PMID 12818659.
- ^ Outteryck O, de Sèze J, Stojkovic T, Cuisset JM, Dobbelaere D, Delalande S, Lacour A, Cabaret M, Lepoutre AC, Deramecourt V, Zéphir H, Fowler B, Vermersch P (červenec 2012). „Nedostatek methionin syntázy: vzácná příčina leukoencefalopatie u dospělých na počátku“. Neurologie. 79 (4): 386–8. doi:10.1212 / WNL.0b013e318260451b. PMID 22786600.
Další čtení
- Ludwig ML, Matthews RG (1997). "Perspektivy založené na struktuře enzymů závislých na B12". Roční přehled biochemie. 66: 269–313. doi:10,1146 / annurev.biochem. 66.1.269. PMID 9242908.
- Matthews RG, Sheppard C, Goulding C (duben 1998). „Methylenetetrahydrofolátreduktáza a methionin syntáza: biochemie a molekulární biologie“ (PDF). European Journal of Pediatrics. 157 Suppl 2: S54–9. doi:10.1007 / PL00014305. PMID 9587027.
- Garovic-Kocic V, Rosenblatt DS (srpen 1992). "Methioninová auxotrofie při vrozených poruchách metabolismu kobalaminu". Klinická a vyšetřovací medicína. 15 (4): 395–400. PMID 1516297.
- O'Connor DL, Moriarty P, Picciano MF (1992). "Dopad nedostatku železa na tok folátů v mléčné žláze". International Journal for Vitamin and Nutrition Research. Internationale Zeitschrift für Vitamin- und Ernährungsforschung. Journal International de Vitaminologie et de Nutrition. 62 (2): 173–80. PMID 1517041.
- Everman BW, Koblin DD (březen 1992). „Stárnutí, chronické podávání ethanolu a akutní expozice oxidu dusnému: účinky na vitamin B12 a stav folátů u potkanů“. Mechanismy stárnutí a rozvoje. 62 (3): 229–43. doi:10.1016 / 0047-6374 (92) 90109-Q. PMID 1583909.
- Vassiliadis A, Rosenblatt DS, Cooper BA, Bergeron JJ (srpen 1991). „Akumulace lyzozomálního kobalaminu ve fibroblastech od pacienta s vrozenou chybou metabolismu kobalaminu (komplementační skupina cblF): vizualizace radioautografií elektronovým mikroskopem“. Experimentální výzkum buněk. 195 (2): 295–302. doi:10.1016/0014-4827(91)90376-6. PMID 2070814.
- Li YN, Gulati S, Baker PJ, Brody LC, Banerjee R, Kruger WD (prosinec 1996). "Klonování, mapování a RNA analýza lidského genu pro methionin syntázu". Lidská molekulární genetika. 5 (12): 1851–8. doi:10,1093 / hmg / 5.12.1851. PMID 8968735.
- Gulati S, Baker P, Li YN, Fowler B, Kruger W, Brody LC, Banerjee R (prosinec 1996). "Vady lidské methionin syntázy u pacientů s cblG". Lidská molekulární genetika. 5 (12): 1859–65. doi:10,1093 / hmg / 5.12.1859. PMID 8968736.
- Leclerc D, Campeau E, Goyette P, Adjalla CE, Christensen B, Ross M, Eydoux P, Rosenblatt DS, Rozen R, Gravel RA (prosinec 1996). „Lidská methionin syntáza: klonování cDNA a identifikace mutací u pacientů s komplementační skupinou cblG s poruchami folátu / kobalaminu“. Lidská molekulární genetika. 5 (12): 1867–74. doi:10,1093 / hmg / 5.12.1867. PMID 8968737.
- Chen LH, Liu ML, Hwang HY, Chen LS, Korenberg J, Shane B (únor 1997). "Lidská methionin syntáza. Klonování cDNA, lokalizace genů a exprese". The Journal of Biological Chemistry. 272 (6): 3628–34. doi:10.1074 / jbc.272.6.3628. PMID 9013615.
- Wilson A, Leclerc D, Saberi F, Campeau E, Hwang HY, Shane B, Phillips JA, Rosenblatt DS, Gravel RA (srpen 1998). „Funkčně nulové mutace u pacientů s cblG-variantní formou deficitu methioninsyntázy“. American Journal of Human Genetics. 63 (2): 409–14. doi:10.1086/301976. PMC 1377317. PMID 9683607.
- Salomon O, Rosenberg N, Zivelin A, Steinberg DM, Kornbrot N, Dardik R, Inbal A, Seligsohn U (2002). „Methionin syntáza A2756G a polymorfismy methylenetetrahydrofolátreduktázy A1298C nejsou rizikovými faktory pro idiopatický žilní tromboembolismus“. Hematologický deník. 2 (1): 38–41. doi:10.1038 / sj.thj.6200078. PMID 11920232.
- Watkins D, Ru M, Hwang HY, Kim CD, Murray A, Philip NS, Kim W, Legakis H, Wai T, Hilton JF, Ge B, Doré C, Hosack A, Wilson A, Gravel RA, Shane B, Hudson TJ , Rosenblatt DS (červenec 2002). „Hyperhomocysteinemie způsobená nedostatkem methioninsyntázy, cblG: struktura genu MTR, rozmanitost genotypů a rozpoznání společné mutace, P1173L“. American Journal of Human Genetics. 71 (1): 143–53. doi:10.1086/341354. PMC 384971. PMID 12068375.
- De Marco P, Calevo MG, Moroni A, Arata L, Merello E, Finnell RH, Zhu H, Andreussi L, Cama A, Capra V (2002). „Studie polymorfismů MTHFR a MS jako rizikových faktorů pro NTD v italské populaci“. Journal of Human Genetics. 47 (6): 319–24. doi:10,1007 / s100380200043. PMID 12111380.
- Doolin MT, Barbaux S, McDonnell M, Hoess K, Whitehead AS, Mitchell LE (listopad 2002). „Mateřské genetické účinky vyvolané geny zapojenými do remethylace homocysteinu ovlivňují riziko spina bifida“. American Journal of Human Genetics. 71 (5): 1222–6. doi:10.1086/344209. PMC 385102. PMID 12375236.
- Zhu H, Wicker NJ, Shaw GM, Lammer EJ, Hendricks K, Suarez L, Canfield M, Finnell RH (březen 2003). „Polymorfismy homocysteinu remethylačního enzymu a zvýšené riziko defektů neurální trubice“. Molekulární genetika a metabolismus. 78 (3): 216–21. doi:10.1016 / S1096-7192 (03) 00008-8. PMID 12649067.
externí odkazy
- GeneReviews / NCBI / NIH / UW záznam o poruchách intracelulárního metabolismu kobalaminu
- ENZYM: EC 2.1.1.13
- 5-Methyltetrahydrofolát-Homocystein + S-Methyltransferáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)







