Glutathion syntetáza - Glutathione synthetase
| Glutathion syntetáza | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Identifikátory | |||||||
| Symbol | GSS | ||||||
| Gen NCBI | 2937 | ||||||
| HGNC | 4624 | ||||||
| OMIM | 601002 | ||||||
| RefSeq | NM_000178 | ||||||
| UniProt | P48637 | ||||||
| Další údaje | |||||||
| EC číslo | 6.3.2.3 | ||||||
| Místo | Chr. 20 q11.2 | ||||||
| |||||||
| Eukaryotická glutathion syntáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Lidská glutathion syntetáza | |||||||||
| Identifikátory | |||||||||
| Symbol | GSH_synthase | ||||||||
| Pfam | PF03199 | ||||||||
| Pfam klan | CL0483 | ||||||||
| InterPro | IPR004887 | ||||||||
| SCOP2 | 2 hodiny / Rozsah / SUPFAM | ||||||||
| |||||||||
| glutathion syntáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 dimer glutathion syntetázy, člověk | |||||||||
| Identifikátory | |||||||||
| EC číslo | 6.3.2.3 | ||||||||
| Číslo CAS | 9023-62-5 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| Eukaryotická glutathion syntáza, vazebná doména ATP | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Lidská glutathion syntetáza | |||||||||
| Identifikátory | |||||||||
| Symbol | GSH_synth_ATP | ||||||||
| Pfam | PF03917 | ||||||||
| InterPro | IPR005615 | ||||||||
| SCOP2 | 1m0t / Rozsah / SUPFAM | ||||||||
| |||||||||
| Prokaryotická glutathion syntetáza, N-terminální doména | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura glutathion syntetázy escherichia coli při pH 7,5 | |||||||||
| Identifikátory | |||||||||
| Symbol | GSH-S_N | ||||||||
| Pfam | PF02951 | ||||||||
| InterPro | IPR004215 | ||||||||
| SCOP2 | 1glv / Rozsah / SUPFAM | ||||||||
| |||||||||
| Prokaryotická glutathion syntetáza, ATP-uchopitelná doména | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura glutathion syntetázy escherichia coli při pH 7,5 | |||||||||
| Identifikátory | |||||||||
| Symbol | GSH-S_ATP | ||||||||
| Pfam | PF02955 | ||||||||
| Pfam klan | CL0179 | ||||||||
| InterPro | IPR004218 | ||||||||
| SCOP2 | 1glv / Rozsah / SUPFAM | ||||||||
| |||||||||
Glutathion syntetáza (GSS) (EC 6.3.2.3) je druhý enzym v glutathion (GSH) biosyntetická dráha. Katalyzuje kondenzaci gama-glutamylcystein a glycin, za vzniku glutathionu.[2] Glutathion syntetáza je také silným antioxidantem. Nachází se v mnoha druzích včetně bakterií, kvasinek, savců a rostlin.[3]
U lidí jsou vady GSS zděděny v autozomálně recesivní způsobem a jsou příčinou těžkých metabolická acidóza, 5-oxoprolinurie, zvýšená míra hemolýza a vadná funkce centrální nervový systém.[4] Nedostatky v GSS mohou způsobit řadu škodlivých příznaků u rostlin iu lidí.[5]
v eukaryoty, to je homodimerní enzym. Doména vázající substrát má tři vrstvy alfa /beta / alfa struktura.[6] Tento enzym využívá a stabilizuje meziprodukt acylfosfátu, aby později dosáhl příznivého účinku nukleofilní útok z glycin.
Struktura
Lidské a kvasinkové glutathion syntetázy jsou homodimery, což znamená, že se skládají ze dvou identických podjednotky sama o sobě nekovalentně navzájem svázaní. Na druhou stranu, E-coli glutathion syntetáza je a homotetramer.[3] Přesto jsou součástí pochopení ATP nadčeleď, který se skládá z 21 enzymů, které obsahují záhyb ATP.[7] Každá podjednotka spolu interaguje alfa šroubovice a beta list vodíkové vazby interakce a obsahuje dvě domény. Jedna doména usnadňuje mechanismus uchopení ATP[8] a druhá je katalytická Aktivní stránky pro y-glutamylcystein. The Uchopení ATP je konzervován v nadrodině ATP-grasp a je charakterizován dvěma alfa helixy a beta listy, které drží na molekule ATP mezi nimi.[9] Doména obsahující aktivní místo vykazuje zajímavé vlastnosti specificity. Na rozdíl od y-glutamylcysteinsyntetázy přijímá glutathionsyntetáza širokou škálu glutamylem modifikovaných analogů y-glutamylcysteinu, ale je mnohem konkrétnější pro cysteinem modifikované analogy y-glutamylcysteinu.[10] Krystalické struktury ukázaly, že glutathion syntetáza vázaná na GSH, ADP, dvě hořčík ionty a iont síranu.[11] Dva ionty hořčíku stabilizují acylfosfátový meziprodukt, usnadňují vazbu ATP a aktivují odstranění fosfátové skupiny z ATP. Síranový iont slouží jako náhrada za anorganický fosfát, jakmile se acylfosfátový meziprodukt vytvoří uvnitř aktivního místa.[6]
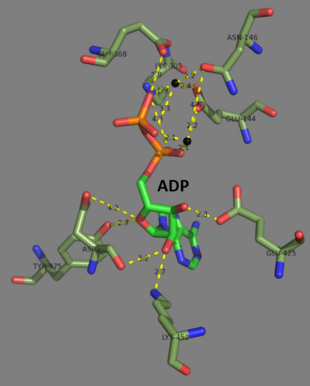
Ke konci roku 2007, 7 struktur byly pro tuto třídu enzymů vyřešeny pomocí PDB přístupové kódy 1GLV, 1GSA, 1GSH, 1M0T, 1M0W, 2GLT, a 2HGS.
Mechanismus
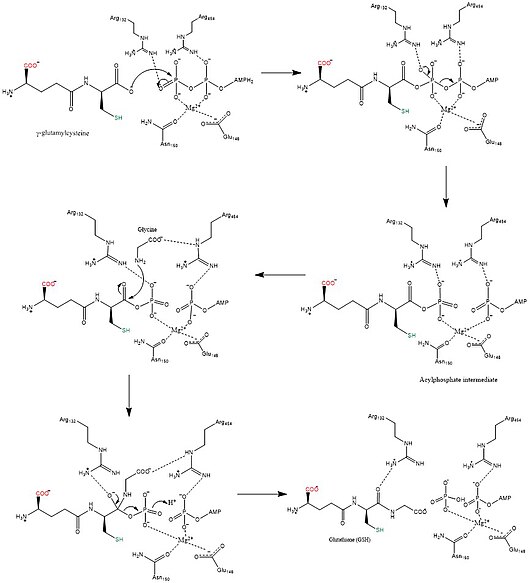
Glutathion syntáza katalyzuje the chemická reakce
- ATP + gama-L-glutamyl-L-cystein + glycin ADP + fosfát + glutathion
3 substráty tohoto enzymu jsou ATP, gama-L-glutamyl-L-cystein, a glycin, zatímco jeho 3 produkty jsou ADP, fosfát, a glutathion.
Tento enzym patří do rodiny ligázy, konkrétně těch, které tvoří vazby uhlík-dusík jako ligázy kyselina-D-aminokyselina (peptidové syntázy). The systematické jméno této třídy enzymů je gama-L-glutamyl-L-cystein: glycin ligáza (tvořící ADP). Mezi další běžně používaná jména patří glutathion syntetáza, a GSH syntetáza. Tento enzym se účastní metabolismus glutamátu a metabolismus glutathionu. Alespoň jedna sloučenina, Fosfinát je známo inhibovat tento enzym.
Biosyntetické mechanismy pro syntetázy využívat energii z nukleosid trifosfáty, zatímco syntázy ne.[12] Glutathion syntetáza zůstává v souladu s tímto pravidlem v tom, že využívá energii generovanou ATP. Zpočátku karboxylát skupina na γ-glutamylcysteinu se převede na acyl fosfát přenosem anorganické fosfátové skupiny ATP za vzniku acylfosfátového meziproduktu. Potom se aminoskupina glycinu účastní nukleofilního ataku, vytěsňuje fosfátovou skupinu a tvoří GSH.[13] Po vyrobení finálního produktu GSH jej může používat glutathionperoxidáza neutralizovat reaktivní formy kyslíku (ROS), jako je H2Ó2 nebo Glutathion S-transferázy při detoxikaci xenobiotika.[7]
Funkce
Glutathion syntetáza je důležitá pro různé biologické funkce ve více organismech. v Arabidopsis thaliana nízké hladiny glutathionsyntetázy vedly ke zvýšené zranitelnosti vůči stresorům, jako jsou těžké kovy, toxické organické chemikálie a oxidační stres.[15] Přítomnost a thiol funkční skupina umožňuje svému produktu GSH sloužit jak jako efektivní oxidující a redukční činidlo v mnoha biologických scénářích. Thioly mohou snadno přijmout pár elektronů a stát se oxidovaný na disulfidy a disulfidy mohou být snadno dostupné snížena regenerovat thioly. Kromě toho thiolový postranní řetězec cysteinů slouží jako silný nukleofily a reagovat s oxidanty a elektrofilními látkami, které by jinak způsobily poškození buňky.[16] Interakce s určitými kovy také stabilizují thiolátové meziprodukty.[17]
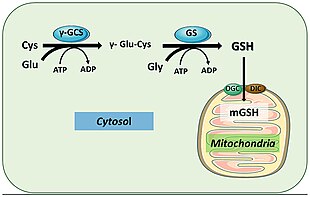
U lidí funguje glutathion syntetáza podobným způsobem. Jeho produkt GSH se účastní buněčných cest zapojených do homeostázy a udržování buněk. Například, glutathionperoxidázy katalyzovat oxidaci GSH na glutathion disulfid (GSSG) redukcí volných radikálů a reaktivních forem kyslíku, jako je peroxid vodíku.[18] Glutathion S-transferáza používá GSH k čištění různých metabolitů, xenobiotik a elektrofilů merkapturáty k vylučování.[19] Díky své antioxidační roli GSS většinou produkuje GSH uvnitř cytoplazmy jaterních buněk a importuje se do mitochondrií, kde dochází k detoxikaci.[20] GSH je také nezbytný pro aktivaci imunitního systému k vytvoření robustních obranných mechanismů proti napadení patogenů.[19] GSH je schopen zabránit infekci chřipkovým virem.[21][22]
Klinický význam
Pacienti s mutacemi v GSS vývoj genu nedostatek glutathion syntetázy (GSS), autozomálně recesivní porucha.[23] U pacientů se vyvine široká škála příznaků v závislosti na závažnosti mutací. Mírně postižení pacienti trpí kompenzovanou hemolytickou anémií, protože mutace ovlivňují stabilitu enzymu. Středně a těžce postižení jedinci mají enzymy s nefunkčními katalytickými místy, což znemožňuje jejich účast na detoxikačních reakcích. Mezi fyziologické příznaky patří metabolická acidóza, neurologické vady a zvýšená náchylnost k patogenním infekcím.[4]
Zacházení s jednotlivci s nedostatek glutathion syntetázy obvykle zahrnují terapeutické léčby zaměřené na mírné až závažné příznaky a stavy. Aby bylo možné léčit metabolická acidóza těžce postiženým pacientům je podáváno velké množství přípravku hydrogenuhličitan a antioxidanty jako vitamin E. a vitamín C.[24] V mírných případech askorbát a N-acetylcystein bylo prokázáno, že rostou glutathion úrovně a zvýšit červená krvinka Výroba.[25] Je důležité si uvědomit, že protože nedostatek glutathion syntetázy je tak vzácný, je špatně pochopen. Nemoc se také objevuje ve spektru, takže je ještě obtížnější zobecnit ji z několika málo případů, které se vyskytnou.[26]
Viz také
Reference
- ^ Gogos A, Shapiro L (prosinec 2002). „Velké konformační změny v katalytickém cyklu glutathion syntázy“. Struktura. 10 (12): 1669–76. doi:10.1016 / S0969-2126 (02) 00906-1. PMID 12467574.
- ^ Njålsson R, Norgren S (2005). "Fyziologické a patologické aspekty metabolismu GSH". Acta Paediatr. 94 (2): 132–7. doi:10.1080/08035250410025285. PMID 15981742.
- ^ A b Li H, Xu H, Graham DE, White RH (srpen 2003). „Homology glutathion-syntetázy kódují alfa-L-glutamát ligázy pro biosyntézy methanogenního koenzymu F420 a tetrahydrosarcinapterinu“. Sborník Národní akademie věd Spojených států amerických. 100 (17): 9785–90. Bibcode:2003PNAS..100.9785L. doi:10.1073 / pnas.1733391100. PMC 187843. PMID 12909715.
- ^ A b Njålsson R (září 2005). "Nedostatek glutathion syntetázy". Buněčné a molekulární biologické vědy. 62 (17): 1938–45. doi:10.1007 / s00018-005-5163-7. PMID 15990954. S2CID 59244.
- ^ O'Neill M. "Nedostatek glutathion syntetázy". Online Mendelian Inheritance in Man.
- ^ A b C Polekhina G, Board PG, Gali RR, Rossjohn J, Parker MW (červen 1999). „Molekulární podstata deficitu glutathion syntetázy a vzácná genová permutace“. Časopis EMBO. 18 (12): 3204–13. doi:10.1093 / emboj / 18.12.3204. PMC 1171401. PMID 10369661.
- ^ A b Banerjee R (2007). "Antioxidační molekuly a redoxní faktory". Redoxní biochemie. Hoboken, N.J .: Wiley. p. 16. ISBN 978-0-471-78624-5.
- ^ Fawaz MV, Topper ME, Firestine SM (prosinec 2011). „ATP-uchopitelné enzymy“. Bioorganická chemie. 39 (5–6): 185–91. doi:10.1016 / j.bioorg.2011.08.004. PMC 3243065. PMID 21920581.
- ^ Fyfe PK, Alphey MS, Hunter WN (duben 2010). „Struktura Trypanosoma brucei glutathion syntetázy: změny domén a smyček v katalytickém cyklu vysoce konzervovaného enzymu“. Molekulární a biochemická parazitologie. 170 (2): 93–9. doi:10.1016 / j.molbiopara.2009.12.011. PMC 2845819. PMID 20045436.
- ^ Galperin MY, Koonin EV (1997). „Různorodá nadrodina enzymů s aktivitou karboxylát-amin / thiol ligázy závislou na ATP“. Věda o bílkovinách. 6 (12): 2639–43. doi:10.1002 / pro.5560061218. PMC 2143612. PMID 9416615.
- ^ Meister A (1978). "Aktuální stav γ-glutamylového cyklu". V Wendel A, Sies H (eds.). Funkce glutathionu v játrech a ledvinách. Berlin, Heidelberg: Springer Berlin Heidelberg. p. 49. ISBN 978-3-642-67132-6.
- ^ Hara T, Kato H, Katsube Y, Oda J (září 1996). „Pseudomichaelisův kvartérní komplex v reverzní reakci ligázy: struktura Escherichia coli B glutathion syntetáza komplexovaná s ADP, glutathionem a síranem v rozlišení 2,0 A“. Biochemie. 35 (37): 11967–74. doi:10.1021 / bi9605245. PMID 8810901.
- ^ „Syntázy a ligázy“. Společná komise IUPAC-IUB pro biochemickou nomenklaturu (JCBN) a nomenklaturní komise IUB (NC-IUB), zpravodaj. 1984. Archivovány od originál dne 15. 10. 2012. Citováno 2016-03-02.
- ^ Herrera K, Cahoon RE, Kumaran S, Jez J (červen 2007). „Reakční mechanismus glutathion syntetázy z Arabidopsis thaliana: místně zaměřená mutageneze zbytků aktivního místa“. The Journal of Biological Chemistry. 282 (23): 17157–65. doi:10,1074 / jbc.M700804200. PMID 17452339.
- ^ Moyer AM, Sun Z, Batzler AJ, Li L, Schaid DJ, Yang P, Weinshilboum RM (březen 2010). "Glutathionová cesta genetické polymorfismy a přežití rakoviny plic po chemoterapii na bázi platiny". Epidemiologie rakoviny, biomarkery a prevence. 19 (3): 811–21. doi:10.1158 / 1055-9965.EPI-09-0871. PMC 2837367. PMID 20200426.
- ^ Xiang C, Werner BL, Christensen EM, Oliver DJ (červen 2001). „Biologické funkce glutathionu se znovu objevily u transgenních rostlin arabidopsis se změněnými hladinami glutathionu“. Fyziologie rostlin. 126 (2): 564–74. doi:10,1104 / pp.126.2.564. PMC 111149. PMID 11402187.
- ^ Conte ML, Carroll KS (14. února 2013). "Chemie oxidace a detekce thiolu" (PDF). Regulace oxidačního stresu a redoxu. s. 1–42. doi:10.1007/978-94-007-5787-5_1. ISBN 978-94-007-5786-8.
- ^ Suzuki N, Higuchi T, Nagano T (srpen 2002). „Několik aktivních meziproduktů v oxidační reakci katalyzovaných syntetickým komplexem hem-thiolátu relevantním pro cytochrom p450“. Journal of the American Chemical Society. 124 (32): 9622–8. doi:10.1021 / ja0115013. PMID 12167058.
- ^ A b Fang YZ, Yang S, Wu G (říjen 2002). "Volné radikály, antioxidanty a výživa". Výživa. 18 (10): 872–9. doi:10.1016 / S0899-9007 (02) 00916-4. PMID 12361782.
- ^ A b Ribas V, García-Ruiz C, Fernández-Checa JC (červenec 2014). "Glutathion a mitochondrie". Hranice ve farmakologii. 5: 151. doi:10.3389 / fphar.2014.00151. PMC 4079069. PMID 25024695.
- ^ Townsend DM, Tew KD, Tapiero H (2003). „Význam glutathionu u lidských nemocí“. Biomedicína a farmakoterapie. 57 (3–4): 145–55. doi:10.1016 / S0753-3322 (03) 00043-X. PMC 6522248. PMID 12818476.
- ^ Cai J, Chen Y, Seth S, Furukawa S, Compans RW, Jones DP (duben 2003). "Inhibice chřipkové infekce glutathionem". Radikální biologie a medicína zdarma. 34 (7): 928–36. doi:10.1016 / S0891-5849 (03) 00023-6. PMID 12654482.
- ^ Ristoff E, Mayatepek E, Larsson A (červenec 2001). "Dlouhodobý klinický výsledek u pacientů s nedostatkem glutathion syntetázy". The Journal of Pediatrics. 139 (1): 79–84. doi:10.1067 / mpd.2001.114480. PMID 11445798.
- ^ Kraut JA, Madias NE (květen 2010). „Metabolická acidóza: patofyziologie, diagnostika a léčba“. Recenze přírody. Nefrologie. 6 (5): 274–85. doi:10.1038 / nrneph.2010.33. PMID 20308999. S2CID 205512465.
- ^ Jain A, Buist NR, Kennaway NG, Powell BR, Auld PA, Mårtensson J (únor 1994). "Účinek léčby askorbátem nebo N-acetylcysteinem u pacienta s dědičným nedostatkem glutathion syntetázy". The Journal of Pediatrics. 124 (2): 229–33. doi:10.1016 / S0022-3476 (94) 70309-4. PMID 8301428.
- ^ Ristoff E, Larsson A (2007). "Vrozené chyby v metabolismu glutathionu". Orphanet Journal of Rare Diseases. 2: 16. doi:10.1186/1750-1172-2-16. PMC 1852094. PMID 17397529.
- Zákon MY, Halliwell B (1986). "Čištění a vlastnosti glutathion syntetázy z listů (Spinacia oleracea)". Plant Sci. 43 (3): 185–191. doi:10.1016/0168-9452(86)90016-6.
- Macnicol PK (1987). „Homoglutathion a glutathion syntetázy sazenic luštěnin - částečné čištění a substrátová specificita“. Plant Sci. 53 (3): 229–235. doi:10.1016/0168-9452(87)90159-2.
externí odkazy
- Glutathion + syntetáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)