Aminokyselinová aminotransferáza s rozvětveným řetězcem - Branched-chain amino acid aminotransferase
| Aminokyselinová aminotransferáza s rozvětveným řetězcem | |||||||
|---|---|---|---|---|---|---|---|
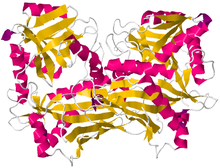 Krystalografická struktura aminotransferázy s rozvětveným řetězcem aminokyseliny z Mycobacterium smegmatis[1] | |||||||
| Identifikátory | |||||||
| Symbol | BCAT | ||||||
| Alt. symboly | BCT | ||||||
| Gen NCBI | 587 | ||||||
| HGNC | 977 | ||||||
| OMIM | 113530 | ||||||
| RefSeq | NM_001190 | ||||||
| UniProt | O15382 | ||||||
| Další údaje | |||||||
| EC číslo | 2.6.1.42 | ||||||
| Místo | Chr. 19 q13 | ||||||
| |||||||
Aminokyselinová aminotransferáza s rozvětveným řetězcem (BCAT), také známý jako aminokyselina transamináza s rozvětveným řetězcem, je aminotransferáza enzym (ES 2.6.1.42 ) na které působí aminokyseliny s rozvětveným řetězcem (BCAA). Je kódován pomocí BCAT2 gen u lidí. Enzym BCAT katalyzuje přeměnu BCAA a α-ketoglutarát do rozvětveného řetězce α-ketokyseliny a glutamát.
Struktura napravo od rozvětvené aminokyseliny aminotransferázy byla nalezena za použití Rentgenová difrakce s rozlišením 2,20 Å. Aminokyselinová aminotransferáza s rozvětveným řetězcem nalezená na tomto obrázku byla izolována z mykobakterie. Tento protein se skládá ze dvou identických polypeptidové řetězce, celkem 372 zbytků.[2]
Biologickou funkcí aminokyselinových aminotransferáz s rozvětveným řetězcem je katalyzovat syntézu nebo degradaci aminokyseliny s rozvětveným řetězcem leucin, isoleucin, a valin.[3] U lidí jsou aminokyseliny s rozvětveným řetězcem nezbytný a jsou degradovány BCAT.
Struktura a funkce
U lidí jsou BCAT homodimery složený ze dvou domén, malé podjednotky (zbytky 1-170) a velké podjednotky (zbytky 182-365). Tyto podjednotky jsou spojeny krátkou smyčkovou spojovací oblastí (zbytky 171-181).[4] Obě podjednotky se skládají ze čtyř alfa-šroubovice a a skládaný list beta.[5] Strukturální studie lidských aminokyselinových aminotransferáz s rozvětveným řetězcem (hBCAT) odhalily, že peptidové vazby v obou izoformách jsou všechny trans kromě vazby mezi zbytky Gly338-Pro339.[5] The Aktivní stránky enzymu leží v rozhraní mezi dvěma doménami.[5] Stejně jako ostatní transaminázové enzymy (stejně jako mnoho enzymů jiných tříd) vyžadují BCAT kofaktor pyridoxal-5'-fosfát (PLP) pro aktivitu. Bylo zjištěno, že PLP mění konformaci enzymů aminotransferázy a blokuje konformaci enzymu pomocí a Schiffova základna (iminová) vazba v reakci mezi lysinovým zbytkem enzymu a karbonylovou skupinou kofaktoru.[6] Tato konformační změna umožňuje substrátům vázat se na kapsu aktivního místa enzymů.
Aktivní stránky
Kromě vazby Schiffovy báze je PLP ukotvena k aktivnímu místu enzymu pomocí vodíkové vazby na zbytcích Tyr 207 a Glu237. Kromě toho fosfátové atomy kyslíku na molekule PLP interagují se zbytky Arg99, Val269, Val270 a Thr310.[5] Savčí BCAT vykazují jedinečný strukturální motiv CXXC (Cys315 a Cys318) citlivý na oxidační činidla[7] a modulován pomocí S-nitrosace,[8] posttranslační modifikace, která reguluje buněčnou signalizaci.[9] Bylo zjištěno, že modifikace těchto dvou cysteinových zbytků oxidací (in vivo / in vitro) nebo titrací (in vitro) inhibuje aktivitu enzymu,[4] což naznačuje, že motiv CXXC je zásadní pro optimální skládání a fungování proteinu.[10] Citlivost obou izoenzymů na oxidace učinit z nich potenciální biomarkery pro redox prostředí v buňce.[11] Ačkoli motiv CXXC je přítomen pouze v savčích BCAT, bylo zjištěno, že okolní aminokyselinové zbytky jsou vysoce konzervativní jak v prokaryotických, tak v eukaryotických buňkách.[12] Conway, Yeenawar a kol. zjistili, že savčí aktivní místo obsahuje tři povrchy: povrch A (Phe75, Tyr207 a Thr240), povrch B (Phe30, Tyr141 a Ala314) a povrch C (Tyr70, Leu153 a Val155, umístěné na opačné doméně), které se vážou na substrát v interakci typu Van der Waalsova typu s rozvětvenými postranními řetězci aminokyselinových substrátů.[12]
Izoformy
Savčí
BCAT u savců katalyzují první krok v metabolismu aminokyselin s rozvětveným řetězcem, reverzibilní transaminaci následovanou oxidativní dekarboxylací transaminačních produktů α-ketoisocaproate, α-keto-p-methylvalerát a α-ketoisovalerát na isovaleryl-CoA, 3- methylbutyryl-CoA, respektive isobutyryl-CoA.[13] Tato reakce reguluje metabolismus aminokyselin a je zásadním krokem při srážení dusíku v celém těle.[14] Aminokyseliny s rozvětveným řetězcem (BCAA) jsou všudypřítomné v mnoha organismech, obsahují 35% všech proteinů a 40% aminokyselin požadovaných u všech savců.[13] Savčí BCAT se vyskytují ve dvou izoformách: cytosolická (BCATc) a mitochondriální (BCATm). Izoformy sdílejí 58% homologie,[15] ale liší se v umístění a katalytické účinnosti.
BCATc
Cytosolické rozvětvené aminokyseliny aminotransferázy jsou méně časté ze dvou izoforem, které se nacházejí v cytoplazmě savčích buněk téměř výlučně v celém nervovém systému.[15] Ačkoli BCATc jsou exprimovány pouze v několika dospělých tkáních, jsou během embryogeneze exprimovány na vysoké úrovni.[16] Cytosolická izoforma má vyšší rychlost obratu, přibližně 2-5krát rychlejší než mitochondriální izoforma.[17] Bylo zjištěno, že BCATc je stabilnější než BCATm, přičemž důkazy naznačují 2 sulfidové vazby. Cytosolický isozym nevykazuje žádnou ztrátu aktivity při titraci jedné thiolové skupiny[17] hBCATc vykazuje nižší redoxní potenciál (přibližně 30 mV) než hBCATm.[11]
BCATm
Mitochondriální aminotransferázy s rozvětveným řetězcem jsou všudypřítomnější ze dvou izoforem přítomných ve všech tkáních v mitochondriích buňky.[8] Bylo zjištěno, že pankreatická acinární tkáň nese nejvyšší hladiny BCATm v těle[18] Kromě toho byly nalezeny dva homology k normálnímu BCATm. Jeden homolog se nachází v placentární tkáni a druhý společně potlačuje jaderné receptory hormonu štítné žlázy.[16][19] BCATm je citlivější na redoxní prostředí buňky a může být inhibován ionty niklu, i když se prostředí zmenšuje. Bylo zjištěno, že BCATm nevytváří žádné disulfidové vazby a titrace dvou -SH skupin 5,5'-dithiobisem (2-nitrobenzoovou kyselinou) zcela eliminuje aktivitu enzymu v případě isozymu BCATm.[17]
Izoformy rostlin
Byly také identifikovány rostlinné BCAT, ale liší se mezi druhy, pokud jde o počet a pořadí. Ve studiíchArabidopsis thaliana (thale cress), bylo identifikováno šest izoforem BCAT, které mezi sebou sdílejí mezi 47,5-84,1% homologii. Tyto izoformy také sdílejí přibližně 30% sekvenční homologii s člověkem a kvasinkami (Saccharomyces cerevisiae) izoformy.[20] BCAT1 se nachází v mitochondriích, BCAT2, 3 a 5 se nacházejí v chloroplastech a BCAT4 a 6 se nacházejí v cytoplazmě A. thaliana.[21] Studie BCAT v roce 2006 Solanum tuberosum (brambor) odhalily dvě izoformy, které jsou dlouhé 683 (BCAT1) a 746 (BCAT2) bp lokalizované primárně v chloroplastech.[22]
Bakteriální izoformy
V bakteriích existuje pouze jedna izoforma enzymu BCAT. Struktura enzymu je však mezi organismy odlišná. v Escherichia coli, enzym je hexamer obsahující šest identických podjednotek. Každá podjednotka má molekulovou hmotnost 34 kDa a je složena z 308 aminokyselin.[23] V porovnání, Lactococcus lactis BCAT je homodimer podobný izoformám savců. Každá podjednotka L. lactis BCAT se skládá z 340 aminokyselin o molekulové hmotnosti 38 kDa.[24]
Fyziologické role
Lidé
Protože aminokyseliny s rozvětveným řetězcem mají zásadní význam pro tvorbu a funkci mnoha proteinů, BCAT mají mnoho povinností ve fyziologii savců. Bylo zjištěno, že BCAT interagují s proteinovými disulfidovými izomerázami, třídou enzymů, které regulují buněčnou opravu a správné skládání proteinů.[10] Druhý krok metabolismu aminokyselin s rozvětveným řetězcem (oxidativní karboxylace pomocí ketoaciddehydrogenázy s rozvětveným řetězcem) stimuluje sekreci inzulínu. Ztráta BCATm koreluje se ztrátou sekrece inzulínu stimulovanou BCKD, ale nebyla spojena se ztrátami sekrece inzulínu z jiných metabolických cest.[18] BCATc reguluje signální dráhy mTORC1 a glykolytické metabolické cesty indukované TCR během CD4+ Aktivace T buněk.[25] V mozku reguluje BCATc množství produkce glutamátu pro použití jako neurotransmiter nebo pro budoucí syntézu kyseliny y-aminomáselné (GABA).[26]
Rostliny
BCAT také hrají roli ve fyziologii rostlinných druhů, ale nebyl studován tak rozsáhle jako savčí BCAT. v Cucumis melo (meloun), bylo zjištěno, že BCAT hrají roli při vývoji těkavých sloučenin aroma, které dodávají melounům jejich výraznou vůni a chuť.[27] v Solanum lycopersicum (rajčata), BCAT hrají roli při syntéze aminokyselin s rozvětveným řetězcem, které působí jako donory elektronů v řetězci transportu elektronů. Celkově rostlinné BCAT mají katabolické a anabolické regulační funkce.[28]
Bakterie
V bakteriální fyziologii provádějí BCAT obě reakce a tvoří jak α-ketokyseliny, tak aminokyseliny s rozvětveným řetězcem. Bakterie rostoucí na médiu bez správných poměrů aminokyselin pro růst musí být schopny syntetizovat aminokyseliny s rozvětveným řetězcem, aby mohly proliferovat.[29] v Streptococcus mutansBylo zjištěno, že grampozitivní bakterie, které žijí v lidských ústních dutinách a jsou odpovědné za zubní kaz, biosyntéza / degradace aminokyselin reguluje glykolýzu a udržuje vnitřní pH buňky. To umožňuje bakteriím přežít v kyselých podmínkách lidské ústní dutiny z rozpadu sacharidů.[30]
Použití
Syntetická organická chemie
BCAT se používají při syntéze některých farmaceutických léčiv jako alternativa k katalyzátorům těžkých kovů, což může být nákladné / ekologické. Aminotransferázy (transaminázy) se obecně používají k vytváření nepřirozených aminokyselin, důležitých stavebních kamenů pro peptidomimetické léky a zemědělské produkty. BCAT z E-coli je obvykle navržen tak, aby byl nadměrně exprimován a extrahován z celých buněk, aby byl použit pro chemickou syntézu.[31] Aminotransferázy se používají, protože mohou dosáhnout typicky vícestupňové reakce v jednom kroku, mohou provádět reakce na široké škále substrátů a mají vysokou regioselektivitu a enantioselektivitu.[32] V syntetické organické chemii se BCAT obvykle používají pro konverzi L-leucin na 2-ketoglutarát.
Drogový cíl
Antikonvulzivum gabapentin [Neurontin; Kyselina 1- (aminomethyl) cyklohexanoctová] je lék často používaný k léčbě pacientů s neuropatickou bolestí.[33][34][35] Tato neuropatická bolest může být způsobena řadou věcí, včetně diabetické neuropatie a postherpetické neuralgie.[36] Gabapentin je aminokyselinové léčivo strukturně podobné dvěma neurotransmiterům glutamátu (syntetizovanému BCAT) a GABA. Lék kompetitivně inhibuje obě izoformy BCAT v mozku a zpomaluje produkci glutamátu.[37] Gabapentin také inhibuje GABA aminotransferázu (GABA-T) a glutamát dehydrogenázu (GDH), dva další enzymy v metabolické cestě glutamátu a GABA.
Odvětví konzervovaného masa a sýrů
Bakterie L. lactis je primární bakterie odpovědná za zrání sýrů a enzymy v bakteriích hrají klíčovou roli ve vývoji chutí, struktury a aroma profilů.[38] Aminokyselinové aminotransferázy s rozvětveným řetězcem pomáhají produkovat sloučeniny, jako je kyselina isovalerová, kyselina isomáselná, 2- a 3-methylbutan (al) (ol) a 2-methylpropan (al) (ol), které dodávají ovocné nebo sladové aroma v závislosti na množství přítomné sloučeniny.[39] Spolu s aromatickými aminotransferázami (AraT), BCAT v L. lactis pomáhají rozvíjet aroma / příchuť vyplývající z těkavých sloučenin síry produkovaných během fermentace
Bakterie Staphylococcus carnosus a Enterococcus faecalis jsou často se používá v tandemu s jinými bakteriemi mléčného kvašení k zahájení procesu fermentace masa. BCAT v těchto dvou bakteriích provádějí transaminace během fermentace masa a produkují odpovídající α-ketokyseliny z aminokyselin. Postupem fermentace se tyto α-ketokyseliny rozkládají na třídu sloučenin známých jako methyl-rozvětvené těkavé látky, které zahrnují aldehydy, alkoholy a karboxylové kyseliny, které všechny přispívají k odlišným vůním a příchutím uzeného masa.[40]
Ideální podmínky
Studie BCAT z Lactococcus lactis podle Yvona, Chambellon et al., našli ideální podmínky pro bakteriální isozym takto:
- pH: ~ 7,5
- Teplota: ~ 35-40 ° C (skladování při 6 ° C udržuje enzym stabilní ~ 1 týden)
- Absence karbonylu, sulfhydrylu nebo Cu2+ nebo Co.2+ činidla / sloučeniny
- Enzym nejlépe katalyzuje reakci s aminokyselinami s rozvětveným řetězcem (v pořadí od největší aktivity po nejméně: isoleucin, leucin, valin)
- Enzym také vykazuje minimální aktivitu s methioninem, cysteinem a alaninem.[24]
Reference
- ^ „Structure Summary for 3DTF - Structural analysis of mycobacterial branched chain aminotransferase - implications for inhibitor design“. RCSB Proteinová datová banka.
- ^ „Proteinová datová banka RCSB - Structure Structure for 3DTF - Structural analysis of mycobacterial branched chain aminotransferase- implications for inhibitor design“.
- ^ Hutson S (2001). "Struktura a funkce aminotransferáz s rozvětveným řetězcem". Pokrok ve výzkumu nukleových kyselin a molekulární biologie. 70: 175–206. doi:10.1016 / s0079-6603 (01) 70017-7. ISBN 9780125400701. PMID 11642362.
- ^ A b Conway ME, Yennawar N, Wallin R, Poole LB, Hutson SM (červenec 2002). „Identifikace redox přepínače citlivého na peroxid u CXXC motivu v lidské mitochondriální aminotransferáze s rozvětveným řetězcem“. Biochemie. 41 (29): 9070–8. doi:10.1021 / bi020200i. PMID 12119021.
- ^ A b C d Yennawar N, Dunbar J, Conway M, Hutson S, Farber G (duben 2001). „Struktura lidské mitochondriální aminotransferázy s rozvětveným řetězcem“. Acta Crystallographica oddíl D. 57 (Pt 4): 506–15. doi:10.1107 / s0907444901001925. PMID 11264579.
- ^ Toney MD (listopad 2011). "Enzymologie pyridoxal fosfátu". Biochimica et Biophysica Acta (BBA) - bílkoviny a proteomika. Enzymologie pyridoxalfosfátu. 1814 (11): 1405–6. doi:10.1016 / j.bbapap.2011.08.007. PMID 21871586.
- ^ Yennawar NH, Islam MM, Conway M, Wallin R, Hutson SM (prosinec 2006). "Lidský mitochondriální rozvětvený řetězec aminotransferázy: strukturální role centra CXXC při katalýze". The Journal of Biological Chemistry. 281 (51): 39660–71. doi:10,1074 / jbc.M607552200. PMID 17050531.
- ^ A b Hull J, Hindy ME, Kehoe PG, Chalmers K, Love S, Conway ME (prosinec 2012). „Distribuce proteinů aminotransferázy s rozvětveným řetězcem v lidském mozku a jejich role v regulaci glutamátu“. Journal of Neurochemistry. 123 (6): 997–1009. doi:10.1111 / jnc.12044. PMID 23043456. S2CID 206088992.
- ^ Thomas DD, Jourd'heuil D (říjen 2012). „S-nitrosace: současné koncepty a nový vývoj“. Antioxidanty a redoxní signalizace. 17 (7): 934–6. doi:10.1089 / ars.2012.4669. PMC 3411337. PMID 22530975.
- ^ A b El Hindy M, Hezwani M, Corry D, Hull J, El Amraoui F, Harris M, Lee C, Forshaw T, Wilson A, Mansbridge A, Hassler M, Patel VB, Kehoe PG, Love S, Conway ME (červen 2014) . „Proteiny aminotransferázy s rozvětveným řetězcem: nové redox chaperony pro protein disulfid izomerázu - důsledky pro Alzheimerovu chorobu“. Antioxidanty a redoxní signalizace. 20 (16): 2497–513. doi:10.1089 / ars.2012.4869. PMC 4026213. PMID 24094038.
- ^ A b Coles SJ, Hancock JT, Conway ME (únor 2012). „Diferenciální redox potenciál mezi lidskou cytosolickou a mitochondriální aminotransferázou s rozvětveným řetězcem“. Acta Biochimica et Biophysica Sinica. 44 (2): 172–6. doi:10.1093 / abbs / gmr103. PMID 22107788.
- ^ A b Conway ME, Yennawar N, Wallin R, Poole LB, Hutson SM (duben 2003). „Lidská mitochondriální aminotransferáza s rozvětveným řetězcem: strukturální základ pro substrátovou specificitu a roli redox aktivních cysteinů“. Biochimica et Biophysica Acta (BBA) - bílkoviny a proteomika. 3. mezinárodní sympozium o vitaminu B6, PQQ, karbonylové katalýze a chinoproteinech. 1647 (1–2): 61–5. doi:10.1016 / S1570-9639 (03) 00051-7. PMID 12686109.
- ^ A b Harper AE, Miller RH, Block KP (01.01.1984). "Metabolismus aminokyselin s rozvětveným řetězcem". Každoroční přehled výživy. 4 (1): 409–54. doi:10.1146 / annurev.nu.04.070184.002205. PMID 6380539.
- ^ Bixel M, Shimomura Y, Hutson S, Hamprecht B (březen 2001). „Distribuce klíčových enzymů metabolismu aminokyselin s rozvětveným řetězcem v gliových a neuronálních buňkách v kultuře“. The Journal of Histochemistry and Cytochemistry. 49 (3): 407–18. doi:10.1177/002215540104900314. PMID 11181743.
- ^ A b D'Mello JP (2012). Aminokyseliny ve výživě a zdraví člověka. CABI. ISBN 978-1-84593-901-4.
- ^ A b Lin HM, Kaneshige M, Zhao L, Zhang X, Hanover JA, Cheng SY (prosinec 2001). „Izoforma aminotransferázy s rozvětveným řetězcem je nový kopresor pro jaderné receptory hormonů štítné žlázy“. The Journal of Biological Chemistry. 276 (51): 48196–205. doi:10,1074 / jbc.M104320200. PMID 11574535.
- ^ A b C Davoodi J, Drown PM, Bledsoe RK, Wallin R, Reinhart GD, Hutson SM (únor 1998). „Nadměrná exprese a charakterizace lidských mitochondriálních a cytosolických aminotransferáz s rozvětveným řetězcem“. The Journal of Biological Chemistry. 273 (9): 4982–9. doi:10.1074 / jbc.273.9.4982. PMID 9478945.
- ^ A b Zhou Y, Jetton TL, Goshorn S, Lynch CJ, She P (říjen 2010). „Pro stimulaci sekrece inzulínu je nutná transaminace {alfa} -ketoizokaproátu, ale ne leucinů“. The Journal of Biological Chemistry. 285 (44): 33718–26. doi:10.1074 / jbc.M110.136846. PMC 2962470. PMID 20736162.
- ^ Than NG, Sümegi B, Than GN, Bellyei S, Bohn H (2001). „Molekulární klonování a charakterizace placentárního tkáňového proteinu 18 (PP18a) / lidské mitochondriální aminotransferázy s rozvětveným řetězcem (BCATm) a jeho nové alternativně sestříhané varianty PP18b“. Placenta. 22 (2–3): 235–43. doi:10.1053 / plac.2000.0603. PMID 11170829.
- ^ Diebold R, Schuster J, Däschner K, Binder S (červen 2002). „Rodina genů transamináz s rozvětveným řetězcem v Arabidopsis kóduje plastidové a mitochondriální proteiny“. Fyziologie rostlin. 129 (2): 540–50. doi:10.1104 / pp.001602. PMC 161671. PMID 12068099.
- ^ Binder S, Knill T, Schuster J (listopad 2006). "Metabolismus aminokyselin s rozvětveným řetězcem u vyšších rostlin". Physiologia Plantarum. 129 (1): 68–78. doi:10.1111 / j.1399-3054.2006.00800.x.
- ^ Campbell MA, Patel JK, Meyers JL, Myrick LC, Gustin JL (říjen 2001). „Geny kódující aminokyselinu s rozvětveným řetězcem aminotransferázy jsou v rostlinách odlišně exprimovány“. Fyziologie rostlin a biochemie. 39 (10): 855–860. doi:10.1016 / S0981-9428 (01) 01306-7.
- ^ Okada K, Hirotsu K, Sato M, Hayashi H, Kagamiyama H (duben 1997). „Trojrozměrná struktura aminokyseliny s rozvětveným řetězcem Escherichia coli s aminotransferázou v rozlišení 2,5 A“. Journal of Biochemistry. 121 (4): 637–41. doi:10.1093 / oxfordjournals.jbchem.a021633. PMID 9163511.
- ^ A b Yvon M, Chambellon E, Bolotin A, Roudot-Algaron F (únor 2000). „Charakterizace a role aminotransferázy s rozvětveným řetězcem (BcaT) izolované z Lactococcus lactis subsp. Cremoris NCDO 763“. Aplikovaná a environmentální mikrobiologie. 66 (2): 571–7. doi:10.1128 / AEM.66.2.571-577.2000. PMC 91865. PMID 10653720.
- ^ Ananieva EA, Patel CH, Drake CH, Powell JD, Hutson SM (červenec 2014). „Cytosolická rozvětvená aminotransferáza (BCATc) reguluje signalizaci mTORC1 a glykolytický metabolismus v CD4 + T buňkách“. The Journal of Biological Chemistry. 289 (27): 18793–804. doi:10.1074 / jbc.M114.554113. PMC 4081922. PMID 24847056.
- ^ Sweatt AJ, Garcia-Espinosa MA, Wallin R, Hutson SM (září 2004). „Aminokyseliny s rozvětveným řetězcem a metabolismus neurotransmiterů: exprese cytosolické aminotransferázy s rozvětveným řetězcem (BCATc) v mozečku a hipokampu“. The Journal of Comparative Neurology. 477 (4): 360–70. doi:10.1002 / kně.20200. PMID 15329886. S2CID 18780804.
- ^ Gonda I, Bar E, Portnoy V, Lev S, Burger J, Schaffer AA, Tadmor Y, Gepstein S, Giovannoni JJ, Katzir N, Lewinsohn E (únor 2010). „Katabolismus s rozvětveným řetězcem a aromatickými aminokyselinami na těkavé aroma v ovoci Cucumis melo L.“. Journal of Experimental Botany. 61 (4): 1111–23. doi:10.1093 / jxb / erp390. PMC 2826658. PMID 20065117.
- ^ Maloney GS, Kochevenko A, Tieman DM, Tohge T, Krieger U, Zamir D, Taylor MG, Fernie AR, Klee HJ (červenec 2010). "Charakterizace skupiny aminokyselin s rozvětveným řetězcem aminotransferázy v rajčatech". Fyziologie rostlin. 153 (3): 925–36. doi:10.1104 / pp.110.154922. PMC 2899903. PMID 20435740.
- ^ Engels WJ, Alting AC, Arntz MM, Gruppen H, Voragen AG, Smit G, Visser S (srpen 2000). „Částečné čištění a charakterizace dvou aminotransferáz z Lactococcus lactis subsp. Cremoris B78 podílejících se na katabolismu methioninu a aminokyselin s rozvětveným řetězcem“. International Dairy Journal. 10 (7): 443–452. doi:10.1016 / S0958-6946 (00) 00068-6.
- ^ Santiago B, MacGilvray M, Faustoferri RC, Quivey RG (duben 2012). „Aminokyselinová aminotransferáza s rozvětveným řetězcem kódovaná ilvE se podílí na kyselé toleranci u Streptococcus mutans.“. Journal of Bacteriology. 194 (8): 2010–9. doi:10.1128 / JB.06737-11. PMC 3318461. PMID 22328677.
- ^ Taylor PP, Pantaleone DP, Senkpeil RF, Fotheringham IG (říjen 1998). "Nové biosyntetické přístupy k produkci nepřirozených aminokyselin pomocí transamináz". Trendy v biotechnologii. 16 (10): 412–8. doi:10.1016 / S0167-7799 (98) 01240-2. PMID 9807838.
- ^ Hwang B, Cho B, Yun H, Koteshwar K, Kim B (prosinec 2005). „Revize aminotransferázy v genomové éře a její aplikace na biokatalýzu“. Journal of Molecular Catalysis B: Enzymatic. 37 (1–6): 47–55. doi:10.1016 / j.molcatb.2005.09.004.
- ^ Wiffen, Philip J .; Derry, Sheena; Bell, Rae F .; Rice, Andrew S. C .; Tölle, Thomas Rudolf; Phillips, Tudor; Moore, R. Andrew (09.06.2017). "Gabapentin pro chronickou neuropatickou bolest u dospělých". Cochrane Database of Systematic Reviews. 6: CD007938. doi:10.1002 / 14651858.CD007938.pub4. ISSN 1469-493X. PMC 6452908. PMID 28597471.
- ^ Gabapentin pro dospělé s neuropatickou bolestí: přehled klinických důkazů a doporučení [Internet]. Ottawa: Kanadská agentura pro drogy a technologie ve zdravotnictví. 26. září 2014. PMID 25411680.
- ^ Gabapentin pro dospělé s neuropatickou bolestí: přehled klinické účinnosti a bezpečnosti [internet]. Ottawa: Kanadská agentura pro drogy a technologie ve zdravotnictví. 14. dubna 2015. PMID 26180879.
- ^ Backonja M, Glanzman RL (leden 2003). „Dávkování gabapentinu pro neuropatickou bolest: důkazy z randomizovaných, placebem kontrolovaných klinických studií“. Klinická terapeutika. 25 (1): 81–104. doi:10.1016 / s0149-2918 (03) 90011-7. PMID 12637113.
- ^ Goldlust A, Su TZ, Welty DF, Taylor CP, Oxender DL (září 1995). "Účinky antikonvulzivního léčiva gabapentinu na enzymy v metabolických drahách glutamátu a GABA". Výzkum epilepsie. 22 (1): 1–11. doi:10.1016/0920-1211(95)00028-9. PMID 8565962. S2CID 22622907.
- ^ García-Cayuela T, Gómez de Cadiñanos LP, Peláez C, Requena T (říjen 2012). „Exprese funkčních genů souvisejících s katabolismem aminokyselin a tvorbou sýrového aroma v Lactococcus lactis je ovlivněna aminokyselinami s rozvětveným řetězcem“. International Journal of Food Microbiology. 159 (3): 207–13. doi:10.1016 / j.ijfoodmicro.2012.09.002. PMID 23107499.
- ^ Rijnen L, Yvon M, van Kranenburg R, Courtin P, Verheul A, Chambellon E, Smit G (01.01.2003). „Laktokokové aminotransferázy AraT a BcaT jsou klíčové enzymy pro tvorbu aromatických sloučenin z aminokyselin v sýru“. International Dairy Journal. 13 (10): 805–812. doi:10.1016 / S0958-6946 (03) 00102-X.
- ^ Freiding S, Ehrmann MA, Vogel RF (duben 2012). „Srovnání různých aminotransferáz IlvE v Lactobacillus sakei a zkoumání jejich příspěvku k tvorbě aroma z aminokyselin s rozvětveným řetězcem“. Mikrobiologie potravin. Fermentované maso Fermentované maso. 29 (2): 205–14. doi:10.1016 / j.fm.2011.07.008. PMID 22202874.
