Mitochondriální matice - Mitochondrial matrix
| Buněčná biologie | |
|---|---|
| The mitochondrie | |
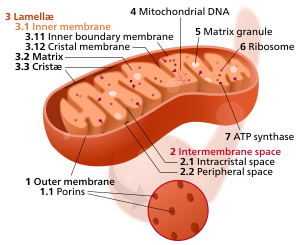 Složky typického mitochondrie
3 Lamela
4 Mitochondriální DNA |
V mitochondrie, matice je prostor uvnitř vnitřní membrány. Slovo „matice“ vychází ze skutečnosti, že tento prostor je viskózní ve srovnání s relativně vodnou cytoplazmou. Mitochondriální matice obsahuje mitochondrie DNA, ribozomy, rozpustný enzymy, malé organické molekuly, nukleotid kofaktory a anorganické ionty.[1] Enzymy v matrici usnadňují reakce odpovědné za produkci ATP, tak jako cyklus kyseliny citronové, oxidační fosforylace, oxidace pyruvát a beta oxidace mastných kyselin.[1]
Složení matice na základě jejích struktur a obsahu vytváří prostředí, které umožňuje anabolický a katabolický způsoby, jak postupovat příznivě. The elektronový transportní řetězec a enzymy v matrici hrají velkou roli v cyklus kyseliny citronové a oxidační fosforylace. The cyklus kyseliny citronové vyrábí NADH a FADH2 oxidací, která bude snížena na oxidační fosforylace k výrobě ATP.[2][3]
Cytosolický, mezimembránový prostor, oddíl má obsah vody 3,8 μL / mg proteinu, zatímco mitochondriální matrix 0,8 μL / mg proteinu.[4] Není známo, jak mitochondrie udržují osmotický rovnováha napříč vnitřní mitochondriální membránou, i když membrána obsahuje aquaporiny které jsou považovány za potrubí pro regulovanou vodní dopravu. Mitochondriální matrice má pH asi 7,8, což je vyšší než pH intermembránového prostoru mitochondrií, které je kolem 7,0–7,4.[5] Mitochondriální DNA objevili Nash a Margit v roce 1963. V mitochondriální matrici je přítomna jedna až mnoho dvouvláknových převážně kruhových DNA. Mitochondriální DNA je 1% z celkové DNA buňky. Je bohatý na guanin a cytosin obsah. Mitochondrie savců mají 55s ribozomy.
Složení
Metabolity
Matice je hostitelem široké škály metabolity účastní se procesů v matici. The cyklus kyseliny citronové zahrnuje acyl-CoA, pyruvát, acetyl-CoA, citrát, isocitrát, α-ketoglutarát, sukcinyl-CoA, fumarát, sukcinát, L-malát, a oxaloacetát.[2] The močovinový cyklus využívá [[ornithinL-ornithin]], karbamoyl fosfát, a L-citrulin.[4] Řetězec transportu elektronů oxiduje koenzymy NADH a FADH2. Syntéza proteinů využívá mitochondriální DNA, RNA, a tRNA.[5] Regulace procesů využívá ionty (Ca.2+ /K.+ /Mg+ ).[6] Další metabolity přítomné v matrici jsou CO2, H2Ó, Ó2, ATP, ADP, a Pi.[1]
Enzymy
Enzymy z procesů probíhajících v matici. Cyklus kyseliny citronové usnadňuje pyruvátdehydrogenáza, citrát syntáza, akonitáza, isocitrát dehydrogenáza, α-ketoglutarát dehydrogenáza, sukcinyl-CoA syntetáza, fumaráza, a malát dehydrogenáza.[2] Cyklus močoviny je usnadněn karbamoylfosfát syntetáza I a ornithin-transkarbamyláza.[4] Použití β-oxidace pyruvátkarboxyláza, acyl-CoA dehydrogenáza, a β-ketothioláza.[1] Produkci aminokyselin usnadňuje transaminázy.[7] Metabolismus aminokyselin je zprostředkován proteázy, jako presekvenční proteáza[8].
Komponenty vnitřní membrány
Vnitřní membrána je a fosfolipidová dvojvrstva který obsahuje komplexy oxidační fosforylace. který obsahuje elektronový transportní řetězec který se nachází na cristae vnitřní membrány a skládá se ze čtyř proteinových komplexů a ATP syntáza. Tyto komplexy jsou komplex I (NADH: koenzym Q oxidoreduktáza), komplex II (sukcinát: koenzym Q oxidoreduktáza), komplex III (koenzym Q: cytochrom c oxidoreduktáza) a komplex IV (cytochrom c oxidáza).[6]
Vnitřní kontrola membrány nad maticovým složením
Elektronový transportní řetězec je odpovědný za stanovení pH a elektrochemický gradient který usnadňuje produkci ATP čerpáním protonů. Gradient také poskytuje kontrolu nad koncentrací iontů, jako je Ca.2+ poháněn potenciálem mitochondriální membrány.[1] Membrána umožňuje pouze nepolární molekuly, jako je CO2 a Ó2 a malé nenabité polární molekuly jako např H2Ó vstoupit do matice. Molekuly vstupují a vystupují z mitochondriální matrice transportní proteiny a iontové transportéry. Molekuly jsou poté schopné mitochondrie opustit porin.[9] Tyto přisuzované charakteristiky umožňují kontrolu nad koncentracemi ionty a metabolity nezbytné pro regulaci a určuje rychlost produkce ATP.[10][11]
Procesy
Cyklus kyseliny citronové
Po glykolýze je cyklus kyseliny citronové aktivován produkcí acetyl-CoA. Oxidace pyruvát pyruvátdehydrogenázou v matrici produkuje CO2, acetyl-CoA a NADH. Beta oxidace mastných kyselin slouží jako náhradník katabolický cesta, která produkuje acetyl-CoA, NADH a FADH2.[1] Produkce acetyl-CoA začíná cyklus kyseliny citronové, zatímco koenzymy vyráběné se používají v elektronový transportní řetězec.[11]

Všechny enzymy pro cyklus kyseliny citronové jsou v matrici (např. citrát syntáza, isocitrát dehydrogenáza, α-ketoglutarát dehydrogenáza, fumaráza, a malát dehydrogenáza ) až na sukcinát dehydrogenáza který je na vnitřní membráně a je součástí bílkoviny komplex II v elektronový transportní řetězec. Cyklus produkuje koenzymy NADH a FADH2 oxidací uhlíků ve dvou cyklech. Oxidace NADH a FADH2 vyrábí GTP ze sukcinyl-CoA syntetázy.[2]
Oxidační fosforylace
NADH a FADH2 jsou produkovány v matrici nebo transportovány přes porin a transportní proteiny, aby prošly oxidací prostřednictvím oxidační fosforylace.[1] NADH a FADH2 podstoupit oxidaci v elektronovém transportním řetězci přenosem an elektrony regenerovat NAD+ a FAD. Protony jsou vtaženy do mezimembránový prostor energií elektronů procházejících elektronovým transportním řetězcem. Čtyři elektrony jsou nakonec přijaty kyslíkem v matrici k dokončení elektronového transportního řetězce. Protony se vracejí do mitochondriální matrice prostřednictvím proteinu ATP syntáza Energie se používá k rotaci ATP syntázy, která usnadňuje průchod protonu a produkuje ATP. Rozdíl pH mezi matricí a mezimembránovým prostorem vytváří elektrochemický gradient, kterým ATP syntáza může příznivě procházet protonem do matrice.[6]
Cyklus močoviny
První dva kroky močovinového cyklu probíhají v mitochondriální matrici jaterních a ledvinových buněk. V prvním kroku amoniak je převeden na karbamoyl fosfát prostřednictvím investice dvou molekul ATP. Tento krok usnadňuje karbamoylfosfát syntetáza I. Druhý krok usnadnil ornithin-transkarbamyláza převádí karbamoyl fosfát a ornitin do citrulin. Po těchto počátečních krocích pokračuje cyklus močoviny ve vnitřním membránovém prostoru, dokud ornithin znovu nevstoupí do matice transportním kanálem a pokračuje prvními kroky v matrici.[12]
Transaminace
α-ketoglutarát a oxaloacetát lze převést na aminokyseliny v matrici procesem transaminace. Tyto reakce usnadňují transaminázy, aby se vytvořily aspartát a asparagin z oxaloacetátu. Produkuje se transaminace α-ketoglutarátu glutamát, prolin, a arginin. Tyto aminokyseliny se poté používají buď v matrici, nebo se transportují do cytosolu k produkci proteinů.[7][13]
Nařízení
Regulace v matici je primárně řízena koncentrací iontů, koncentrací metabolitů a energetickým nábojem. Dostupnost iontů, jako je Ca.2+ řízení různé funkce cyklu kyseliny citrónové. v matici se aktivuje pyruvátdehydrogenáza, isocitrát dehydrogenáza, a α-ketoglutarát dehydrogenáza což zvyšuje reakční rychlost v cyklu.[14] Koncentrace meziproduktů a koenzymů v matrici také zvyšuje nebo snižuje rychlost produkce ATP v důsledku anaplerotický a kataplerotické účinky. NADH může fungovat jako inhibitor pro α-ketoglutarát, isocitrát dehydrogenáza, citrát syntáza, a pyruvátdehydrogenáza. Zejména koncentrace oxaloacetátu je udržována na nízké úrovni, takže jakékoli kolísání těchto koncentrací slouží k posunutí cyklu kyseliny citrónové vpřed.[2] Produkce ATP slouží také jako prostředek regulace tím, že působí jako inhibitor isocitrátdehydrogenázy, pyruvátdehydrogenázy, komplexů proteinů transportního řetězce elektronů a ATP syntázy. ADP funguje jako aktivátor.[1]
Proteosyntéza
Mitochondrie obsahují vlastní sadu DNA používanou k produkci proteinů nacházejících se v řetězci transportu elektronů. Mitochondriální DNA kóduje pouze asi třináct proteinů, které se používají při zpracování mitochondriálních transkriptů, ribozomální proteiny, ribozomální RNA, přenos RNA, a proteinové podjednotky nalezen v proteinové komplexy řetězce transportu elektronů.[15][16]
Viz také
Reference
- ^ A b C d E F G Voet, Donald; Voet, Judith; Pratt, Charlotte (2013). Základy života biochemie na molekulární úrovni. New York City: John Wiley & Sons, Inc., str. 582–584. ISBN 978-1118129180.
- ^ A b C d E Stryer, L; Berg, J; Tymoczko, JL (2002). Biochemie. San Francisco: W.H. Freemane. 509–527, 569–579, 614–616, 638–641, 732–735, 739–748, 770–773. ISBN 978-0-7167-4684-3.
- ^ Mitchell, Peter; Moyle, Jennifer (01.01.1967). "Chemiosmotická hypotéza oxidační fosforylace". Příroda. 213 (5072): 137–139. doi:10.1038 / 213137a0. PMID 4291593.
- ^ A b C Soboll, S; Scholz, R; Freisl, M; Elbers, R; Heldt, H.W. (1976). Distribuce metabolitů mezi mitochondriemi a cytosolem perfundovaných jater. New York: Elsevier. str. 29–40. ISBN 978-0-444-10925-5.
- ^ A b Porcelli, Anna Maria; Ghelli, Anna; Zanna, Claudia; Pinton, Paolo; Rizzuto, Rosario; Rugolo, Michela (2005-01-28). „Rozdíl pH přes vnější mitochondriální membránu měřený zeleným fluorescenčním proteinovým mutantem“. Sdělení o biochemickém a biofyzikálním výzkumu. 326 (4): 799–804. doi:10.1016 / j.bbrc.2004.11.105. PMID 15607740.
- ^ A b C Dimroth, P .; Kaim, G .; Matthey, U. (2000-01-01). „Zásadní role membránového potenciálu pro syntézu ATP syntázami F (1) F (o) ATP“. The Journal of Experimental Biology. 203 (Pt 1): 51–59. ISSN 0022-0949. PMID 10600673.
- ^ A b Karmen, A .; Wroblewski, F .; Ladue, J. S. (01.01.1955). "Aktivita transaminázy v lidské krvi". The Journal of Clinical Investigation. 34 (1): 126–131. doi:10.1172 / JCI103055. ISSN 0021-9738. PMC 438594. PMID 13221663.
- ^ King, John V .; Liang, Wenguang G .; Scherpelz, Kathryn P .; Schilling, Alexander B .; Meredith, Stephen C .; Tang, Wei-Jen (08.07.2014). „Molekulární podstata rozpoznávání a degradace substrátu proteázou lidské presekvence“. Struktura (Londýn, Anglie: 1993). 22 (7): 996–1007. doi:10.1016 / j.str.2014.05.003. ISSN 1878-4186. PMC 4128088. PMID 24931469.
- ^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Roberts, Keith; Peters, Walter; Raff, Martin (1994). Molekulární biologie buňky. New York: Garland Publishing Inc. ISBN 978-0-8153-3218-3.
- ^ Anderson, S .; Bankier, A. T .; Barrell, B. G .; de Bruijn, M. H. L .; Coulson, A. R .; Drouin, J .; Eperon, I.C .; Nierlich, D. P .; Roe, B. A. (09.04.1981). "Pořadí a organizace lidského mitochondriálního genomu". Příroda. 290 (5806): 457–465. doi:10.1038 / 290457a0. PMID 7219534.
- ^ A b Iuchi, S .; Lin, E. C. C. (01.07.1993). "Adaptace Escherichia coli na redoxní prostředí genovou expresí". Molekulární mikrobiologie. 9 (1): 9–15. doi:10.1111 / j.1365-2958.1993.tb01664.x. ISSN 1365-2958. PMID 8412675.
- ^ Tuchman, Mendel; Plante, Robert J. (01.01.1995). "Mutace a polymorfismy v lidském genu pro ornithin-transkarbamylázu: Dodatek k aktualizaci mutací". Lidská mutace. 5 (4): 293–295. doi:10,1002 / humu.1380050404. ISSN 1098-1004. PMID 7627182.
- ^ Kirsch, Jack F .; Eichele, Gregor; Ford, Geoffrey C .; Vincent, Michael G .; Jansonius, Johan N.; Gehring, Heinz; Christen, Philipp (1984-04-15). „Mechanismus účinku aspartátaminotransferázy navržený na základě jeho prostorové struktury“. Journal of Molecular Biology. 174 (3): 497–525. doi:10.1016/0022-2836(84)90333-4. PMID 6143829.
- ^ Denton, Richard M .; Randle, Philip J .; Bridges, Barbara J .; Cooper, Ronald H .; Kerbey, Alan L .; Pask, Helen T .; Severson, David L .; Stansbie, David; Whitehouse, Susan (01.10.1975). "Regulace savčí pyruvátdehydrogenázy". Molekulární a buněčná biochemie. 9 (1): 27–53. doi:10.1007 / BF01731731. ISSN 0300-8177. PMID 171557.
- ^ Fox, Thomas D. (2012-12-01). "Syntéza, import a shromáždění mitochondriálních proteinů". Genetika. 192 (4): 1203–1234. doi:10.1534 / genetika.112.141267. ISSN 0016-6731. PMC 3512135. PMID 23212899.
- ^ Grivell, L.A .; Pel, H. J. (1994). "Syntéza proteinů v mitochondriích" (PDF). Mol. Biol. Rep. 19 (3): 183–194. doi:10.1007 / bf00986960.
