Epoxidreduktáza vitaminu K. - Vitamin K epoxide reductase
| Epoxid reduktáza vitaminu K (citlivá na warfarin) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
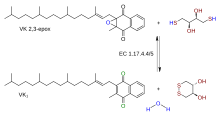 Reakce | |||||||||
| Identifikátory | |||||||||
| EC číslo | 1.17.4.4 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| Epoxidreduktáza vitaminu K. | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikátory | |||||||||
| Symbol | VKOR | ||||||||
| Pfam | PF07884 | ||||||||
| InterPro | IPR012932 | ||||||||
| KOCOUR | 3kp9 | ||||||||
| TCDB | 9.B.265 | ||||||||
| OPM nadčeleď | 18 | ||||||||
| OPM protein | 3kp9 | ||||||||
| |||||||||
Epoxidreduktáza vitaminu K. (VKOR) je enzym (ES 1.17.4.4 ) že snižuje vitamin K. poté, co byl oxidován při karboxylaci kyselina glutamová zbytky v srážení krve enzymy. VKOR je členem velké rodiny predikovaných enzymů, které jsou přítomny u obratlovců, Drosophila, rostliny, bakterie a archaea.[1] V některých rostlina a bakteriální homology, VKOR doména je spojen s domén z thioredoxin rodina oxidoreduktázy.[1]
Čtyři cystein zbytky a jeden zbytek, kterým je buď serin nebo threonin, jsou identifikovány jako pravděpodobné aktivní stránky zbytky.[1] Vyřešené bakteriální struktury VKOR umožnily více poznatků o katalytickém mechanismu. Všechny VKOR jsou transmembránové proteiny s alespoň třemi helixy TM v katalytickém jádru. Chinon, který má být redukován, je vázán redoxně aktivním CXXC motivem v C-koncových šroubovicích, podobně jako DsbB Aktivní stránky. Dva další cysteiny k N-konci jsou umístěny ve smyčce mimo transmembránovou oblast; přenášejí elektrony s redoxním proteinem (nebo v případě bakteriálního homologu s jeho vlastní fúzovanou doménou).[2][3]
Lidský gen pro VKOR se nazývá VKORC1 (VKOR komplexní podjednotka 1). Je cílem antikoagulant warfarin. Jeho partnerem je redoxní protein s neznámou identitou.[4][5] Existuje také podobný gen VKORC1L1.
Reference
- ^ A b C Goodstadt L, Ponting CP (červen 2004). "Vitamin K epoxid reduktáza: homologie, aktivní místo a katalytický mechanismus". Trendy v biochemických vědách. 29 (6): 289–92. doi:10.1016 / j.tibs.2004.04.004. PMID 15276181.
- ^ Li W, Schulman S, Dutton RJ, Boyd D, Beckwith J, Rapoport TA (leden 2010). „Struktura bakteriálního homologu epoxidreduktázy vitaminu K“. Příroda. 463 (7280): 507–12. Bibcode:2010Natur.463..507L. doi:10.1038 / nature08720. PMC 2919313. PMID 20110994.
- ^ Rishavy MA, Usubalieva A, Hallgren KW, Berkner KL (březen 2011). „Nové poznatky o mechanismu oxidoreduktázy vitaminu K (VKOR): elektronové relé prostřednictvím Cys43 a Cys51 snižuje VKOR, aby umožnilo redukci vitaminu K a usnadnilo karboxylaci bílkovin závislou na vitaminu K“. The Journal of Biological Chemistry. 286 (9): 7267–78. doi:10.1074 / jbc.M110.172213. PMC 3044983. PMID 20978134.
- ^ Li T, Chang CY, Jin DY, Lin PJ, Khvorova A, Stafford DW (únor 2004). "Identifikace genu pro vitamin K epoxidreduktázu". Příroda. 427 (6974): 541–4. Bibcode:2004 Natur.427..541L. doi:10.1038 / nature02254. PMID 14765195.
- ^ Rost S, Fregin A, Ivaskevicius V, Conzelmann E, Hörtnagel K, Pelz HJ, Lappegard K, Seifried E, Scharrer I, Tuddenham EG, Müller CR, Strom TM, Oldenburg J (únor 2004). „Mutace ve VKORC1 způsobují rezistenci na warfarin a deficienci mnohočetného koagulačního faktoru typu 2“. Příroda. 427 (6974): 537–41. Bibcode:2004 Natur.427..537R. doi:10.1038 / nature02214. PMID 14765194.
