Acetát železitý - Iron(III) acetate - Wikipedia
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC octan železitý | |
| Ostatní jména zásaditý octan železitý, oxyacetát železitý, octan železitý | |
| Identifikátory | |
3D model (JSmol ) |
|
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Vlastnosti | |
| C14H27Fe3Ó18 | |
| Molární hmotnost | 650,9 g / mol |
| Vzhled | hnědočervený amorfní prášek |
| Rozpustnost | rozpustný v ethanol[2] |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
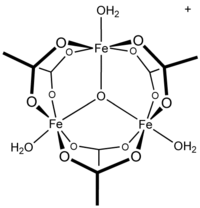
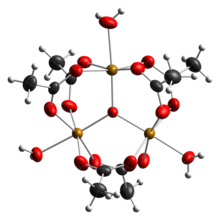
Octan železitý je octanová sůl koordinační komplex [Fe3O (OAc)6(H2Ó)3]+ (OAc− je CH3CO2−). Obvykle je sůl známá jako „zásaditý octan železitý“.[3] Tvorba červenohnědého komplexu byla kdysi použita jako test na železitý ionty.[4]
Struktura a syntéza
Základní formy octanu železa se zpracovávají na vodné roztoky zdrojů železa (III) octanovými solemi.[5] Typickým prekurzorem je čerstvě vysrážený oxid / hydroxid železitý, který neobsahuje halogenidy.[6]
Rané práce ukázaly, že kation je trojjaderný.[7] Fe centra jsou ekvivalentní, každé z nich osmistěn, navázaný na šest kyslíkových ligandů, včetně trojnásobně přemosťujícího oxidu ve středu rovnostranného trojúhelníku.[8] Sloučenina byla časným příkladem molekulárního komplexu železa, který obsahuje oxidový ligand. Kationt idealizoval D.3h symetrie.
Reakce
Terminální aqua ligandy na trimetalické kostře mohou být substituovány jinými ligandy, jako je například pyridin a dimethylformamid. Mnoho různých solí je známo výměnou aniontu, např. [Fe3(μ3-O) (OAc)6(H2Ó)3] Cl. Redukce kationtu poskytuje neutrální derivát se smíšenou valencí, který obsahuje jedno železité a dvě železitá centra.[3] Jsou známy druhy smíšených kovů, například [Fe2CoO (OAc)6(H2Ó)3].[9]
Související sloučeniny
Chrom (III), ruthenium (III), vanad (III) a rhodium (III) tvoří analogické sloučeniny.[10] Acetát železitý (bez oxo ligandu) byl nárokován jako červeně zbarvená sloučenina z reakce octan stříbrný a chlorid železitý.[11]
Použití
Materiály připravené zahříváním železa, kyseliny octové a vzduchu, volně popsané jako bazické octany železa, se používají jako barviva a mořidla.[3]
Acetát železa je často kartáčován na neošetřené dřevo, aby mu dodalo věk.
Viz také
Reference
- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87. vydání). Boca Raton, FL: CRC Press. s. 4–63. ISBN 0-8493-0487-3.
- ^ „Acetát železitý“. EndMemo. Citováno 18. dubna 2015.
- ^ A b C J., Burgess; M. V., Twigg (2005). R. Bruce, král; J., Wiley (eds.). Encyklopedie anorganické chemie (2. vyd.). New York: Wiley. ISBN 978-0-470-86078-6.
- ^ H., Brearley; F., Ibbotson (1902). Analýza ocelářských materiálů. Londýn ; New York: Longmans, Green. Archivovány od originál dne 18. dubna 2015.
- ^ W., Simon (březen 2007). Manuál chemie. str. 474. ISBN 1406733350.
- ^ H. Lux (1963). "Základní octan železitý". V Georg Brauer (ed.). Příručka preparativní anorganické chemie. str. 1508.
- ^ Weinland, R .; Dinkelacker, P. (červenec 1909). „Über Salze einer Hexaacetato (formiato) -trichrombase. II“ (PDF). Berichte der Deutschen Chemischen Gesellschaft. 42 (3): 2997–3018. doi:10,1002 / cber.19090420318.
- ^ Figgis, B. N .; Robertson, G. B. (13. února 1965). "Krystalová-molekulární struktura a magnetické vlastnosti Cr3(CH3.VRKAT)6OCl.5H2Ó". Příroda. 205 (4972): 694–695. doi:10.1038 / 205694a0. Tento článek popisuje isostrukturní sloučeniny chrómu a železa.
- ^ Blake, Antony B .; Yavari, Ahmad; Hatfield, William E .; Sethulekshmi, C. N. (1985). "Magnetické a spektroskopické vlastnosti některých heterotrinukleárních bazických acetátů chromu (III), železa (III) a dvojmocných kovových iontů". Journal of the Chemical Society, Dalton Transactions (12): 2509. doi:10.1039 / DT9850002509.
- ^ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Anorganická chemie, přeloženo Eaglesonem, Mary; Brewer, William, San Diego / Berlin: Academic Press / De Gruyter, ISBN 0-12-352651-5
- ^ Paul, Ram C .; Narula, Ramesh C .; Vasisht, Sham K. (prosinec 1978). "Acetáty železa (III)". Chemie přechodových kovů. 3 (1): 35–38. doi:10.1007 / BF01393501.
| AcOH | On | ||||||||||||||||||
| LiOAc | Být (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | Ahoj | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 ALSOL Al (OAc)2ACH Al2TAK4(OAc)4 | Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Jako (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Pozn | Mo (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | Cd (OAc)2 | v | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Ta | Ž | Re | Os | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Bi (OAc)3 | Po | Na | Rn | |||
| Fr. | Ra | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La (OAc)3 | Ce (OAc)X | Pr | Nd | Odpoledne | Sm (OAc)3 | EU (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Ho (OAc)3 | Er | Tm | Yb (OAc)3 | Lu (OAc)3 | |||||
| Ac | Čt | Pa | UO2(OAc)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||
