Octan chromitý - Chromium(II) acetate
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Hydrát octanu chromitého | |
| Ostatní jména octan chromitý, diacetát chromitý, ethanoát chromitý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.224.848 |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C8H16Cr2Ó10 | |
| Molární hmotnost | 376.198 g · mol−1 |
| Vzhled | cihlově červená pevná látka |
| Hustota | 1,79 g / cm3 |
| Bod tání | dehydratuje |
| rozpustný v horké vodě, MeOH | |
| -5104.0·10−6 cm3/ mol | |
| Struktura | |
| monoklinický | |
| osmistěn počítání vazby Cr – Cr | |
| čtyřnásobná vazba Cr – Cr | |
| 0 D | |
| Nebezpečí | |
| Hlavní nebezpečí | mohl exotermicky reagovat ve vzduchu |
| Související sloučeniny | |
Související sloučeniny | Rh2(OAc)4(H2Ó)2 Cu2(OAc)4(H2Ó)2, octan molybdeničitý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
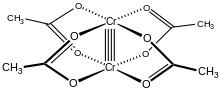
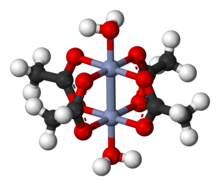
Hydrát octanu chromitého, také známý jako octan chromitý, je koordinační sloučenina s vzorec Cr2(CH3CO2)4(H2Ó)2. Tento vzorec je běžně zkrácen Cr2(OAc)4(H2Ó)2. Tato červeně zbarvená směs má a čtyřnásobná vazba. Příprava octanu chromitého byla jednou standardní zkouškou syntetických dovedností studentů kvůli své citlivosti na vzduch a dramatické barevné změny, které doprovázejí jeho oxidaci. Existuje jako dihydrát a bezvodý formuláře.
Cr2(OAc)4(H2Ó)2 je načervenalý diamagnetický prášek, i když ve tvaru diamantu krystaly lze pěstovat. V souladu se skutečností, že to neníiontový, Cr2(OAc)4(H2Ó)2 vykazuje špatnou rozpustnost v voda a methanolu.

Struktura
The Cr2(OAc)4(H2Ó)2 molekula obsahuje dva atomy chrom, dva ligován molekuly vody a čtyři acetát přemosťující ligandy. Koordinační prostředí kolem každého atomu chrómu se skládá ze čtyř kyslík atomy (jeden z každého acetátového ligandu) ve čtverci, jedna molekula vody (v axiální poloze) a druhý atom chrómu (naproti molekule vody), což dává každému centru chrómu oktaedrická geometrie. Atomy chrómu jsou spojeny čtyřnásobnou vazbou a molekula má D4h symetrie (ignorování polohy atomů vodíku). Stejnou základní strukturu přijímá Rh2(OAc)4(H2Ó)2 a Cu2(OAc)4(H2Ó)2, i když tyto druhy nemají tak krátké kontakty M – M.[1]
Čtyřnásobná vazba mezi dvěma atomy chrómu vzniká překrytím čtyř d-orbitaly na každém kovu se stejnými orbitaly na druhém kovu: dz2 orbitaly se překrývají a dávají a sigma lepení složka, dxz adyz orbitaly se překrývají a dávají dva spojení pi komponenty a dxy orbitaly dávají a delta vazba. Tuto čtyřnásobnou vazbu potvrzuje i nízká hodnota magnetický moment a krátká mezimolekulární vzdálenost mezi dvěma atomy 236,2 ± 0,1odpoledne. Vzdálenosti Cr – Cr jsou ještě kratší, což je rekord 184 pm, když chybí axiální ligand nebo je karboxylát nahrazen izoelektronickými dusíkatými ligandy.[2]
Dějiny
Eugène-Melchior Péligot poprvé ohlásil octan chromitý v roce 1844. Jeho materiál byl zjevně dimerní Cr2(OAc)4(H2Ó)2.[3][4] Neobvyklá struktura, stejně jako struktura octan měďnatý, byla odkryta v roce 1951.[5]
Příprava
Příprava obvykle začíná redukcí vodného roztoku sloučeniny Cr (III) za použití zinek.[6] Na výsledný modrý roztok se působí octan sodný, což vede k rychlému srážky octanu chromitého ve formě jasně červeného prášku.
- 2 kr3+ + Zn → 2 kr2+ + Zn2+
- 2 kr2+ + 4 OAc− + 2 H2O → Cr2(OAc)4(H2Ó)2
Syntéza Cr2(OAc)4(H2Ó)2 se tradičně používá k testování syntetických dovedností a trpělivosti studentů anorganické laboratoře v vysoké školy protože náhodné vniknutí malého množství vzduchu do zařízení je snadno indikováno změnou barvy jinak jasně červeného produktu.[7] Bezvodou formu octanu chromitého a také příbuzné karboxyláty chromité lze připravit z chromocen:
- 4 RCO2H + 2 Cr (C.5H5)2 → Cr2(Ó2ČR)4 + 4 C5H6
Tato metoda poskytuje bezvodé deriváty přímým způsobem.[8]
Protože je tak snadno připravitelný, Cr2(OAc)4(H2Ó)2 je výchozím materiálem pro další sloučeniny chrómu (II). Mnoho analogů bylo také připraveno za použití jiných karboxylové kyseliny místo octanu a místo vody se používají různé zásady.
Aplikace
Octan chromitý má několik praktických aplikací. Používá se k dehalogenaci organických sloučenin, jako jsou a-bromketony a chlorhydriny.[9] Zdá se, že reakce probíhají přes 1e− kroky a někdy jsou pozorovány produkty přeskupení.
Protože sloučenina je dobrým redukčním činidlem, bude snižovat O2 nachází se ve vzduchu a lze jej použít jako pračku kyslíku.
Viz také
Reference
- ^ Cotton, F. A.; Walton, R. A. (1993). Několik vazeb mezi kovovými atomy. Oxford: Oxford University Press. ISBN 0-19-855649-7.
- ^ Cotton, F. A.; Hillard, E.A.; Murillo, C. A .; Zhou, H.-C. (2000). „Po 155 letech krystalický karboxylát chromu s vazbou Supershort Cr – Cr“. J. Am. Chem. Soc. 122 (2): 416–417. doi:10.1021 / ja993755i.
- ^ Péligot, E.-M. (1844). „Sur un nouvel oxide de chrome“ [Na novém oxidu chromu]. C. R. Acad. Sci. (francouzsky). 19: 609–618.
- ^ Péligot, E.-M. (1844). „Recherches sur le chrom“ [Výzkum chromu]. Ann. Chim. Phys. (francouzsky). 12: 527–548.
- ^ Van Niekerk, J. N .; Schoening, F. R. L. (1953). „Rentgenový důkaz pro vazby kov na kov v měďnatém a chromovém octanu“. Příroda. 171 (4340): 36–37. doi:10.1038 / 171036a0.
- ^ Ocone, L.R .; Block, B.P. (1966). „Bezvodý octan chromitý, 1-hydrát octanu chromitého a Bis (2,4-pentandionato) chrom (II)“. Inorg. Synth. 8: 125–129. doi:10.1002 / 9780470132395.ch33. ISBN 978-0-470-13239-5.
- ^ Jolly, W. L. (1970). Syntéza a charakterizace anorganických sloučenin. Prentice Hall. str.442–445.
- ^ Beneš, L .; Kalousová, J .; Votinský, J. (1985). "Reakce chromocenu s karboxylovými kyselinami a některými deriváty kyseliny octové". J. Organomet. Chem. 290: 147–151. doi:10.1016 / 0022-328X (85) 87428-3.
- ^ Ray, T. (2004). „Acetát chromitý (II)“. V Paquette, L. (ed.). Encyklopedie činidel pro organickou syntézu. New York, NY: J. Wiley & Sons. doi:10.1002 / 047084289X.
Další čtení
- Rice, Steven F .; Wilson, Randall B .; Solomon, Edward I. (1980). "Elektronové absorpční spektrum dihydrátu octanu chromitého a souvisejících binukleárních chromových karboxylátů". Inorg. Chem. 19 (11): 3425–3431. doi:10.1021 / ic50213a042.
externí odkazy
- http://www.molecules.org/coordcpds.html#Cr2OAc4H2O
- http://alpha.chem.umb.edu/chemistry/ch370/documents/CH371chromiumacetate06.pdf[trvalý mrtvý odkaz ] (zastaralý)
- http://wwwchem.uwimona.edu.jm/courses/chromium.pdf
Acetylhalogenidy a jejich soli acetát ion | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | On | ||||||||||||||||||
| LiOAc | Být (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | Ahoj | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 ALSOL Al (OAc)2ACH Al2TAK4(OAc)4 | Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Jako (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Pozn | Mo (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | Cd (OAc)2 | v | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Ta | Ž | Re | Os | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Bi (OAc)3 | Po | Na | Rn | |||
| Fr. | Ra | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La (OAc)3 | Ce (OAc)X | Pr | Nd | Odpoledne | Sm (OAc)3 | EU (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Ho (OAc)3 | Er | Tm | Yb (OAc)3 | Lu (OAc)3 | |||||
| Ac | Čt | Pa | UO2(OAc)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||
