Octan chromitý - Chromium(III) acetate
 | |
| Jména | |
|---|---|
| Název IUPAC Hydrát octanu chromitého | |
| Ostatní jména octan chromitý, triacetát chromitý, ethanoát chromitý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.012.646 |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C12H36ClCr3Ó22 | |
| Molární hmotnost | 723.84 g · mol−1 |
| Vzhled | šedozelená až modrozelená pevná látka |
| Hustota | 1,662 g / cm3 |
| -5104.0·10−6 cm3/ mol | |
| Struktura | |
| osmistěn | |
| Související sloučeniny | |
Související sloučeniny | Octan manganatý Acetát železitý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
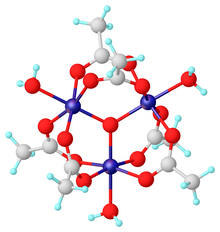
Octan chromitý, běžně známý jako základní octan chromitý,[1] popisuje rodinu soli kde kation má vzorec [Cr3O (O.2CCH3)6(ACH2)3]+. Trichromový kation se setkává s řadou aniontů, jako je chlorid a dusičnan. Údaje v tabulce výše platí pro hexahydrát chloridu, [Cr3O (O.2CCH3)6(ACH2)3] Cl (H2Ó)6.
Soli zásaditého octanu chromitého již dlouho přitahují pozornost díky své výrazné struktuře, která se vyznačuje oktaedrickými středy Cr (III), trojitým přemostěním oxo ligand, šest acetát ligandy a tři aqua ligandy.[1] Stejná struktura je sdílena se zásaditým octanem železitým a zásaditým octanem manganatým.[1][2] Existuje jen málo důkazů pro jednoduchý octan chromitý, tj. Chybí oxo ligand.[3] Octan chromitý je modrý / šedozelený prášek, který je rozpustný ve vodě. Stále je[2] připraven podle původního postupu z roku 1909.[4]

Viz také
Reference
- ^ A b C Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ A b Kurt J. Schenk, Hans U. Güdel (1982). „Nízkoteplotní strukturní a spektroskopické vlastnosti [Cr3O (CH3VRKAT)6(H2Ó)3] Cl.6H2Ó". Inorg. Chem. 21 (6): 2253–2256. doi:10.1021 / ic00136a025.CS1 maint: používá parametr autoři (odkaz)
- ^ Erre, Liliana Strinna; Micera, Giovanni; Glowiak, Tadeusz; Kozlowski, Henry (duben 1997). „Acetát chromitý (III), hydroxid octový (III), nebo µ3-Oxo-esakis- (µ2-acetato-O, O ') - triaqua-trichromium (III) octan? Stanovení struktury komplexní sloučeniny analytickými a Spektroskopické metody “. Journal of Chemical Education. 74 (4): 432. doi:10.1021 / ed074p432.
- ^ R. Weinland P. Dinkelacker (1909). „Über Salze einer Hexaacetato (formiato) ‐trichrombase. II“. Berichte der Deutschen Chemischen Gesellschaft. 42 (3): 2997–3018. doi:10,1002 / cber.19090420318.CS1 maint: používá parametr autoři (odkaz)
Acetylhalogenidy a jejich soli acetát ion | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | On | ||||||||||||||||||
| LiOAc | Být (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | Ahoj | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 ALSOL Al (OAc)2ACH Al2TAK4(OAc)4 | Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Jako (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Pozn | Mo (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | Cd (OAc)2 | v | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Ta | Ž | Re | Os | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Bi (OAc)3 | Po | Na | Rn | |||
| Fr. | Ra | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La (OAc)3 | Ce (OAc)X | Pr | Nd | Odpoledne | Sm (OAc)3 | EU (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Ho (OAc)3 | Er | Tm | Yb (OAc)3 | Lu (OAc)3 | |||||
| Ac | Čt | Pa | UO2(OAc)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||
