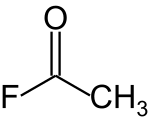
Acetylfluorid - Acetyl fluoride
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC Acetylfluorid | |
| Systematický název IUPAC Ethanoylfluorid | |
| Ostatní jména Methylkarbonylfluorid | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.008.354 |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C2H3FÓ | |
| Molární hmotnost | 62.043 g · mol−1 |
| Hustota | 1,032 g / cm3 |
| Bod tání | -84 ° C (-119 ° F; 189 K) |
| Bod varu | 21 ° C (70 ° F; 294 K)[1] |
| Nebezpečí | |
| Piktogramy GHS |  |
| Signální slovo GHS | Nebezpečí |
| H314 | |
| P260, P264, P280, P301 + 330 + 331, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P321, P363, P405, P501 | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Acetylfluorid je acylhalogenid s chemický vzorec CH3COF.[2]
Syntéza
Acetylfluorid se syntetizuje za použití fluorovodík a anhydrid kyseliny octové. Octová kyselina se vyrábí jako vedlejší produkt.[3]
- HF + (CH
3CO)
2Ó → CH
3CO
2H + CH
3COF
Viz také
Reference
- ^ „Acetylfluorid“. Archivovány od originál dne 2014-03-28. Citováno 2012-03-07.
- ^ "Acetylfluorid". NIST. Archivovány od originál dne 21. února 2019. Citováno 7. března 2012.
- ^ Tanaka, Mutsuo; Fujiwara, Masahiro; Ando, Hisanori (1995). „Duální reaktivita formymového kationu jako elektrofilu a kyseliny rozvětvené v superkyselinách“. Journal of Organic Chemistry. 60 (12): 3846–3850. doi:10.1021 / jo00117a041.
| Tento článek o organický halogenid je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
