Thioantimoničnan sodný - Sodium thioantimoniate
 | |
| Jména | |
|---|---|
| Název IUPAC Tetrathioantimonát sodný (V) | |
| Identifikátory | |
| Informační karta ECHA | 100.208.207 |
Řídicí panel CompTox (EPA) | |
| Vlastnosti | |
| Na3SbS4· 9H2Ó | |
| Vzhled | Žluté krystaly |
| Hustota | 1,806 g / cm3, pevný |
| Bod tání | 87 ° C (189 ° F; 360 K) |
| Související sloučeniny | |
jiný kationty | Thioantimoničnan draselný |
Související sloučeniny | Sulfid antimonitý (III) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Thioantimoničnan sodný je anorganická sloučenina s vzorec Na3SbS4. Nehydrát tohoto materiálu je známý jako Schlippeova sůl, pojmenované podle K. F. Schlippeho (1799–1867), Tyto sloučeniny jsou příklady sulfosoly. Kdysi byly zajímavé jako druhy generované v kvalitativní anorganická analýza.
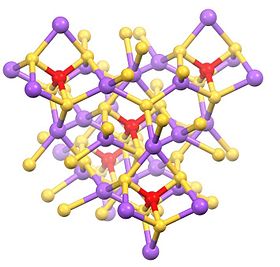
Struktura
Tato hydratovaná sůl se skládá z čtyřbokého SbS43− anion (rSb-S = 2,33 Å) a sodné kationty, které jsou hydratovaný.[1][2] Příbuzné soli jsou známé pro různé kationty včetně amonný a draslík.
Bezvodá sůl je polymer s čtyřstěnnými místy Na a Sb.[3]
Příprava
Thioantimoničnan sodný se připravuje reakcí trisulfid antimonitý, elementární síra a vodné sulfid zdroj.
- 3 Na2S + 2 S + Sb2S3 + 9 hodin2O → 2 Na3SbS4· 9 hodin2Ó
Sulfid může být generován nepřímo tepelnou reakcí elementární síry s hydroxid sodný nebo dokonce dřevěné uhlí:
- Sb2S3 + 8 NaOH + 6 S → 2 Na3SbS4 + Na2TAK4 + 4 H2Ó
Na druhé cestě je směs síran sodný (16 dílů) se redukuje fúzí s dřevěné uhlí (4 až 5 dílů) v přítomnosti antimonu sulfid (13 dílů). Tavenina se extrahuje do voda který je ošetřen sírou (4 díly). Po odpaření roztoku se sůl krystalizuje jako velký čtyřstěn, které jsou snadno rozpustné ve vodě. The bezvodý sůl se při zahřátí snadno roztaví a ve vlhkém stavu se po vystavení vlhkému vzduchu potáhne červeným filmem.
Požadovaný sulfid antimonitý se připraví obvyklým způsobem zpracováním prakticky jakékoli sloučeniny Sb (III) zdroji sulfidu:
- 2 SbCl3 + 3 H2S → Sb2S3 + 6 HCl
Reakce
Hydrát se rozpouští ve vodě a získá se čtyřboký SbS43− ion. Sůl po okyselení poskytuje „chinsulfidový antimon“:
- 2 Na3SbS4 + 6 HCl → Sb2S5 + 6 NaCl + 3 H2S
Poznámky
- ^ Krebs, B., „Thio- a Seleno sloučeniny hlavních skupinových prvků - nové anorganické oligomery a polymery“, Angewandte Chemie, 1983, svazek 95, strany 113-34.
- ^ K. Mereiter, A. Preisinger a H. Guth „Vodíkové vazby ve Schlippeho soli: zdokonalení krystalových struktur Na3SbS4.9H2O rentgenovou difrakcí a Na3SbS4.9D2O neutronovou difrakcí při teplotě místnosti "Acta Crystallographica 1979, roč. B35, 19-25. doi:10.1107 / S0567740879002442.
- ^ H. A. Graf, H. Schäfer "Zur Strukturchemie der Alkalisalze der Tetrathiosäuren der Elemente der 5. Hauptgruppe (strany 67–80) Zeitschrift für Anorganische und Allgemeine Chemie 1976, sv. 425, str. 67-p80. doi:10.1002 / zaac.19764250109
Reference
 Tento článek včlení text z publikace nyní v veřejná doména: Chisholm, Hugh, ed. (1911). "Schlippeova sůl ". Encyklopedie Britannica (11. vydání). Cambridge University Press.
Tento článek včlení text z publikace nyní v veřejná doména: Chisholm, Hugh, ed. (1911). "Schlippeova sůl ". Encyklopedie Britannica (11. vydání). Cambridge University Press.
