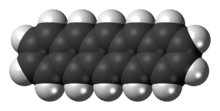
Pentacen - Pentacene
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC Pentacen | |
| Ostatní jména 2,3: 6,7-Dibenzanthracen Benzo [b] naftacen Dibenz [b, i] anthracen NSC 90784 lin-dibenzanthracen lin-naftoantracen | |
| Identifikátory | |
3D model (JSmol ) | |
| 1912418 | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.004.722 |
| Číslo ES |
|
| 733903 | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C22H14 | |
| Molární hmotnost | 278.354 g · mol−1 |
| Vzhled | Tmavě modrý prášek |
| Hustota | 1,3 g cm−3 |
| Bod tání | > 300 ° C (572 ° F; 573 K) sublimuje při 372 ° C |
| Bod varu | 40–43 ° C (104–109 ° F; 313–316 K) při 0,15 torr |
| -205.4 × 10−6 cm3 mol−1 | |
| Struktura | |
| Triclinic | |
| P-1 | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Pentacen je polycyklický aromatický uhlovodík skládající se z pěti lineárně fúzovaných benzen prsteny. Toto velmi konjugované sloučenina je organický polovodič. Sloučenina generuje excitony po absorpci ultrafialového záření (UV ) nebo viditelné světlo; díky tomu je velmi citlivý na oxidaci. Z tohoto důvodu se tato sloučenina, která je fialovým práškem, pomalu vystavuje působení vzduchu a světla.
Strukturálně je pentacen jedním z lineárních aceny předchozí tetracen (čtyři kondenzované benzenové kruhy) a další hexacen (šest kondenzovaných benzenových kruhů). V srpnu 2009 zveřejnila skupina vědců z IBM experimentální výsledky zobrazování jediného molekula pentacenu pomocí an mikroskop atomové síly.[1][2] V červenci 2011 použili modifikaci skenovací tunelovací mikroskopie experimentálně určit tvary nejvyšší obsazené a nejnižší neobsazené molekulární orbitaly.[3][4]
V roce 2012 dopovaný pentacenem p-terfenyl Ukázalo se, že je účinné jako médium zesilovače pro pokojovou teplotu maser.[5]
Syntéza


Pentacen byl poprvé syntetizován v roce 1912 britskými chemiky William Hobson Mills a Mildred May Gostling.[7][8] Klasická metoda pro syntézu pentacenu je metodou Reakce Labe.[9][10]
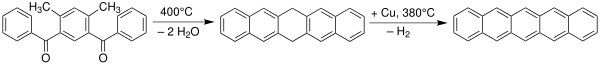
Pentaceny lze také připravit vytlačování malé těkavé složky (kysličník uhelnatý ) z vhodného prekurzoru při 150 ° C.[11]

Samotný předchůdce se připravuje ve třech krocích ze dvou molekul α, α, α ', α'-tetrabromo-Ó-xylen se 7-tert-butoxybicyklo [2.2.1] hepta-2,5-dien prvním zahřátím s jodid sodný v dimethylformamid podstoupit řadu odstranění a Diels – Olše reakce za vzniku kruhového systému, poté hydrolyzuje tert-butoxy skupina do alkohol a následuje jeho oxidace na keton.[11]
Uvádí se, že produkt má určitou rozpustnost v chloroform a je tedy přístupný rotační povlak. Pentacen je rozpustný v horkých chlorovaných benzenech, jako je např 1,2,4-trichlorbenzen, ze kterého lze rekrystalizovat za vzniku krevních destiček.
Deriváty pentacenu
Monomerní deriváty pentacenu
6,13-Substituované pentaceny jsou přístupné prostřednictvím pentacenchinonu reakcí s arylovým nebo alkinylovým nukleofilem (například Grignardovým nebo organolithným činidlem), po které následuje redukční aromatizace.[12][13][14] Další metoda je založena na homologizaci diynes přechodnými kovy (prostřednictvím zirkonacyklopentadienů) [15][16][17][18][19] Funkcionalizace pentacenu umožnila kontrolu tuhého stavu balení tohoto chromoforu.[20][21] Volba substituentů (jak velikost, tak místo substituce na pentacenu) ovlivňuje obal v pevném stavu a lze ji použít k řízení toho, zda sloučenina přijímá 1-dimenzionální nebo 2-dimenzionální kofacial skládání pí v pevném stavu, na rozdíl od balení rybí kosti pozorovaného u pentacenu.
Ačkoli se struktura pentacenu podobá struktuře jiných aromatických sloučenin anthracen, své aromatický vlastnosti jsou špatně definované; jako takový je pentacen a jeho deriváty předmětem mnoha výzkumů.
A tautomerní chemická rovnováha existuje mezi 6-methylen-6,13-dihydropentacen a 6-methylpentacen.
 Rovnováha 6-methylpentacenu
Rovnováha 6-methylpentacenu
Tato rovnováha je zcela ve prospěch methylenové sloučeniny. Pouze zahřátím roztoku sloučeniny na 200 ° C se vyvíjí malé množství pentacenu, o čemž svědčí vznik červenofialového zbarvení. Podle jedné studie[22] the mechanismus reakce protože tato rovnováha není založena na intramolekulární 1,5-hydridový posun, ale na a bimolekulární volné radikály migrace vodíku. V porovnání, isotolueny se stejným centrálním chemickým motivem snadno aromatizuje.
Pentacen reaguje s elementárními síra v 1,2,4-trichlorbenzen ke sloučenině hexathiapentacen.[23] Rentgenová krystalografie ukazuje, že veškerý uhlík k síře délky vazby jsou zhruba stejné (170 odpoledne ); z toho vyplývá, že rezonanční struktury B a C s úplnou separací náboje jsou významnější než struktura A.
 Hexathiapentacen
Hexathiapentacen
V krystalové fázi se molekuly zobrazují aromatické stohovací interakce, přičemž vzdálenost mezi některými atomy síry na sousedních molekulách může být menší (337 pm) než součet dvou Van der Waalsovy poloměry (180 hodin)
Jako související tetrathiafulvalen, tato sloučenina je studována v oboru organické polovodiče.
Aceny se mohou jevit jako rovinné a tuhé molekuly, ale ve skutečnosti mohou být velmi zkreslené. Pentacen znázorněný níže:[24]
 Zkroucené aceny
Zkroucené aceny
má end-to-end twist 144 ° a je stericky stabilizován šesti fenyl skupiny. Sloučeninu lze rozdělit na dvě enantiomery s neobvykle vysokou hlášenou optická rotace 7400 ° racemizace probíhá s chemický poločas 9 hodin.
Oligomery a polymery pentacenu

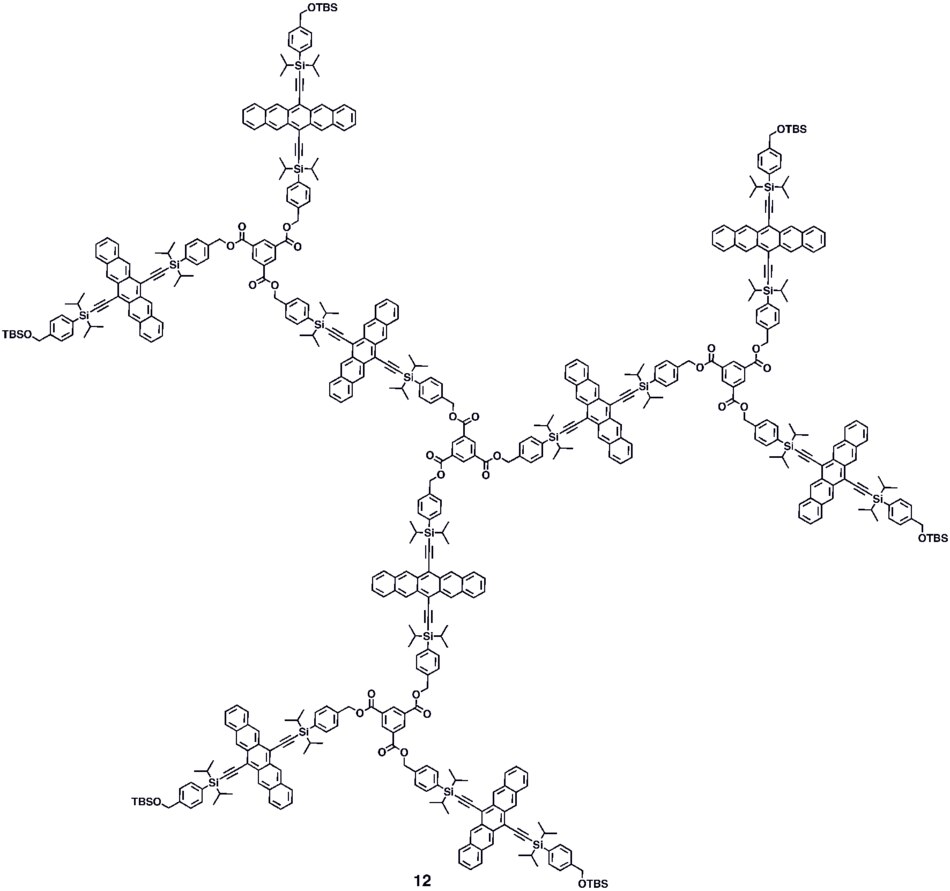
Oligomery a polymery založené na pentacenu byly prozkoumány jak synteticky, tak v nastavení aplikace zařízení.[25][26] Polymerní světlo emitující diody (PLEDy ) byly konstruovány pomocí konjugovaných kopolymerů (1a – b) obsahující fluoren a pentacen.[27] Několik dalších konjugovaných polymerů pentacenu (2a – b a 3) byly realizovány na základě Sonogashira a Suzuki kopulační reakce monomeru dibromopentacenu.[28][29] Nekonjugované polymery na bázi pentacenu byly syntetizovány esterifikací monomeru pentacendiolu s chloridy bis-kyselin za vzniku polymerů 4a – b.[30][31]

Pro přípravu konjugovaných oligomerů pentacenu byly použity různé syntetické strategie 5a – c včetně postupu vytváření vazby jeden hrnec se čtyřmi vazbami, který poskytl roztokem zpracovatelný konjugovaný pentacenový dimer (5c) které vykazovaly fotovodivý zisk> 10,[32] uvedení jeho výkonu do stejného řádu jako tepelně odpařené filmy nefunkčního pentacenu, které vykazovaly fotovodivý zisk> 16 za použití analogických měřicích technik.[33] Modulární syntetická metoda pro konjugované pentacenové di-, tri- a tetramery (6–8), který je založen na homo- a cross-coupling reakcích robustních dehydropentacenových meziproduktů.[34] Nekonjugované oligomery 9–10 na bázi pentacenu byly syntetizovány,[30][31] včetně dendrimerů 9–10 s až 9 pentacenovými skupinami na molekulu s molární absorpcí pro nejintenzivnější absorpci> 2 000 000 M−1•cm−1. Dendrimery 11–12 Bylo prokázáno, že mají lepší výkon v zařízeních ve srovnání s analogickými polymery na bázi pentacenu 4a – b v kontextu fotodetektorů.[35]

Materiálový výzkum
Pentaceny byly zkoumány jako potenciální dichroická barviva. Níže zobrazený pentacenochinon je fluorescenční a po smíchání s směs E7 z tekutých krystalů A dichroický poměr je dosaženo 8.[36][37] Delší aceny se lépe vyrovnají v nematic tekutý krystal fáze.
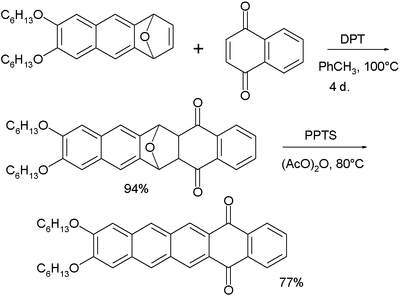 Fluorescenční acenochinony
Fluorescenční acenochinony
Zkombinováno s buckminsterfullerene, pentacen se používá při vývoji organických fotovoltaických prototypů.[38][39] Organické fotovoltaické články jsou levnější a pružnější než tradiční anorganické články, což by na nových trzích mohlo potenciálně otevřít dveře solárním článkům.[40]
Pentacen je populární volbou pro výzkum organických látek tenkovrstvé tranzistory a OFETY je jednou z nejdůkladněji zkoumaných konjugovaných organických molekul s vysokým aplikačním potenciálem díky pohyblivosti děr v OFET až 5,5 cm2/ (V · s), který převyšuje amorfní křemík.[41][42][43]
Pentacen, stejně jako další organické vodiče, podléhá rychlé oxidaci na vzduchu, což vylučuje komercializaci. Pokud je pentacen preoxidován, je pentacen-chinon potenciálním izolátorem brány, pak se mobilita může přiblížit mobilitě rubren - organický polovodič s nejvyšší mobilitou - konkrétně 40 cm2/ (V · s). Tato technika oxidace pentacenu je obdobou oxidace křemíku používaného v křemíkové elektronice.[42]
Viz také
Reference
- ^ „Ohromující obraz jedné molekuly“. BBC novinky. 2009-08-28. Citováno 2009-08-28.
- ^ Gross, L .; Mohn, F; Moll, N; Liljeroth, P; Meyer, G (2009). "Chemická struktura molekuly vyřešená mikroskopií atomové síly". Věda. 325 (5944): 1110–1114. Bibcode:2009Sci ... 325.1110G. doi:10.1126 / science.1176210. PMID 19713523. S2CID 9346745.
- ^ Krieger, K. (23. srpna 2011). „Molekuly zobrazené nejdůvěrněji“. Věda teď. Citováno 29. června 2017.
- ^ Gross, L .; Moll, N .; Mohn, F .; Curioni, A .; Meyer, G .; Hanke, F .; Persson, M. (2011). „Molekulární orbitální zobrazování s vysokým rozlišením pomocí a p-Wave STM Tip ". Phys. Rev. Lett. 107 (8): 86101–86104. Bibcode:2011PhRvL.107h6101G. doi:10.1103 / PhysRevLett.107.086101. PMID 21929180.
- ^ Brumfiel, G. (2012). „Mikrovlnný laser splňuje 60 let slibu“. Příroda. doi:10.1038 / příroda.2012.11199. S2CID 124247048.
- ^ Dinca, L. E.; De Marchi, F .; MacLeod, J. M .; Lipton-Duffin, J .; Gatti, R .; Ma, D .; Perepichka, D. F.; Rosei, F. (2015). „Pentacen na Ni (111): Molekulární náplň při pokojové teplotě a teplotně aktivovaná přeměna na grafen“. Nanoměřítko. 7 (7): 3263–3269. Bibcode:2015Nanos ... 7.3263D. doi:10.1039 / C4NR07057G. PMID 25619890.
- ^ Mills, William Hobson; Mills, Mildred (1912). „CCXXX. — Syntetická výroba derivátů dinafthanthracenu“. J. Chem. Soc., Trans. 101: 2194–2208. doi:10.1039 / CT9120102194.
- ^ Chung, Hyunjoong; Diao, Ying (2016). „Polymorfismus jako nastupující designová strategie pro vysoce výkonnou organickou elektroniku“. J. Mater. Chem. C. 4 (18): 3915–3933. doi:10.1039 / C5TC04390E.
Od syntézy v roce 1912 až po kategorizaci nejméně čtyř různých polymorfů v roce 2003 se pentacen vyvinul ve srovnávací organický polovodič díky vynikajícímu výkonu tenkého filmu
- ^ Elbs, Karl (1886). „Beiträge zur Kenntniss aromatischer Ketone. Erste Mittheilung“. J. Prakt. Chem. (v němčině). 33 (1): 180–188. doi:10.1002 / prac.18860330119.
- ^ Breitmaier, Eberhard; Jung, Günther (2005). „12.5.3 Elbs-Reaktion“. Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstrukturen (v němčině) (5. vydání). Stuttgart: Georg Thieme Verlag. p. 183. ISBN 9783135415055.
- ^ A b Chen, Kew-Yu; Hsieh, Hsing-Hung; Wu, Chung-Chih; Hwang, Jiunn-Jye; Chow, Tahsin J. (2007). „Nový typ rozpustného prekurzoru pentacenu pro organické tenkovrstvé tranzistory“ (PDF). Chem. Commun. 2007 (10): 1065–1067. doi:10.1039 / b616511g. PMID 17325807.
- ^ Allen, C. F. H .; Bell, Alan (1942). „Působení Grignardových činidel na určité pentacenchinony, 6,13-difenylpentacen“. Journal of the American Chemical Society. 64 (6): 1253–1260. doi:10.1021 / ja01258a005.
- ^ Maulding, D. R .; Roberts, Bernard G. (1969). "Elektronická absorpce a fluorescence fenylethynylem substituovaných acenů". The Journal of Organic Chemistry. 34 (6): 1734–1736. doi:10.1021 / jo01258a045.
- ^ Li, Shi; Zhou, Lishan; Nakajima, Kiyohiko; Kanno, Ken-Ichiro; Takahashi, Tamotsu (2010). „Syntéza 1,2,3,4,8,9,10,11-oktasubstituovaných derivátů pentacenchinonu a jejich přeměna na substituované pentaceny“. Chemistry: An Asian Journal. 5 (7): 1620–6. doi:10.1002 / Asie.200900754. PMID 20455241.
- ^ Takahashi, Tamotsu; Kitamura, Masanori; Shen, Baojian; Nakajima, Kiyohiko (2000). „Přímočará metoda pro syntézu vysoce alkyl-substituovaných naftacenových a pentacenových derivátů homologací“. Journal of the American Chemical Society. 122 (51): 12876–12877. doi:10.1021 / ja003130g.
- ^ Takahashi, Tamotsu; Li, Shi; Huang, Wenying; Kong, Fanzhi; Nakajima, Kiyohiko; Shen, Baojian; Ohe, Takahiro; Kanno, Ken-Ichiro (2006). „Homologační metoda pro přípravu substituovaných pentacenů a naftacenů“. The Journal of Organic Chemistry. 71 (21): 7967–77. doi:10.1021 / jo060923y. PMID 17025283.
- ^ Takahashi, Tamotsu; Li, Yanzhong; Hu, Jinghan; Kong, Fanzhi; Nakajima, Kiyohiko; Zhou, Lishan; Kanno, Ken-Ichiro (2007). „Cu (I) zprostředkovaná cykloadiční reakce zirkonacyklopentadienů s fumaronitrilem a aplikace pro syntézu pentacenů substituovaných monocyklem“. Čtyřstěn dopisy. 48 (38): 6726–6730. doi:10.1016 / j.tetlet.2007.07.075.
- ^ Kámen, Matthew T .; Anderson, Harry L. (2007). „Tříkroková syntéza koncových substituovaných pentacenů“. The Journal of Organic Chemistry. 72 (25): 9776–8. doi:10.1021 / jo7017284. PMID 17999529.
- ^ Li, Shi; Li, Zhiping; Nakajima, Kiyohiko; Kanno, Ken-Ichiro; Takahashi, Tamotsu (2009). „Metoda dvojité homologace pro substituované rozpustné pentaceny a dimerizační chování pentacenů“. Chemistry: An Asian Journal. 4 (2): 294–301. doi:10.1002 / Asie.200800312. PMID 19072938.
- ^ Anthony, J. E.; Brooks, J. S .; Eaton, D. L .; Parkin, S. R. (2001). "Funkcionalizovaný pentacen: Vylepšené elektronické vlastnosti z řízení řádu v pevné fázi". Journal of the American Chemical Society. 123 (38): 9482–9483. doi:10.1021 / ja0162459. PMID 11562247.
- ^ Anthony, J. E.; Eaton, D. L .; Parkin, S. R. (2002). „Cestovní mapa stabilních, rozpustných a snadno krystalizovaných derivátů pentacenu“. Organické dopisy. 4 (1): 15–18. doi:10.1021 / ol0167356. PMID 11772079.
- ^ Norton, Joseph E .; Northrop, BH; Nuckolls, C; Houk, KN (2006). „Proč 6-methylpentacen dekonjuguje, ale vyhýbá se tepelně povolenému unimolekulárnímu mechanismu“. Organické dopisy. 8 (21): 4915–8. doi:10,1021 / ol062012g. PMID 17020335.
- ^ Briseno, Alejandro L .; Miao, Q; Ling, MM; Reese, C; Meng, H; Bao, Z; Wudl, F (2006). „Hexathiapentacene: Structure, Molecular Packing, and Thin-Film Transistors“. Journal of the American Chemical Society. 128 (49): 15576–7. doi:10.1021 / ja066088j. PMID 17147352..
- ^ Lu, červen; Ho, DM; Vogelaar, NJ; Kraml, CM; Bernhard, S; Byrne, N; Kim, LR; Pascal Jr, RA (2006). "Syntéza, struktura a rozlišení výjimečně zkroucených pentacenů". Journal of the American Chemical Society. 128 (51): 17043–50. doi:10.1021 / ja065935f. PMID 17177456.
- ^ Lehnherr, D .; Tykwinski, R.R. (2010). „Oligomery a polymery na bázi stavebních bloků pentacenu“. Materiály. 3 (4): 2772–2800. Bibcode:2010Mate .... 3.2772L. doi:10,3390 / ma3042772. PMC 5445842.
- ^ Lehnherr, D .; Tykwinski, R. R. (2011). „Konjugované oligomery a polymery na bázi stavebních bloků anthracenu, tetracenu, pentacenu, naftodithiofenu a anthradithiofenu“. Australian Journal of Chemistry. 64 (7): 919–929. doi:10.1071 / CH11169.
- ^ Tokito, S .; Weinfurtner, K.-H .; Fujikawa, H .; Tsutsui, T .; Taga, Y. (2001). Kafafi, Zakya H (ed.). "Acen obsahující polyfluoreny pro červenou, zelenou a modrou emisi v organických diodách emitujících světlo". Proc. SPIE – Int. Opt. Soc. Eng. Organické materiály a zařízení emitující světlo IV. 4105: 69–74. Bibcode:2001SPIE.4105 ... 69T. doi:10.1117/12.416877. S2CID 96976350.
- ^ Okamoto, T .; Bao, Z. (2007). „Syntéza rozpustných konjugovaných kopolymerů obsahujících pentacen“. Journal of the American Chemical Society. 129 (34): 10308–10309. doi:10.1021 / ja0725403. PMID 17685520.
- ^ Okamoto, T .; Okamoto, T .; Jiang, Y .; Qu, F .; Mayer, A.C .; Parmer, J. E.; McGehee, M.D .; Bao, Z. (2008). „Syntéza a charakterizace kopolymerů konjugovaných s pentacenem a anthradithiofenem a fluorenem syntetizovaných Suzukiho reakcemi“. Makromolekuly. 41 (19): 6977–6980. Bibcode:2008MaMol..41.6977O. doi:10.1021 / ma800931a.
- ^ A b Lehnherr, D .; Tykwinski, R. R. (2007). „Pentacene Oligomers and Polymers: Functionisation of Pentacene to Afford Mono-, Di-, Tri-, and Polymeric Materials“. Organické dopisy. 9 (22): 4583–4586. doi:10.1021 / ol702094d. PMID 17918951.
- ^ A b Lehnherr, Dan; McDonald, Robert; Ferguson, Michael J .; Tykwinski, Rik R. (2008). "Syntéza rozpustných oligo- a polymerních materiálů na bázi pentacenu". Čtyřstěn. 64 (50): 11449–11461. doi:10.1016 / j.tet.2008.09.041. ISSN 0040-4020.
- ^ Lehnherr, D .; Gao, J .; Hegmann, F. A .; Tykwinski, R. R. (2008). "Syntéza a elektronické vlastnosti konjugovaných dimerů pentacenu". Organické dopisy. 10 (21): 4779–4782. doi:10.1021 / ol801886h. PMID 18823120.
- ^ Gao, J .; Hegmann, F. A (2008). "Hromadný fotovodivý zisk v pentacenových tenkých filmech". Aplikovaná fyzikální písmena. 93 (22): 223306. Bibcode:2008ApPhL..93v3306G. doi:10.1063/1.3043431.
- ^ Lehnherr, D .; Murray, A. H .; McDonald, R .; Tykwinski, R.R. (2010). „Modulární syntetický přístup ke konjugovaným pentacenovým di-, tri- a tetramerům“. Angewandte Chemie International Edition. 49 (35): 6190–6194. doi:10,1002 / anie.201000555. PMID 20645363.
- ^ Lehnherr, D .; Gao, J .; Hegmann, F. A .; Tykwinski, R. R. (2009). „Dendrimery na bázi pentacenu: syntéza a měření fotovodivosti tenkého filmu rozvětvených pentacenových oligomerů“. Journal of Organic Chemistry. 74 (14): 5017–5024. doi:10.1021 / jo9007089. PMID 19489566.
- ^ Chen, Zhihua; Swager, TM (2007). „Syntéza a charakterizace fluorescenčních acenekvinonů jako barviv pro displeje tekutých krystalů host-hostitel“. Organické dopisy. 9 (6): 997–1000. doi:10,1021 / ol062999m. PMID 17298074.
- ^ při syntéze této sloučeniny se na výchozí materiál působí 1,4-naftochinon a DPT. DTP převádí oxo-norbornadien na zprostředkovatele furan. Druhým krokem je oxidace pomocí PPTS
- ^ Dissanayake, D. M. Nanditha M. (2007). „Velkoplošné heteropropojení pentacen-C [sub 60] fotovoltaické zařízení s nanotiskem“ (PDF). Aplikovaná fyzikální písmena. 90 (25): 253502. Bibcode:2007ApPhL..90y3502D. doi:10.1063/1.2749863.
- ^ Efektivně organické: Vědci používají pentacen k vývoji solární energie nové generace sciencedaily.com Odkaz
- ^ „Efektivně ekologické: Vědci používají Pentacen k vývoji solární energie nové generace“. ScienceDaily. Citováno 2017-11-14.
- ^ Norbert Koch (2007). "Organická elektronická zařízení a jejich funkční rozhraní". ChemPhysChem. 8 (10): 1438–55. doi:10.1002 / cphc.200700177. PMID 17539032.
- ^ A b Tatsuo Hasegawa a Jun Takeya (2009). „Tranzistory s efektem organického pole využívající monokrystaly“. Sci. Technol. Adv. Mater. 10 (2): 024314. Bibcode:2009STAdM..10b4314H. doi:10.1088/1468-6996/10/2/024314. PMC 5090444. PMID 27877287.
- ^ Yoshiro Yamashita (2009). „Organické polovodiče pro tranzistory s organickým polním efektem“. Sci. Technol. Adv. Mater. 10 (2): 024313. Bibcode:2009STAdM..10b4313Y. doi:10.1088/1468-6996/10/2/024313. PMC 5090443. PMID 27877286.
externí odkazy
- fakta o pentacenu, vyvoláno 17. dubna 2006
- Organický tranzistor se s věkem zlepšuje Nový vědec, 2. prosince 2007
- Pentacen zobrazen „IBM představuje Pentacen, první molekulu podrobně zobrazenou 29. srpna 2009




