Dynamická kovalentní chemie - Dynamic covalent chemistry
Dynamická kovalentní chemie (DCvC) je syntetická strategie používaná chemiky k výrobě komplexních supramolekulárních sestav z diskrétních molekulárních stavebních bloků.[1] DCvC umožnil přístup ke komplexním sestavám, jako jsou kovalentní organické rámce, molekulární uzly, polymery a nové makrocykly.[2] Nesmí být zaměňována s dynamickou kombinatorickou chemií, DCvC se týká pouze interakcí kovalentní vazby. Jako takový zahrnuje pouze podmnožinu supramolekulárních chemikálií.
Základní myšlenkou je, že rychlá ekvilibrace umožňuje koexistenci různých druhů, mezi nimiž lze vybrat molekuly s požadovaným chemikálie, farmaceutické a biologický vlastnosti. Například přidání vhodné šablony posune rovnováhu směrem ke složce, která tvoří komplex vyšší stability (termodynamické efekt šablony ). Po novém rovnováha je stanoveno, jsou reakční podmínky upraveny tak, aby se zastavila rovnováha. Optimální pojivo pro templát se potom extrahuje z reakční směsi obvyklým způsobem laboratoř postupy. Vlastnost samosestavování a oprav chyb, které umožňují DCvC být užitečné v supramolekulární chemii, se spoléhají na dynamickou vlastnost
Dynamické systémy
Dynamické systémy jsou soubory diskrétních molekulárních komponent, které mohou reverzibilitu sestavovat a demontovat. Systémy mohou zahrnovat více interagujících druhů vedoucích ke konkurenčním reakcím. Reverzibilita, která je vlastní
Termodynamické řízení

V dynamických reakčních směsích existuje více produktů v rovnováze. Reverzibilní sestava molekulárních komponent generuje produkty a polostabilní meziprodukty. Reakce mohou probíhat po kinetických nebo termodynamických drahách. Počáteční koncentrace kinetických meziproduktů jsou vyšší než termodynamické produkty, protože spodní aktivační bariéra (ΔG ‡) ve srovnání s termodynamickou cestou poskytuje rychlejší rychlost tvorby. Kinetická cesta je na obrázku 1 znázorněna jako fialový energetický diagram. Postupem času se meziprodukty ekvilibrují směrem k globálnímu minimu, což odpovídá nejnižší celkové volné Gibbově volné energii (ΔG °), která je na reakčním diagramu na obrázku 1 zobrazena červeně. označované jako termodynamické řízení. Poměr produktů k jakémukoli rovnovážnému stavu je určen relativními velikostmi volné energie produktů. Tento vztah mezi populací a relativními energiemi se nazývá Maxwell-Boltzmannova distribuce.
Efekt termodynamické šablony
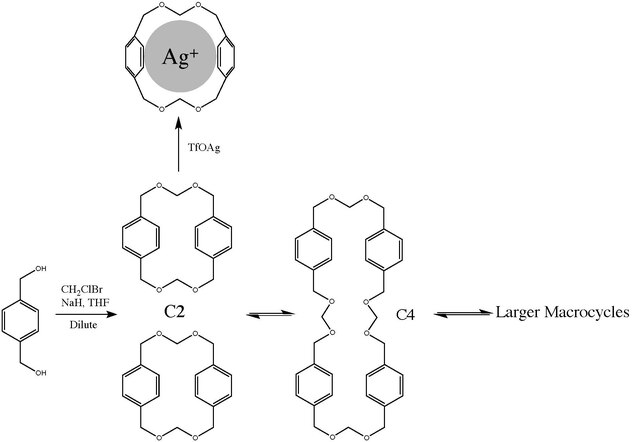
Koncept termodynamické šablony je demonstrován na schématu 1. Termodynamická šablona je činidlo, které může stabilizovat formu jednoho produktu nad ostatními snížením jeho Gibbovy volné energie (ΔG °) ve vztahu k jiným produktům. cyklofan C2 lze připravit nevratnou vysoce zředěnou reakcí diolu s chlorbrommethan v přítomnosti hydrid sodný. Dimer je však součástí řady rovnováh mezi polyacetalovými makrocykly různé velikosti, které přináší kyselinou katalyzovaný (kyselina triflová ) transacetalizace.[4] Bez ohledu na výchozí materiál, C2, C4 nebo vysoká molární hmotnost rovnováha nakonec způsobí distribuci produktu napříč mnoha makrocykly a oligomery. V tomto systému je možné zesilovat přítomnost někoho C2 ve směsi, když je transacetalizačním katalyzátorem triflát stříbra, protože stříbrný iont ideálně a nevratně zapadá do C2 dutina.
Syntetické metody
Reakce používané v DCvC musí generovat termodynamicky stabilní produkty, aby překonaly entropické náklady na vlastní montáž. Reakce musí tvořit kovalentní vazby mezi stavebními kameny. Nakonec musí být všechny možné meziprodukty reverzibilní a reakce v ideálním případě probíhá za podmínek, které jsou tolerantní k funkčním skupinám kdekoli v molekule.
Reakce, které lze použít v DCvC, jsou různé a lze je rozdělit do dvou obecných kategorií. Výměnné reakce zahrnují substituci jednoho reakčního partnera v intermolekulární reakci za jiného se stejným typem vazby. Některé příklady jsou ukázány ve schématech 5 a 8, při výměně esterů a disulfidových výměnách. Druhý typ, formační reakce, závisí na tvorbě nových kovalentních vazeb. Některé příklady zahrnují Diels-Alderovy a Aldolovy reakce. V některých případech se reakce může týkat obou kategorií. Například tvorbu Schiffovy báze lze kategorizovat jako vytváření nových kovalentních vazeb mezi karbonylovou skupinou a primárním aminem. Avšak v přítomnosti dvou různých aminů se reakce stává výměnnou reakcí, kde dva iminové deriváty soutěží v rovnováze.
Výměnné a formační reakce lze dále rozdělit do tří kategorií:
- Spojení mezi uhlíkem a uhlíkem
- Vazba mezi uhlíkem a heteroatomem
- Vazba mezi Heteroatom-Heteroatom
Tvorba vazeb C-C
Tvorba vazby mezi atomy uhlíku tvoří velmi termodynamicky stabilní produkty. Proto často vyžadují použití katalyzátoru ke zlepšení kinetiky a zajištění reverzibility.
Aldol reakce
Aldolové reakce se běžně používají v organické chemii k vytvoření vazeb uhlík-uhlík. Aldehydalkoholový motiv společný pro reakční produkt je všudypřítomný pro syntetickou chemii a přírodní produkty. Reakce využívá dvě karbonylové sloučeniny k vytvoření p-hydroxykarbonylu. Katalýza je vždy nutná, protože bariéra aktivace mezi kinetickými produkty a výchozími materiály činí dynamický reverzibilní proces příliš pomalý. Katalyzátory, které byly úspěšně použity, zahrnují enzymatickou aldolázu a systémy na bázi Al2O3.[5]

Diels-Alder
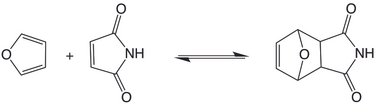
[4 + 2] cykloadice dienu a alkenu byly použity jako DCvC reakce. Tyto reakce jsou často reverzibilní při vysokých teplotách. V případě furan-maleimidových aduktů je retrocykloadice přístupná při teplotách až 40 ° C.[6]
Metateze

Metateze olefinů a alkinu označuje reakci vytvářející vazbu uhlík-uhlík. V případě metateze olefinů se vytvoří vazba mezi dvěma sp2-hybridizovanými uhlíkovými centry. Při alkinové metathezi se tvoří mezi dvěma sp-hybridizovanými uhlíkovými centry.[7] Při polymeraci a syntéze makrocyklů lze použít polymeraci polymerace s otevřením kruhu (ROMP).[1]
Uhlík-heteroatom
Běžným dynamickým kovalentním budovacím motivem je tvorba vazby mezi středem uhlíku a heteroatomem, jako je dusík nebo kyslík. Protože vazba vytvořená mezi uhlíkem a heteroatomem je méně stabilní než vazba uhlík-uhlík, nabízí větší reverzibilitu a rychlejší dosažení termodynamické rovnováhy než vazba uhlík vytvářející dynamické kovalentní reakce.
Výměna Ester

Esterová výměna probíhá mezi esterem karbonylem a alkoholem. Reverzní esterifikace může probíhat hydrolýzou. Tato metoda byla značně používána při syntéze polymerů.[8]
Iminální a aminální formace
Reakce vytvářející vazby mezi uhlíkem a dusíkem jsou nejpoužívanější v dynamické kovalentní chemii. Byly používány v širším měřítku v chemii materiálů pro molekulární spínače, kovalentní organické rámce a v samo-třídících systémech.[1]
Tvorba iminu probíhá mezi aldehydem nebo ketonem a primárním aminem. Podobně dochází k aminální tvorbě mezi aldehydem nebo ketonem a vicinálním sekundárním aminem.[8] Obě reakce se běžně používají v DCvC.[1] Zatímco obě reakce lze zpočátku kategorizovat jako formační reakce, v přítomnosti jednoho nebo více z obou činidel se z dynamické rovnováhy mezi karbonylem a aminem stává výměnná reakce.


Heteroatom-Heteroatom
Vytváření dynamické heteroatomové vazby představuje užitečné reakce v sadě nástrojů dynamické kovalentní reakce. Kondenzace kyseliny borité (BAC) a výměna disulfidů tvoří dvě hlavní reakce v této kategorii.[1]
Výměna disulfidu
Disulfidy mohou procházet dynamickými výměnnými reakcemi s volnými thioly. Reakce je dobře zdokumentována v oblasti DCvC a je jednou z prvních reakcí, u nichž se prokázalo, že mají dynamické vlastnosti.[1][9] Aplikace disulfidové chemie má další výhodu v tom, že je biologickým motivem. Zbytky cysteinu mohou v přírodních systémech vytvářet disulfidové vazby.[1]

Kyselina boritá
Vlastní kondenzace boronové kyseliny nebo kondenzace s dioly je dobře zdokumentovaná dynamická kovalentní reakce. Kondenzace kyseliny borité má tu vlastnost, že tvoří dvě dynamické vazby s různými substráty. To je výhodné při navrhování systémů, kde je požadována vysoká tuhost, jako jsou 3D klece a COF.[10]
Schéma 9: Vlastní kondenzace kyseliny borité.

Aplikace
Dynamická kovalentní chemie umožnila přístup k široké škále supramolekulárních struktur. Pomocí výše uvedených reakcí k propojení molekulárních fragmentů byly vyrobeny materiály vyššího řádu. Mezi tyto materiály patří makrocykly, COF a molekulární uzly. Aplikace těchto produktů se mimo jiné využívaly při skladování plynu, katalýze a biomedicínském snímání.[1]
Dynamické signalizační kaskády
Dynamické kovalentní reakce byly nedávno použity v Systémová chemie iniciovat signální kaskády reverzibilním uvolňováním protonů. Dynamická povaha reakcí poskytuje kaskádovým systémům vhodnou „vypínací“ povahu podobnou spínači.[11]
Makrocykly
Existuje mnoho příkladů, které demonstrují užitečnost DCvC v syntéze makrocyklů. Tento typ chemie je účinný pro syntézu velkých makrocyklů, protože termodynamický templátový efekt je vhodný ke stabilizaci kruhových struktur. Schopnost opravy chyb inherentní DCvC navíc umožňuje vytváření velkých struktur bez chyb.[12][13]
Kovalentní organické rámce
Všechny současné metody kovalentní organický rámec (COF) syntéza používá DCvC. Dehydratace kyselinou boritou, jak dokazuje Yaghi et al. je nejběžnějším typem použité reakce.[14] COF byly použity při skladování plynu, katalýze,. Možné morfologie zahrnují nekonečné kovalentní 3D rámce, 2D polymery nebo diskrétní molekulární klece.
Molekulární uzly
DCvC se používá k výrobě molekul se složitými topologickými vlastnostmi. V případě Borromejské prsteny „DCvC se používá k syntéze blokovacího systému se třemi kruhy. Termodynamické šablony se používají ke stabilizaci vzájemně provázaného růstu makrocyklů.
Viz také
- Organická chemie
- Supramolekulární chemie
- Efekt šablony
- Boronové kyseliny v supramolekulární chemii: rozpoznávání sacharidů
- Dynamická kombinatorická chemie
- Termodynamické řízení
Reference
- ^ A b C d E F G h Jin, Yinghua; Yu, Chao; Denman, Ryan J .; Zhang, Wei (2013-08-21). "Nedávný pokrok v dynamické kovalentní chemii". Recenze chemické společnosti. 42 (16): 6634–6654. doi:10.1039 / c3cs60044k. ISSN 1460-4744. PMID 23749182.
- ^ Jin, Yinghua; Wang, Qi; Taynton, Philip; Zhang, Wei (2014-05-20). „Dynamická kovalentní chemie se přibližuje k makrocyklům, molekulárním klecím a polymerům“. Účty chemického výzkumu. 47 (5): 1575–1586. doi:10.1021 / ar500037v. ISSN 0001-4842. PMID 24739018.
- ^ "Termodyamické versus kinetické řízení" od Nick024 - vlastní práce. Licencováno pod CC0 prostřednictvím Commons - https://commons.wikimedia.org/wiki/File:Thermodyamic_versus_kinetic_control.png#/media/File:Thermodyamic_versus_kinetic_control.png
- ^ Tento konkrétní typ transacetalizace se nazývá formální metateze protože to připomíná metateze olefinů ale pak s formaldehyd.
- ^ Zhang, Yan; Vongvilai, Pornrapee; Sakulsombat, Morakot; Fischer, Andreas; Ramström, Olof (2014-03-24). „Asymetrická syntéza substituovaných thiolanů prostřednictvím Domino Thia-Michael – Henry Dynamic Covalent Systemic Resolution pomocí lipázové katalýzy“. Pokročilá syntéza a katalýza. 356 (5): 987–992. doi:10.1002 / adsc.201301033. ISSN 1615-4150. PMC 4498465. PMID 26190961.
- ^ Boutelle, Robert C .; Northrop, Brian H. (10.10.2011). "Substituční účinky na reverzibilitu cykloadic furan-maleimidu". The Journal of Organic Chemistry. 76 (19): 7994–8002. doi:10.1021 / jo201606z. ISSN 1520-6904. PMID 21866976.
- ^ Vougioukalakis, Georgios C .; Grubbs, Robert H. (2010-03-10). „Heterocyklické katalyzátory metheze olefinů koordinované heterocyklickými karbeny“. Chemické recenze. 110 (3): 1746–1787. doi:10.1021 / cr9002424. ISSN 0009-2665. PMID 20000700.
- ^ A b Bozdemir, O. Altan; Barin, Gokhan; Belowich, Matthew E .; Basuray, Ashish N .; Beuerle, Florian; Stoddart, J. Fraser (26. 9. 2012). "Dynamická kovalentní templátovaná syntéza [c2] sedmikráskových řetězců". Chemická komunikace. 48 (84): 10401–10403. doi:10.1039 / C2CC35522A. PMID 22982882. Citováno 2015-11-17.
- ^ Kim, Jeehong; Baek, Kangkyun; Shetty, Dinesh; Selvapalam, Narayanan; Yun, Gyeongwon; Kim, Nam Hoon; Ko, Young Ho; Park, Kyeng Min; Hwang, Ilha (2015-02-23). „Reverzibilní morfologická transformace mezi polymerními nanokapslemi a tenkými vrstvami prostřednictvím dynamického kovalentního samosestavování“. Angewandte Chemie International Edition. 54 (9): 2693–2697. doi:10.1002 / anie.201411842. ISSN 1521-3773. PMID 25612160.
- ^ Nishiyabu, Ryuhei; Kubo, Yuji; James, Tony D .; Fossey, John S. (2011-01-28). "Stavební bloky kyseliny borité: nástroje pro vlastní montáž". Chemická komunikace (Cambridge, Anglie). 47 (4): 1124–1150. doi:10.1039 / c0cc02921a. ISSN 1364-548X. PMID 21113558.
- ^ Ren, Yulong; Ty, Lei (11.11.2015). „Dynamické signalizační kaskády: reverzibilní molekulární spínače spojené s kovalentní reakcí“. Journal of the American Chemical Society. 137 (44): 14220–14228. doi:10.1021 / jacs.5b09912. ISSN 0002-7863. PMID 26488558.
- ^ Cacciapaglia, Roberta; Di Stefano, Stefano; Mandolini, Luigi (05.10.2005). „Metatezační reakce formaldehydových acetálů: snadný vstup do dynamické kovalentní chemie tvorby cyklofanu“. Journal of the American Chemical Society. 127 (39): 13666–13671. doi:10.1021 / ja054362o. ISSN 0002-7863. PMID 16190732.
- ^ Kornienko, Nikolay; Zhao, Yingbo; Kley, Christopher S .; Zhu, Chenhui; Kim, Dohyung; Lin, Song; Chang, Christopher J .; Yaghi, Omar M .; Yang, Peidong (2015-10-28). „Kovovo-organické rámce pro elektrokatalytickou redukci oxidu uhličitého“. Journal of the American Chemical Society. 137 (44): 14129–14135. doi:10.1021 / jacs.5b08212. PMID 26509213.
- ^ Bunck, David N .; Dichtel, William R. (2012-02-20). „Interní funkcionalizace trojrozměrných kovalentních organických rámců“. Angewandte Chemie International Edition. 51 (8): 1885–1889. doi:10,1002 / anie.201108462. ISSN 1521-3773. PMID 22249947.
