Fotochemie - Photochemistry

Fotochemie je pobočkou chemie zabývající se chemickými účinky světla. Obecně se tento termín používá k popisu chemické reakce způsobené absorpcí ultrafialový (vlnová délka od 100 do 400nm ), viditelné světlo (400–750 nm) nebo infračervený záření (750–2500 nm).[1]
V přírodě má fotochemie nesmírný význam, protože je základem fotosyntézy, vidění a formování Vitamín D se slunečním světlem.[2] Fotochemické reakce probíhají jinak než reakce řízené teplotou. Fotochemické cesty přistupují k vysokoenergetickým meziproduktům, které nelze tepelně generovat, čímž v krátké době překonávají velké aktivační bariéry a umožňují reakce jinak nepřístupné tepelnými procesy. Fotochemie je také destruktivní, jak dokládá fotodegradace plastů.
Pojem
Grotthuss – Draperovo právo a Stark-Einsteinovo právo
Fotoexcitace je prvním krokem ve fotochemickém procesu, kdy je reaktant povýšen do stavu vyšší energie, an vzrušený stav. První zákon fotochemie, známý jako Grotthuss – Draperův zákon (pro chemiky Theodor Grotthuss a John W. Draper ), uvádí, že světlo musí být vstřebává chemickou látkou za účelem a fotochemická reakce se bude konat. Podle druhého zákona fotochemie, známého jako Stark-Einsteinův zákon (pro fyziky Johannes Stark a Albert Einstein ), pro každý foton světla absorbovaného chemickým systémem není aktivována více než jedna molekula pro fotochemickou reakci, jak je definováno kvantový výnos.[3][4]
Fluorescence a fosforescence
Když molekula nebo atom v základní stav (S.0) absorbuje světlo, jeden elektron je excitován na vyšší orbitální úroveň. Tento elektron udržuje roztočit podle pravidla výběru odstřeďování; jiné přechody by porušovaly zákon z zachování momentu hybnosti Buzení do vyššího stavu singletu může být od HOMO na LUMO nebo na vyšší orbitál, takže singletová excitace uvádí S1, S.2, S.3… Při různých energiích jsou možné.
Kashovo pravidlo stanoví, že vyšší stavy singletu by se rychle uvolnily radiačním rozpadem nebo interní konverze (IC) na S1. S1 je obvykle, ale ne vždy, jediný relevantní vzrušený stav singletu. Tento vzrušený stav S.1 může dále relaxovat na S.0 IC, ale také povoleným radiačním přechodem ze S1 do S.0 který emituje foton; tento proces se nazývá fluorescence.
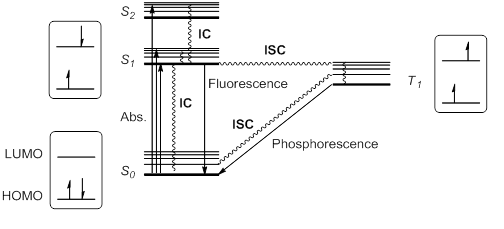
Alternativně je možné pro excitovaný stav S1 podstoupit inverzi rotace a vygenerovat tripletový excitovaný stav T1 mít dva nepárové elektrony se stejnou rotací. Toto porušení pravidla výběru rotace je možné pomocí křížení mezi systémy (ISC) vibračních a elektronických hladin S.1 a T1. Podle Hundovo pravidlo maximální multiplicity, toto t1 stát by byl o něco stabilnější než S.1.
Tento tripletový stav se může uvolnit do základního stavu S.0 IC bez záření nebo radiační cestou zvanou fosforescence. Tento proces implikuje změnu elektronického odstřeďování, která je zakázána pravidly výběru odstřeďování, čímž vzniká fosforescence (z T1 do S.0) mnohem pomalejší než fluorescence (ze S1 do S.0). Stavy tripletů tedy mají obecně delší životnost než stavy singletů. Tyto přechody jsou obvykle shrnuty ve stavovém energetickém diagramu nebo Jablonského diagram, paradigma molekulární fotochemie.
Tyto vzrušené druhy, buď S1 nebo T1, mají poloprázdný nízkoenergetický orbitál a následně oxidují více než základní stav. Současně však mají elektron na vysokoenergetické dráze, a proto se více redukují. Obecně jsou vzrušené druhy náchylné k účasti na procesech přenosu elektronů.[5]
Experimentální nastavení

Fotochemické reakce vyžadují světelný zdroj, který vyzařuje vlnové délky odpovídající elektronickému přechodu v reaktantu. V raných experimentech (a v každodenním životě) bylo zdrojem světla sluneční světlo, i když je polychromatické. Rtuťové výbojky jsou častější v laboratoři. Nízkotlaké rtuťové výbojky emitují hlavně při 254 nm. U polychromatických zdrojů lze rozsahy vlnových délek vybrat pomocí filtrů. Alternativně jsou laserové paprsky obvykle monochromatické (i když lze pomocí nelineární optiky získat dvě nebo více vlnových délek) a LED diody mají relativně úzkopásmové, které lze efektivně využít, stejně jako Rayonetovy lampy, aby získaly přibližně monochromatické paprsky.

Vyzařované světlo musí samozřejmě dosáhnout cíleného funkční skupina aniž by byl blokován přítomným reaktorem, médiem nebo jinými funkčními skupinami. Pro mnoho aplikací křemen se používá pro reaktory i pro uložení lampy. Pyrex absorbuje při vlnových délkách kratších než 275 nm. Rozpouštědlo je důležitým experimentálním parametrem. Rozpouštědla jsou potenciální reaktanty, a z tohoto důvodu se chlorovaným rozpouštědlům vyhýbáme, protože může dojít k vazbě C-Cl chlorování podkladu. Silně absorbující rozpouštědla zabraňují fotonům dosáhnout substrátu. Uhlovodíková rozpouštědla absorbují pouze při krátkých vlnových délkách, a jsou proto výhodná pro fotochemické experimenty vyžadující fotony s vysokou energií. Rozpouštědla obsahující nenasycenost absorbují při delších vlnových délkách a mohou užitečně odfiltrovat krátké vlnové délky. Například, cyklohexan a aceton „cut off“ (silně absorbovat) při vlnových délkách kratších než 215, respektive 330 nm.
Fotochemie v kombinaci s chemie toku
Kontinuální toková fotochemie nabízí oproti dávkové fotochemii několik výhod. Fotochemické reakce jsou řízeny počtem fotonů, které jsou schopné aktivovat molekuly způsobující požadovanou reakci. Poměr velké povrchové plochy k objemu mikroreaktoru maximalizuje osvětlení a současně umožňuje účinné chlazení, které snižuje vedlejší produkty tepelné.[6]
Zásady
V případě fotochemických reakcí poskytuje světlo aktivační energii. Zjednodušeně řečeno, světlo je jeden mechanismus pro poskytnutí aktivační energie potřebné pro mnoho reakcí. Pokud je použito laserové světlo, je možné selektivně excitovat molekulu tak, aby vznikl požadovaný elektronický a vibrační stav.[7] Stejně tak lze selektivně monitorovat emise z konkrétního státu, což poskytuje měřítko populace tohoto státu. Pokud je chemický systém pod nízkým tlakem, umožňuje to vědcům sledovat distribuci energie produktů chemické reakce dříve, než budou rozdíly v energii rozmazány a zprůměrovány opakovanými kolizemi.
Absorpce fotonu světla molekulou reaktantu může také umožnit, aby došlo k reakci nejen přivedením molekuly na potřebnou aktivační energii, ale také změnou symetrie elektronické konfigurace molekuly, což umožní jinak nepřístupnou reakční cestu, jak popsal Pravidla výběru Woodward – Hoffmann. Cykloadiční reakce 2 + 2 je jedním příkladem a pericyklická reakce které lze analyzovat pomocí těchto pravidel nebo související hranicí molekulární orbitální teorie.
Některé fotochemické reakce jsou o několik řádů rychlejší než tepelné reakce; reakce již za 10−9 sekund a související procesy již za 10−15 sekundy jsou často pozorovány.
Foton může být absorbován přímo reaktantem nebo a fotosenzibilizátor, který absorbuje foton a přenáší energii na reaktant. Nazývá se opačný proces kalení když je fotoexitovaný stav deaktivován chemickým činidlem.
Většina fotochemických transformací probíhá prostřednictvím řady jednoduchých kroků známých jako primární fotochemické procesy. Jedním z běžných příkladů těchto procesů je přenos protonů v excitovaném stavu.
Fotochemické reakce
Příklady fotochemických reakcí
- Fotosyntéza: použití rostlin solární energie převést oxid uhličitý a vodu do glukóza a kyslík.
- Lidská formace Vitamín D vystavením slunečnímu záření.
- Bioluminiscence: např. v světlušky, an enzym v břiše katalyzuje reakci, která vyprodukovala světlo.[8]
- Polymerizace zahájena uživatelem fotoiniciátory, které se při absorpci světla rozkládají za vzniku volných radikálů pro radikální polymerace.
- Fotodegradace mnoha látek, např. polyvinyl chlorid a Fp. Lahvičky na léky jsou často vyráběny se ztmaveným sklem, aby se zabránilo fotodegradaci léčiv.
- Fotodynamická terapie: světlo se používá k ničení nádorů působením singletového kyslíku generovaného fotocitlivými reakcemi tripletového kyslíku. Mezi typické fotosenzibilizátory patří tetrafenylporfyrin a methylenová modř. Výsledný singletový kyslík je agresivní oxidant, který je schopen převádět vazby C-H na skupiny C-OH.
- Diazo tiskový proces
- Fotorezist technologie použitá při výrobě mikroelektronické komponenty.
- Vidění je zahájena fotochemickou reakcí rhodopsin.[9]
- Toray fotochemická produkce ε-kaprolaktamu.[10]
- Fotochemická výroba artemisinin, lék proti malárii.[11][12]
- Fotoalkylace, který se používá pro světlo indukované přidání alkylových skupin k molekulám.
Organická fotochemie
Příklady fotochemických organické reakce jsou elektrocyklické reakce, radikální reakce, fotoizomerizace a Norské reakce.[13][14]
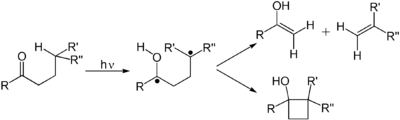
Alkenes podstoupit mnoho důležitých reakcí, které probíhají prostřednictvím fotonem indukovaného přechodu π na π *. Prvnímu elektronickému excitovanému stavu alkenu chybí n-vazba, takže rotace kolem vazby C-C je rychlá a molekula se účastní reakcí, které nejsou tepelně pozorovány. Mezi tyto reakce patří cis-trans izomerizace, cykloadice na další (základní) alken, který se získá cyklobutan deriváty. Je zahrnuta cis-trans izomerizace (poly) alkenu sítnice, součást strojního zařízení z vidění. Dimerizace alkenů je relevantní pro fotopoškození DNA, kde dimery tyminu jsou pozorovány při osvětlení DNA UV záření. Takové dimery interferují s transkripce. Příznivé účinky slunečního světla jsou spojeny s fotochemicky indukovanou retrocyklizační (decyklizační) reakcí ergosterol dát Vitamín D. V DeMayo reakce „Alken reaguje s 1,3-diketonem prostřednictvím jeho enol čímž se získá 1,5-diketon. Ještě další běžná fotochemická reakce je reakce Zimmermana Di-pi-metan přesmyk.
V průmyslové aplikaci asi 100 000 tun benzylchlorid jsou každoročně připravovány fotochemickou reakcí plynné fáze toluen s chlór.[15] Světlo je absorbováno molekulou chloru, přičemž nízká energie tohoto přechodu je indikována nažloutlou barvou plynu. Foton indukuje homolýzu vazby Cl-Cl a výsledný chlorový radikál převádí toluen na benzylový radikál:
- Cl2 + hν → 2 Cl ·
- C6H5CH3 + Cl · → C6H5CH2· + HCl
- C6H5CH2· + Cl · → C6H5CH2Cl
Merkaptany lze vyrobit fotochemickým přídavkem sirovodík (H2S) do alfa olefiny.
Anorganická a organokovová fotochemie
Koordinační komplexy a organokovové sloučeniny jsou také fotoreaktivní. Tyto reakce mohou zahrnovat cis-trans izomerizaci. Častěji fotoreakce vedou k disociaci ligandů, protože foton excituje elektron na kovu na orbitál, který je vůči ligandům antibondingový. Tím pádem, kovové karbonyly které odolávají tepelné substituci, po ozařování UV zářením podléhají dekarbonylaci. UV záření a THF řešení hexakarbonyl molybdenu dává komplex THF, který je synteticky užitečný:
- Mo (CO)6 + THF → Mo (CO)5(THF) + CO
V související reakci fotolýza pentakarbonyl železa dovoluje diiron nonacarbonyl (viz obrázek):
- 2 Fe (CO)5 → Fe2(CO)9 + CO
Vybrané fotoreaktivní koordinační komplexy mohou projít oxidačně-redukčními procesy pomocí přenosu jediného elektronu. K tomuto elektronovému přenosu může dojít v rámci vnitřní nebo vnější koordinační sféra kovu.[16]
Historický
Ačkoli se bělení praktikuje již dlouho, první fotochemickou reakci popsal Trommsdorff v roce 1834.[17] Pozoroval to krystaly sloučeniny α-santonin při vystavení slunečnímu záření zožloutlo a prasklo. Ve studii z roku 2007 byla reakce popsána jako sled tří kroků probíhajících v jediném krystalu.[18]
Prvním krokem je a přesmyková reakce do a cyklopentadienon středně pokročilí 2, druhý a dimerizace v Diels-Alderova reakce (3) a třetí an intramolekulární [2+2]cykloadice (4). Efekt prasknutí je přičítán velké změně objemu krystalů při dimerizaci.
Viz také
- Fotonická molekula
- Fotoelektrochemická buňka
- Fotochemická logická brána
- Fotosyntéza
- Reakce závislé na světle
- Seznam fotochemiků
- Zdroje jednoho fotonu
- Fotochemie
- Fotoelektrický efekt
- Fotolýza
Reference
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “fotochemie ". doi:10.1351 / zlatá kniha.P04588
- ^ Glusac, Ksenija (2016). „Co kdy světlo udělalo pro chemii?“. Přírodní chemie. 8 (8): 734–735. Bibcode:2016NatCh ... 8..734G. doi:10,1038 / nchem.2582. PMID 27442273.
- ^ Calvert, J. G .; Pitts, J. N. Fotochemie. Wiley & Sons: New York, USA, 1966. Katalogové číslo kongresu: 65-24288
- ^ Fotochemie, web William Reusch (Michigan State University), přístup 26. června 2016
- ^ Wayne, C.E .; Wayne, R. P. Fotochemie, 1. vyd .; Oxford University Press: Oxford, Velká Británie, dotisk 2005. ISBN 0-19-855886-4.
- ^ Oelgemöller, Michael; Shvydkiv, Oksana (2011). „Nedávné pokroky v mikroskopické fotochemii“. Molekuly. 16 (9): 7522–7550. doi:10,3390 / molekuly 16097522. PMC 6264405. PMID 21894087.
- ^ Menzel, Jan P .; Noble, Benjamin B .; Lauer, Andrea; Coote, Michelle L .; Blinco, James P .; Barner-Kowollik, Christopher (2017). "Závislost vlnových délek cykloadic vyvolaných světlem". Journal of the American Chemical Society. 139 (44): 15812–15820. doi:10.1021 / jacs.7b08047. hdl:1885/209117. ISSN 0002-7863. PMID 29024596.
- ^ Saunders, D. S. (11. 11. 2002). Hodiny proti hmyzu, třetí vydání. str. 179. ISBN 0444504079.
- ^ Dugave, Christophe (06.10.2006). Cis-trans izomerizace v biochemii. str.56. ISBN 9783527313044.
- ^ Protti, Stefano; Fagnoni, Maurizio (2009). "Slunečná stránka chemie: Zelená syntéza slunečním světlem". Fotochemické a fotobiologické vědy. 8 (11): 1499–516. doi:10.1039 / B909128A. PMID 19862408.
- ^ Peplow, Mark (17 dubna 2013). „Sanofi zahajuje výrobu léků na malárii“. Chemický svět.
- ^ Paddon, C. J .; Westfall, P. J .; Pitera, D. J .; Benjamin, K .; Fisher, K .; McPhee, D .; Leavell, M. D .; Tai, A .; Main, A .; Eng, D .; Polichuk, D. R. (2013). „Polosyntetická výroba silného antimalarického artemisininu na vysoké úrovni“. Příroda. 496 (7446): 528–532. doi:10.1038 / nature12051. ISSN 0028-0836. PMID 23575629.
- ^ Klán, Petr; Wirz, Jakob (2009-03-23). Fotochemie organických sloučenin: Od konceptů k praxi. ISBN 978-1405190886.
- ^ Turro, Nicholas J .; Ramamurthy, V .; Scaiano, Juan C. (2010). Moderní molekulární fotochemie organických molekul. ISBN 978-1891389252.
- ^ Rossberg, Manfred; Lendle, Wilhelm; Pfleiderer, Gerhard; Tögel, Adolf; Dreher, Eberhard-Ludwig; Langer, Ernst; Rassaerts, Heinz; Kleinschmidt, Peter; Strack, Heinz; Cook, Richard; Beck, Uwe; Lipper, Karl-August; Torkelson, Theodore R .; Löser, Eckhard; Beutel, Klaus K .; Mann, Trevor (2006). „Chlorované uhlovodíky“. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a06_233.pub2. ISBN 3527306730.
- ^ Balzani, Vincenzo; Carassiti, Vittorio (1970). Fotochemie koordinačních sloučenin. New York, New York: Academic Press, Inc. s. 37–39. ISBN 9780120772506.
- ^ Trommsdorff, Hermann (1834). „Ueber Santonin“. Annalen der Pharmacie. 11 (2): 190–207. doi:10,1002 / jlac.18340110207.
- ^ Natarajan, Arunkumar; Tsai, C. K .; Khan, Saeed I .; McCarren, Patrick; Houk, K. N .; Garcia-Garibay, Miguel A. (2007). „Photoarrangement of a-Santonin is a Single-Crystal-to-Single-Crystal Reaction: a Long Kept Secret in Solid-State Organic Chemistry Revealed“. Journal of the American Chemical Society. 129 (32): 9846–9847. doi:10.1021 / ja073189o. PMID 17645337.
Další čtení
- Bowen, E. J., Chemické aspekty světla. Oxford: Clarendon Press, 1942. 2. vydání, 1946.
- Fotochemie

