Objev a vývoj nukleosidových a nukleotidových inhibitorů reverzní transkriptázy - Discovery and development of nucleoside and nucleotide reverse-transcriptase inhibitors
Objev a vývoj nukleosid a nukleotid inhibitory reverzní transkriptázy (NRTI a NtRTI) začala v 80. letech, kdy AIDS epidemický zasáhnout západní společnosti. NRTI inhibují reverzní transkriptáza (RT), an enzym který řídí replikaci genetického materiálu viru lidské imunodeficience (HIV ). První NRTI byl zidovudin, schváleno USA Úřad pro kontrolu potravin a léčiv (FDA) v roce 1987, což byl první krok k léčbě HIV. Následovalo šest agentů NRTI a jeden NtRTI. NRTI a NtRTI jsou analogy endogenního 2´-deoxy-nukleosidu a nukleotidu. Odolný vůči drogám viry jsou nevyhnutelným důsledkem dlouhodobého vystavení HIV-1 lékům proti HIV.
Dějiny
V létě roku 1981 byl poprvé hlášen syndrom získané imunodeficience (AIDS).[1] O dva roky později etiologický v souvislosti s AIDS byl identifikován virus lidské imunodeficience (HIV).[2][3] Od identifikace HIV byl vývoj účinných antiretrovirových léků a vědecké úspěchy ve výzkumu HIV obrovské.[3][4] Antiretrovirová léčiva k léčbě infekcí HIV patří do šesti kategorií: Nukleosidové a nukleotidové inhibitory reverzní transkriptázy, Nenukleosidové inhibitory reverzní transkriptázy, inhibitory proteázy, inhibitory vstupu, inhibitory koreceptorů a inhibitory integrázy.[4] Reverzní transkriptáza HIV-1 byla hlavním základem pro vývoj léků proti HIV.[5] Prvním nukleosidovým inhibitorem reverzní transkriptázy s aktivitou anti-HIV in vitro byl zidovudin.[6] Vzhledem k tomu, že zidovudin byl schválen v roce 1987, bylo FDA schváleno šest nukleosidů a jeden nukleotidový inhibitor reverzní transkriptázy (NRTI).[6] NRTI schválené FDA jsou zidovudin, didanosin, zalcitabin, stavudin, lamivudin, abakavir a emtricitabin a jediný schválený nukleotidový inhibitor reverzní transkriptázy (NtRTI) je tenofovir (viz tabulka 4).[4][6]
Enzym reverzní transkriptázy HIV-1
Funkce

Většina standardních lékových terapií proti HIV se točí kolem inhibice enzymu reverzní transkriptázy (RT), což je enzym, který je nezbytný pro virus HIV-1 a další retroviry dokončit svůj životní cyklus.[5] Enzym RT slouží dvěma klíčovým funkcím. Nejprve prostřednictvím něj řídí replikaci genetického materiálu virů polymeráza aktivita. Převádí virovou jednovláknovou RNA do integrační kompetentní dvouvláknové DNA. Následně je generovaná DNA translokována do jádro hostitele buňka kde je integrován do svého genom retrovirovou integrázou. Druhou rolí RT je její ribonukleáza H aktivita, která degraduje RNA, pouze pokud je v a heteroduplex s DNA.[7][8]
Struktura
HIV-1 RT je asymetrický heterodimer, který je 1000 aminokyselina dlouhý a skládá se ze dvou podjednotky. Větší podjednotka, p66, je dlouhá 560 aminokyselin a vykazuje všechny enzymatické aktivity RT.[8] Menší podjednotka, zvaná p51, má délku 440 aminokyselin a je považována za stabilizující heterodimer, ale také se může podílet na vazbě tRNA primer. Podjednotka p66 má dvě aktivní místa: polymerázu a ribonukleázu H. Polymeráza má čtyři subdomény, které byly pojmenovány „prsty“, „palec“, „spojení“ a „dlaň“, protože byla srovnávána s pravou rukou.[7][8][9]
Mechanismus účinku
Aktivace nukleosidových a nukleotidových inhibitorů reverzní transkriptázy je primárně závislá na vstupu buněk do pasivní difúze nebo transport zprostředkovaný dopravcem. NRTI jsou vysoce hydrofilní a mají omezenou permeabilitu membrány, a proto je tento krok velmi důležitý. NRTI jsou analogy endogenní 2´-deoxy-nukleosid a nukleotid. Jsou neaktivní ve svých mateřských formách a vyžadují postupné fosforylace.[6]
Nukleosidy musí být trifosforylovány, zatímco nukleotidy, které obsahují jednu fosfonovanou skupinu, musí být difosforylovány.[10] Tento postupný aktivační proces probíhá uvnitř buňky a je zprostředkován koordinovanou řadou enzymů.[11] První a často omezení rychlosti, fosforylační krok (pro nukleosidové analogy) je nejčastěji katalyzován deoxynukleosidkinázami. Přidání druhé fosfátové skupiny k analogům nukleosidmonofosfátu je dokončeno nukleosidmonofosfátkinázami (NMP kinázy). Řada enzymů je schopna katalyzovat konečný krok fosforylace pro NRTI, včetně nukleosiddifosfátkinázy (NDP kináza), fosfoglycerátkináza, pyruvátkináza a kreatinkináza, což vede k tvorbě příslušných antivirově aktivních látek trifosfát analogy.[6]Ve svých příslušných trifosfátových formách soutěží NRTI a jediný dostupný NtRTI s jejich odpovídajícími endogenními deoxynukleotid trifosfáty (dNTP) o začlenění do nascentního řetězce DNA (viz obrázek 1).[6] Na rozdíl od dNTP substrátu chybí NRTI na 3´-hydroxylové skupině deoxyribóza skupina. Po začlenění do řetězce DNA nepřítomnost 3´-hydroxylové skupiny, která normálně tvoří 5´- až 3´- fosfoester pouto s dalším nukleová kyselina blokuje další prodloužení DNA pomocí RT a působí jako terminátory řetězce.[10][12]
Objev a vývoj
První krok k léčbě HIV-zidovudinu
V roce 1964 zidovudin (AZT) syntetizoval Horwitz v Michigan Cancer Foundation. 3´hydroxylová skupina v deoxyribózovém kruhu thymidinu je nahrazena an azido skupina, která nám dává zidovudin.[13] Nedostatek 3´hydroxylové skupiny, která poskytuje bod připojení dalšího nukleotidu v rostoucím řetězci DNA během reverzní transkripce, z něj činí povinného terminátoru řetězce. Ziduvodin je zabudován místo thymidinu a je extrémně účinným inhibitorem HIV replikace.[14] Tato sloučenina byla připravena v roce 1964 jako potenciál proti rakovině agent, ale ukázalo se, že je neúčinný.[15] V roce 1974 byl údajně zidovudin aktivní proti retrovirům a následně byl znovu prověřován jako antivirotikum, když během 80. let zasáhla západní společnosti epidemie AIDS.[13][15] Zidovudin je však relativně toxický protože je buněčnými enzymy přeměňován na thetrifosfát, a proto je aktivován v neinfikovaných buňkách.[14]
Další vývoj nukleosidových analogů
Dideoxynukleosidy
| Dideoxyadenosin | Didanosin | |
|---|---|---|
| Chemikálie struktura |  |  |
Dideoxynukleosidy jsou analogy nukleosidů, kde v cukrovém kruhu chybí jak 2´, tak 3´-hydroxylové skupiny.[9] Tři roky po syntéza Jerome Horwitz a jeho kolegové v Chicagu připravili další dideoxynukleosid, nyní známý jako zalcitabin (ddC).[16] Zalcitabin je syntetický pyrimidin nukleosidový analog, strukturně příbuzný deoxycytidin, ve kterém 3´-hydroxylová skupina ribóza cukerná část je substituována vodíkem.[17] Zalcitabin byl schválen FDA pro léčbu HIV-1 v červnu 1992.[3][18]
2´, 3´-dideoxyinosin nebo didanosin se in vivo převádí na dideoxyadenosin. Jeho vývoj má dlouhou historii.[19] V roce 1964 dideoxyadenosin, odpovídající adenosin byl syntetizován analog zalcitabinu. Způsobeno dideoxyadenosinem ledviny poškození, takže didanosin byl připraven z dideoxyadenosinu enzymatickou oxidací (viz tabulka 1). Bylo zjištěno, že je aktivní proti HIV bez poškození ledvin.[16] Didanosin byl schválen FDA pro léčbu HIV-1 v říjnu 1991.[18]Zalcitabin a didanosin jsou oba povinné terminátory řetězce, které byly vyvinuty pro léčbu HIV. Bohužel obě léky chybí selektivita a proto způsobit vedlejší efekty.[14]
| Zalcitabin | Lamivudin | |
|---|---|---|
| Chemikálie struktura | 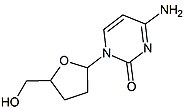 |  |
Další modifikace dideoxy rámce vedla k vývoji 2´, 3´-didehydro-3´-deoxythymidinu (stavudin, d4T). Ukázalo se, že aktivita stavudinu je podobná jako u zidovudinu, i když se jejich fosforylační vzorce liší; theafinita pro zidovudin na thymidinkináza (enzym odpovědný za první fosforylaci) je podobný enzymu z thymidin, zatímco afinita
pro stavudin je 700krát slabší.[9]
2 ', 3'-dideoxy-3'-thiacytidin (lamivudin, 3TC) byl objeven Bernard Belleau. Historie
lamivudinu lze vysledovat až do poloviny 70. let, zatímco Bernard Belleau zkoumal cukr deriváty. Lamivudin byl vyvinut jako síra analog zalcitabinu (viz tabulka 2).[16] To bylo zpočátku syntetizováno jako racemický směs (BCH-189) a analýza ukázala, že jsou pozitivní i negativní enantiomery BCH-189 (2 ', 3'-dideoxy-3'-thiacytidin) mělo aktivitu in vitro proti HIV. Lamivudin je negativní enantiomer a je analogem pyrimidinového nukleosidu. 3 'uhlík ribózového kruhu 2'-deoxycytidinu byl nahrazen atomem síry, protože měl větší anti-HIV aktivitu a je méně toxický než pozitivní enantiomer.[16][20][21]
Další v řadě byl 2 ', 3'-dideoxy-5-fluor-3'-thiacytidin (Emtricitabine, FTC), který je strukturální homolog lamivudinu. Strukturním rozdílem je 5-fluor-modifikace bazické části lamivudinu. V mnoha ohledech je podobný lamivudinu a je účinný proti HIV-1 i viru hepatitidy B (HBV ).[21][22]
Karbocyklický nukleosid
Karbocyklické analogy dideoxyadenosinu byly zkoumány na jejich anti-HIV aktivitu. Nejprve byla pozorována minimální aktivita. Bylo připraveno a zkoumáno mnoho nukleosidových analogů, ale pouze jeden měl významnou aktivitu a splňoval požadavky klinický použití. To byl 2´, 3´-didehydro analog dideoxyadenosinu. Vložení a cyklopropyl skupina na 6-amino dusík z adenin kroužek se zvýšil lipofilita a tím zlepšenou penetraci mozku. Výsledná sloučenina je známá jako abakavir (viz tabulka 3).[16] Abakavir byl schválen FDA pro použití při léčbě infekcí HIV-1 v prosinci 1998.[20]
Tento lék je jediný schválený antiretrovirový přípravek, který je aktivní jako guanosin analogický in vivo. Nejprve je monofosforylován adenosin fosfotransferázou a poté je monofosfát převeden na karbovir 3´-monofosfát. Následně je plně fosforylován a karbovir je inkorporován RT do řetězce DNA a působí jako terminátor řetězce. Karbovir je příbuzný analog guanosinu, který měl špatné orální podání biologická dostupnost a tak byl stažen z klinického vývoje.[19]
| Dideoxyadenosin | Didanosin | Abakavir | |
|---|---|---|---|
| Chemická struktura |  |  |  |
Acyklický nukleotid - jediný schválený NtRTI
Nukleotidové analogy vyžadují pouze dva kroky fosforylace, zatímco nukleosidové analogy vyžadují tři kroky. Snížení požadavku na fosforylaci může umožnit rychlejší a úplnější přeměnu léčiv na jejich aktivní metabolity. Tyto úvahy vedly k vývoji analogů fosfonátových nukleotidů, jako je tenofovir. Tenofovir disoproxil fumarát (Tenofovir DF) je proléčivo tenofoviru. Tenofovir je acyklický derivát adenosinu. Acyklická povaha sloučeniny a její fosfonátové části jsou jedinečnými strukturálními rysy mezi schválenými NRTI.[21] Tenofovir DF je hydrolyzovaný enzymaticky na tenofovir, který vykazuje anti-HIV aktivitu.[23][24] Byl vyvinut syntézou a Široké spektrum antivirová aktivita 2,3-dihydroxypropyladeninu.[24] Tenofovir DF byl prvním nukleotidovým inhibitorem reverzní transkriptázy schváleným FDA pro léčbu infekce HIV-1 v říjnu 2001.[18][23]
| Nukleotidový analog | Nukleosidové analogy | |||||||
|---|---|---|---|---|---|---|---|---|
 Purinové analogy |  Analogy pyrimidinu |  Purinové analogy | ||||||
| N u |  Adenosin |  Deoxythymidin | 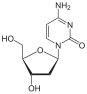 Deoxycytidin |  Adenosin | 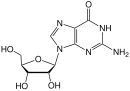 Guanosin | |||
| D r |  Tenofovir Kyselina ({[(2R) -1- (6-amino-9H-purin-9-yl) propan-2-yl] oxy} methyl) fosfonová | 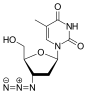 Zidovudin 3´Azido-2´, 3´-dideoxythymidin, azidothymidin (AZT) |  Stavudin 2´, 3´-didehydro-2´, 3´-dideoxythymidin (d4T) |  Emtricitabin (-) - ß-L-3´-thia-2´, 3´-dideoxy-5-fluorocytidin ((-) FTC) |  Lamivudin 2´, 3´-dideoxy-3´-thiacytidin (3TC) |  Zalcitabin 2´, 3´-dideoxycytidin (ddC) | 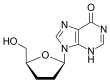 Didanosin 2´, 3´-dideoxyinosin (ddI) |  Abakavir (4- (2-amino-6- (cyklopropylamino) - 9H-purin-9yl) cyklopent-2enyl) methanol (ABC) |
proč tabulka pojídá nadpis další sekce, pokud zde není nic napsáno?
Odpor
V současné době vzhled rezistentní vůči lékům viry je nevyhnutelným důsledkem dlouhodobého vystavení HIV-1 antiretrovirové terapii. Rezistence na léky je vážným klinickým problémem při léčbě virové infekce a je obzvláště obtížným problémem při léčbě HIV.[25] Mutace rezistence jsou známy pro všechny schválené NRTI.[26]
Jsou známy dva hlavní mechanismy, které způsobují rezistenci na NRTI léčiva: Interference se začleněním NRTI a excizí začleněných NRTI.[26][27] Interference se začleněnými NRTI zahrnuje a mutace v subdoméně p66 RT.[27] Mutace způsobuje a sterická překážka které mohou vyloučit začlenění určitých léků, například lamivudinu, během reverzní transkripce. V případě excize začleněných NRTI rezistentní enzymy snadno přijímají inhibitor jako substrát pro začlenění do řetězce DNA.[27] Následně může RT enzym odstranit začleněný NRTI obrácením polymerizace krok. Excizní reakce vyžaduje donor pyrofosfátu, který se RT připojí k NRTI na 3´primerovém konci a vyřízne jej z DNA primeru.[27]K dosažení účinné inhibice replikace HIV-1 u pacientů a ke zpoždění nebo prevenci výskytu virů rezistentních na léčiva se používají lékové kombinace. HAART, také známá jako vysoce aktivní antiretrovirová terapie, sestává z kombinací antivirových léků, které zahrnují NRTI, NtRTI, nenukleosidové inhibitory reverzní transkriptázy a proteázové inhibitory.[28]
Aktuální stav
V současné době existuje několik NRTI v různých stádiích klinických a předklinické rozvoj. Hlavními důvody pro pokračování hledání nových NRTI proti HIV-1 jsou snížení toxicity, zvýšení účinnosti proti rezistentním virům a zjednodušení léčby proti HIV-1.[6][26][29]
Apricitabin (ATC)
Apricitabin je analog deoxycytidinu. Strukturálně souvisí s lamivudinem, kde jsou polohy kyslík a síra jsou v podstatě obráceny.[21] I když je apricitabin o něco méně účinný in vitro ve srovnání s některými jinými NRTI, udržuje si svoji aktivitu proti širokému spektru variant HIV-1 s mutacemi rezistence na NRTI. Apricitabin je v konečné fázi klinického vývoje pro léčbu pacientů již dříve léčených NRTI.[6]
Elvucitabin (L-d4FC)
Elvucitabin je analog deoxycytidinu s aktivitou proti HIV rezistentní na několik dalších nukleosidových analogů, včetně zidovudinu a lamivudinu.[22] To je částečně kvůli vysoké intracelulární hladiny jeho trifosfátu metabolit dosáhl v buňkách.[6] Klinické studie s elvucitabinem jsou pozastaveny, protože se ukázalo potlačení kostní dřeně u některých pacientů s CD4 + počty buněk klesají již dva dny po zahájení dávkování.[22][29]
Amdoxovir (DAPD)
Amdoxovir je proléčivo analogu guanosinu NRTI, které má dobrou biologickou dostupnost.[6][22][29] Je intracelulárně deaminován adenosindeamináza na dioxolane guanin (DXG). DXG-trifosfát, aktivní forma léčiva, má větší aktivitu než DAPD-trifosfát.[22] Amdoxovir je v současné době v klinických studiích fáze II.[24][29]
Racivir (RCV)
Racivir je racemická směs dvou β-enantiomerů emtricitabinu (FTC), (-) - FTC a (+) - FTC. Racivir má vynikající orální biologickou dostupnost a má tu výhodu, že je třeba ho užívat pouze jednou denně. Racivir lze považovat za používaný v kombinaci se dvěma NRTI a při použití v kombinaci vykazuje slibnou antivirovou aktivitu. Racivir je v současné době v klinických studiích fáze II.[6][22][29]
| Kandidát na drogu | Apricitabin | Elvucitabin | Amdoxovir | Racivir |
|---|---|---|---|---|
| Chemická struktura | 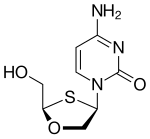 |  | 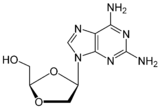 |  |
| Fáze vývoje | Konečná fáze klinického vývoje | Pozastaveno | fáze II | fáze II |
Ve vývoji je několik dalších NRTI. Buď sponzoři podali žádost o Investigational New Drug (IND) aplikace, aplikace byla schválena FDA nebo jsou léky v různých fázích klinických studií. Některé z NRTI, které jsou ve vývoji, vykazují různé atraktivní farmakologické vlastnosti, díky nimž by mohly být žádoucí pro léčbu pacientů, kteří potřebují nová činidla.[6][22][29]
Viz také
- Antiretrovirové léčivo
- Objev a vývoj antagonistů receptoru CCR5
- Objev a vývoj nenukleosidových inhibitorů reverzní transkriptázy
- Objev a vývoj inhibitorů HIV proteázy
- Inhibitor reverzní transkriptázy
- Inhibitor proteázy
- Inhibitor vstupu
- Objev a vývoj inhibitorů HIV proteázy
- Objev a vývoj antagonistů receptoru CCR5
Reference
- ^ Merson, M.D .; Michael, H. (2006), „Pandemie HIV – AIDS ve věku 25 let - globální reakce“, The New England Journal of Medicine, 354 (23): 2414–2417, doi:10.1056 / NEJMp068074, PMID 16760441, S2CID 2579436
- ^ Fausi, A.S. (1999), „Úvahy o epidemii AIDS pro 21. století“, The New England Journal of Medicine, 351 (14): 1046–1050, doi:10.1056 / NEJM199909303411406, PMID 10502595
- ^ A b C Fauci, A.S. (2003), „HIV a AIDS: 20 let vědy“, Přírodní medicína, 9 (7): 839–843, doi:10,1038 / nm0703-839, PMID 12835701, S2CID 5472960, ProQuest 223114463
- ^ A b C De-Clercq, E. (2009), „Léky proti HIV: 25 sloučenin schválených do 25 let po objevení HIV“, International Journal of Antimicrobial Agents, 33 (4): 307–320, doi:10.1016 / j.ijantimicag.2008.10.010, PMID 19108994
- ^ A b Boyer, P.L .; Coffin, J.M .; Delviks_Frankenberry, K.A .; Hughes, S.H .; Jeren, A .; Nikolenko, G.N .; Pathak, V.K. (2008), „Mutace subdomény připojení reverzní transkriptázy HIV-1 snižují degradaci templátu RNA a zvyšují excizi AZT“, Sborník Národní akademie věd Spojených států amerických, 105 (31): 10943–10948, Bibcode:2008PNAS..10510943D, doi:10.1073 / pnas.0804660105, PMC 2491488, PMID 18667707
- ^ A b C d E F G h i j k l Cihlar, T .; Ray, A.S. (2010), „Nukleosidové a nukleotidové inhibitory reverzní transkriptázy HIV: 25 let po zidovudinu“, Antivirový výzkum, 85 (1): 39–58, doi:10.1016 / j.antiviral.2009.09.014, PMID 19887088
- ^ A b Herschorn, A .; Hizi (2008), „Retrovirové reverzní transkriptázy (jiné než HIV-1 a virus myší leukémie): Porovnání jejich molekulárních a biochemických vlastností“, Virový výzkum, 134 (1–2): 203–220, doi:10.1016 / j.virusres.2007.12.008, PMID 18291546
- ^ A b C Giridhar, R .; Prajapati, D.G .; Ramajayam, R .; Yadav, M.R. (2009), „Hledání silných NNRTI s malými molekulami: recenze“, Bioorganická a léčivá chemie, 17 (16): 5744–5762, doi:10.1016 / j.bmc.2009.06.060, PMID 19632850
- ^ A b C Anderson, K.S. (2007), „Reverzní transkripce pandemie HIV-1“, FASEB Journal, 21 (14): 3795–3808, doi:10.1096 / fj.07-8697rev, PMID 17639073
- ^ A b Goldschmidt, V .; Marquet, R. (2004), „Blokování primeru reverzní transkritptázou HIV-1 a rezistence na nukleosidové inhibitory RT“, International Journal of Biochemistry & Cell Biology, 36 (9): 1687–1705, doi:10.1016 / j.biocel.2004.02.028, PMID 15183338
- ^ Kakuda, T.N. (2010), „Farmakologie nukleosidů a nukleotidů - mitochondriální toxicita vyvolaná inhibitorem reverzní transkriptázy“, Klinická terapie, 22 (6): 2717–2747, doi:10.1016 / S0149-2918 (00) 90004-3, PMID 10929917
- ^ Herschorn, A .; Hizi, A. (2010), "Retrovirové reverzní transkriptázy", Buněčné a molekulární biologické vědy, 67 (16): 2717–2747, doi:10.1007 / s00018-010-0346-2, PMID 20358252, S2CID 6954555
- ^ A b Sneader, W. (1996), Prototypy drog a jejich využití„John Wileys a synové, str. 448–450, ISBN 978-0-471-94847-6
- ^ A b C Smith, J .; William, Hywel (1998), Smith a Williams Úvod do principů navrhování a činnosti drog (3. vyd.), Harwood akademická nakladatelství, str. 247–250, 486–490, ISBN 978-90-5702-037-7
- ^ A b Saunders, J. (2000), Nejlepší léky: Nejlepší syntetické cesty, s. 71–75
- ^ A b C d E Sneader, W. (2005), Objev drog historie, str. 250–268, ISBN 978-0-471-89979-2
- ^ Georgiev, V.S. (2009), Národní ústav pro alergie a infekční choroby, NIH, 2, str. 417–426, doi:10.1007/978-1-60327-297 (neaktivní 2020-09-01), ISBN 978-1-60327-296-4CS1 maint: DOI neaktivní od září 2020 (odkaz)
- ^ A b C De-Clercq, E. (2009), „Léky proti HIV: 25 sloučenin schválených do 25 let po objevení HIV“, International Journal of Antimicrobial Agents, 33 (4): 307–320, doi:10.1016 / j.ijantimicag.2008.10.010, PMID 19108994
- ^ A b Brunton, L .; Lazo, J .; Parker, K. (2006), Goodman & Gilman's The Pharmacological Basis of Therapeutics, Eleventh Edition, McGraw-Hill, str. 1280–1292, ISBN 978-0-07-142280-2
- ^ A b Ogden, R.C .; Skowron, G. (2006), Inhibitory reverzní transkriptázy v léčbě HIV / AIDS, Humana press inc, s. 33–63, ISBN 978-1-58829-649-8
- ^ A b C d LaFemina, R.L. (2009), Antivirové výzkumné strategie při objevování antivirotik, AMS press, str. 51–70
- ^ A b C d E F G Otto, M. J. (2003), „Nové nukleosidové inhibitory reverzní transkriptázy pro léčbu infekcí HIV“, Současný názor na farmakologii, 9 (7): 839–843, doi:10.1016 / j.coph.2004.06.001, PMID 15351346
- ^ A b Fung, H. B.; Piacenti, F.J .; Stone, E.A. (2002), „Tenofovir-disoproxil-fumarát: inhibitor nukleotidové reverzní transkriptázy pro léčbu infekce HIV“, Klinická terapie, 24 (10): 1515–1548, doi:10.1016 / S0149-2918 (02) 80058-3, PMID 12462284
- ^ A b C Nguyen-Ba, N .; Rando, R.F. (2000), „Vývoj nových nukleosidových analogů pro použití proti kmenům HIV-1 rezistentním na léčiva“, Objev drog dnes, 5 (10): 465–476, doi:10.1016 / s1359-6446 (00) 01558-0, PMID 11018598
- ^ Arnold, E .; Dasa, K .; Hughesc, S.H .; Lewib, P.J. (2005), „Krystalografie a návrh léků proti AIDS: při navrhování nenukleosidových inhibitorů reverzní transkriptázy HIV-1 je důležitá konformační flexibilita a polohová přizpůsobivost“ (PDF), Pokrok v biofyzice a molekulární biologii, 88 (2): 209–231, doi:10.1016 / j.pbiomolbio.2004.07.001, PMID 15572156
- ^ A b C Delviks-Frankenberry, K.A .; Nikolenko, G.N .; Pathakar, V.K. (2010), „Spojení“ mezi HIV rezistencí na léky a RNázou H, Viry, 2 (7): 1476–1503, doi:10,3390 / v2071476, PMC 2982141, PMID 21088701
- ^ A b C d Kirby, K.A .; Marchand, B .; Michailidis, E .; Sarafianos, S.G .; Singh, K. (2010), „Strukturální aspekty lékové rezistence a inhibice reverzní transkriptázy HIV-1“, Viry, 2 (2): 606–638, doi:10,3390 / v2020606, PMC 2850067, PMID 20376302
- ^ Bowling, T.L .; Gu, Z .; L´Heureux, L .; Muys, J.M .; Nguyen-Ba, N .; Rando, R.F .; Wainberg, M.A. (1999), „Mechanism of Action and In Vitro Activity of 1 ', 3'-Dioxolanylpurine Nucleoside Analogues against Sensitive and Drug-Resistant Human Immunodeficiency Virus Type 1 Variant“, Antimikrobiální látky a chemoterapie, 43 (10): 2376–2382, doi:10.1128 / AAC.43.10.2376, PMC 89486, PMID 10508010
- ^ A b C d E F Agrawala, R. K.; Krishnan, P.N .; Raman, S .; Ravichandran, S .; Veerasamy, R. (2008), „Přehled inhibitorů reverzní transkriptázy HIV-1“ (PDF), Digest Journal of Nanomaterials and Biostructure, 3 (4): 171–187, archivovány od originál (PDF) dne 2011-07-20
