Objev a vývoj gliflozinů - Discovery and development of gliflozins - Wikipedia
Glifloziny jsou třídou léků při léčbě cukrovka typu 2 (T2D). Působí inhibicí kotransportér sodík / glukóza 2 (SGLT-2), a proto se také nazývají inhibitory SGLT-2. Účinnost léku závisí na vylučování ledvinami a brání glukóza od vstupu do krevního oběhu propagací glukosurie. Mechanismus účinku je nezávislý na inzulínu.
Tři léky byly přijaty Úřad pro kontrolu potravin a léčiv (FDA) v Spojené státy; dapagliflozin, kanagliflozin a empagliflozin. Canagliflozin byl prvním inhibitorem SGLT-2, který byl schválen FDA a byl přijat v březnu 2013. Dapagliflozin a empagliflozin byly přijaty v roce 2014.
Úvod
Úloha ledvin v homeostáze glukózy
Existují nejméně čtyři členové rodiny genů SLC-5, což jsou sekundární aktivní transportéry glukózy. Proteiny transportující glukózu sodnou SGLT-1 a SGLT-2 jsou dva přední členové rodiny. Tito dva členové se nacházejí v ledviny, mimo jiné přepravci, a jsou tam hlavními spoluvlastníky souvisejícími s krevní cukr. Hrají roli při reabsorpci glukózy v ledvinách a při absorpci glukózy ve střevě.[1][2]
Glukóza v krvi je volně filtrován pomocí glomeruli a SGLT-1 a SGLT-2 reabsorbují glukózu v ledvinách a dávají ji zpět do oběhových buněk. SGLT-2 je zodpovědný za 90% reabsorpce a SGLT-1 za dalších 10%.[1][3]
Protein SGLT-2
Kontransportér sodík / glukóza (SGLT ) proteiny jsou vázány na buněčná membrána a mají úlohu transportu glukózy přes membránu do buněk proti koncentrační gradient glukózy. To se provádí pomocí gradientu sodíku produkovaného sodíkem / draslíkem ATPáza pumpuje, takže současně se glukóza transportuje do buněk, sodík je také. Jelikož je proti gradientu, vyžaduje k práci energii. Proteiny SGLT způsobují reabsorpce glukózy z glomerulární filtrát, nezávislý na inzulín.[1][3][4]
SGLT-2 je členem rodiny glukózových transportérů a je nízkoafinitním a vysokokapacitním glukózovým transportérem. SGLT-2 je převážně exprimován v segmentech S-1 a S-2 proximálních renálních tubulů, kde je absorbována většina filtrované glukózy. SGLT-2 hraje roli v regulaci glukózy a je zodpovědný za většinu reabsorpce glukózy v ledvinách.[1][5]
U diabetu se zvyšuje extracelulární koncentrace glukózy a tato vysoká hladina glukózy vede k upregulace SGLT-2, což vede k větší absorpci glukózy v ledvinách. Tyto účinky způsobují údržbu hyperglykémie.[6] Vzhledem k tomu, že se sodík vstřebává současně s glukózou prostřednictvím SGLT-2, vede pravděpodobně regulace SGLT-2 k vývoji nebo udržování hypertenze. Ve studii, kde byly podávány buď krysy ramipril nebo losartan, hladiny SGLT-2 proteinu a mRNA byly výrazně sníženy. U pacientů s diabetem je hypertenze běžným problémem, takže to může mít u tohoto onemocnění význam.[1]
Léky, které inhibují sodík / glukózu kotransportér 2, inhibují reabsorpci glukózy v ledvinách, což vede ke zvýšenému vylučování glukózy močí a ke snížení glukózy v krvi. Pracují nezávisle na inzulínu a mohou snížit hladinu glukózy, aniž by způsobily hypoglykemii nebo přírůstek hmotnosti.[1][7]
Objev
Středověcí lékaři běžně ochutnávali moč a na svá pozorování psali projevy. Lékař, který si původně myslel[kým? ] že diabetes mellitus byl porucha ledvin kvůli glukóze nalezené v moč je zjevně ztracen v historii. Jakmile byl objeven inzulín, zaměřila se léčba diabetu na slinivka břišní. Tradičním zaměřením terapeutických strategií pro cukrovku bylo zvýšení endogenní sekrece inzulínu a zlepšení citlivost na inzulín. V předchozím desetiletí[když? ] byla zkoumána role ledvin při vývoji a udržování vysokých hladin glukózy. Role ledvin vedla k vývoji léků, které inhibují protein transportéru 2 / glukózy. Každý den se přes filtruje přibližně 180 gramů glukózy glomeruli a ztratil se do primární moči u zdravých dospělých, ale více než 90% glukózy, která byla původně filtrována, je reabsorbována vysokokapacitním systémem řízeným SGLT-2 v časném stočeném segmentu proximálních tubulů. Téměř veškerá zbývající filtrovaná glukóza je reabsorbována transportérem sodíku / glukózy 1, takže za normálních okolností bude téměř veškerá filtrovaná glukóza reabsorbována a méně než 100 mg glukóza nachází cestu do moči nediabetických jedinců.[8][9]
Phlorizin

Phlorizin je sloučenina známá již více než století. Jedná se o přirozeně se vyskytující botaniku glukosid který produkuje renální glukosurie a blokuje absorpci glukózy ve střevě prostřednictvím inhibice sodíku / glukózy sympatizanti umístěné v proximálním renálním tubulu a sliznici tenké střevo. Florizin byl poprvé izolován v roce 1835 a následně bylo zjištěno, že je silným, ale spíše neselektivním inhibitorem jak proteinů SGLT-1, tak SGLT-2.[10][11][12]
Zdálo se, že phlorizin má velmi zajímavé vlastnosti a výsledky studií na zvířatech byly povzbudivé, zlepšily citlivost na inzulín a u diabetiků krysí modely zdálo se, že zvyšuje hladinu glukózy v moči a také normální koncentrace glukózy v plazmě nastala bez hypoglykemie. Bohužel navzdory těmto vlastnostem nebyl florizin dostatečně vhodný pro klinický vývoj z několika důvodů. Florizin má velmi špatný orální obsah biologická dostupnost jak se člení v gastrointestinální trakt, takže to musí být podáváno parenterálně. Phloretin, aktivní metabolit florizinu, je silným inhibitorem usnadnění transportéry glukózy a zdá se, že florizin vede k závažným nežádoucím účinkům v gastrointestinálním traktu průjem a dehydratace. Z těchto důvodů nebyl u lidí nikdy sledován florizin.[10][12][13]
Přestože florizin nebyl vhodný pro další použití klinické testy, hrálo důležitou roli ve vývoji inhibitorů SGLT-2. Sloužil jako základ pro rozpoznání inhibitorů SGLT se zlepšenými profily bezpečnosti a snášenlivosti. Například inhibitory SGLT nejsou spojeny s gastrointestinálními nežádoucími účinky a biologická dostupnost je mnohem vyšší.[4][12][13]
Výsledkem inhibice SGLT-2 je lepší kontrola hladiny glukózy, nižší inzulín, nižší krevní tlak a kyselina močová úrovně a zvyšuje plýtvání kalorií. Některá data podporují hypotézu, že inhibice SGLT-2 může mít přímé renoprotektivní účinky. To zahrnuje akce k zeslabení tubulárních hypertrofie a hyperfiltrace spojená s diabetem a ke snížení tubulární toxicity glukózy. Inhibice SGLT-2 po léčbě dapagliflozinem snižuje kapacitu tubulární reabsorpce glukózy přibližně o 30–50%.[8]
Vývoj léků
Florizin se skládá z glukózy skupina a dva aromatické kruhy (aglykonová část) spojená s alkyl distanční vložka. Zpočátku byl florizin izolován pro léčbu horečky a zejména infekčních onemocnění malárie. Podle Michael Nauck a jeho partneři, v padesátých letech 20. století byly provedeny studie o florizinu, které ukázaly, že může blokovat transport cukru v ledvinách, tenkém střevě a několika dalších tkáních. Na počátku 90. let byl plně charakterizován kotransportér 2 sodík / glukóza, takže mechanismus florizinu se stal skutečným zajímavým. V pozdějších studiích to bylo řečeno[kým? ] že účinky florizinu blokující cukr byly způsobeny inhibicí proteinů kotransporterů sodík / glukóza.[1][4][9][11]
Většina hlášených inhibitorů SGLT-2 je glukosid analogy, které lze sledovat na o-arylglukosid vyskytující se v přírodě. Problém s používáním o-glukosidy protože inhibitory SGLT-2 je nestabilita, kterou lze sledovat až k degradaci β-glukosidáza v tenkém střevě. Z tohoto důvodu musí být o-glukosidy podávané orálně proléčivo estery. Tato proléčiva procházejí změnami v těle, které vedou k vazba uhlík-uhlík mezi glukózou a aglykon skupina tak c-glukosid jsou tvořeny z o-glukosidů. C-glukosidy mají odlišný farmakokinetický profil než o-glukosidy (např. poločas rozpadu a doba působení) a nejsou degradovány β-glukosidázou. Prvním objeveným c-glukosidem byla droga dapagliflozin.[1][14][15] Dapagliflozin byl prvním vysoce selektivním inhibitorem SGLT-2 schváleným Evropská agentura pro léčivé přípravky.[16] Všechny inhibitory SGLT-2 v klinickém vývoji jsou proléčiva které je třeba pro aktivitu převést do aktivního formuláře „A“.[9]
T-1095

Vzhledem k tomu, že Florizin je neselektivní inhibitor se špatnou perorální biologickou dostupností, byl syntetizován derivát florizinu s názvem T-1095. T-1095 je a methylkarbonát proléčivo, které se při perorálním podání vstřebává do oběhu a v játrech se rychle převádí na aktivní metabolit T-1095A.[1][9] Inhibicí SGLT-1 a SGLT-2, se u diabetických zvířat zvýšila exkrece glukózy močí. T-1095 nepokračoval v klinickém vývoji, pravděpodobně kvůli inhibici SGLT-1[1] ale neselektivní inhibitory SGLT mohou také blokovat transportér glukózy 1 (GLUT-1). Protože 90% filtrované glukózy je reabsorbováno prostřednictvím SGLT-2, zaměřil se výzkum konkrétně na SGLT-2. Inhibice SGLT-1 může také vést ke genetickému onemocnění malabsorpce glukózy a galaktózy, který se vyznačuje silným průjmem.[9][17]
ISIS 388626
Podle předběžných zjištění nové metody inhibice SGLT-2 se antisense oligonukleotid ISIS 388626 zlepšil plazmatickou glukózu u hlodavců a psů snížením mRNA exprese v proximálních renálních tubulech až o 80%, pokud se podává jednou týdně. Nemělo to vliv na SGLT-1. Výsledky studie o dlouhodobém užívání ISIS 388626 v subhumánní primáti pozorováno více než 1000násobné zvýšení v roce 2006 glukosurie bez jakékoli související hypoglykemie. Toto zvýšení glukosurie lze připsat na dávce závislému snížení exprese SGLT-2, kde nejvyšší dávka vedla k více než 75% snížení.[9] V roce 2011, Ionis Pharmaceuticals zahájil a klinická studie fáze 1 s ISIS-SGLT-2RX, 12-nukleotidovým antisense oligonukleotid.[18] Výsledky této studie byly publikovány v roce 2017 a léčba byla „spojena s neočekávanými účinky na ledviny“. Autoři dospěli k závěru, že „Než bude možné dále prozkoumat koncept antisense zprostředkovaného blokování SGLT2 s ISIS 388626, jsou zapotřebí další preklinická data, která by odůvodnila další vyšetřování.“ [19]
Aktivita inhibitorů SGLT-2 při kontrole glykemie
Michael Nauck to líčí metaanalýzy studií o aktivitě inhibitorů SGLT-2 při kontrole glykemie u pacientů s diabetes mellitus typu 2 ukazuje zlepšení kontroly glukózy ve srovnání s placebo, metformin, sulfonylmočovina, thiazolidindiony, inzulín a další. The HbA1c byl vyšetřen poté, co byly inhibitory SGLT-2 podány samostatně (jako monoterapie) a jako přídavná léčba k dalším lékům na diabetes. Použitými inhibitory SGLT-2 byly dapagliflozin a kanagliflozin a další ve stejné třídě léčiv. Metaanalýza byla převzata ze studií od období několika týdnů do více než 100 týdnů.[4]
Shrnuté výsledky byly takové, že 10 mg dapagliflozinu vykazovalo větší účinek než placebo při kontrole glukózy, pokud se podávalo po dobu 24 týdnů. Nebyla však prokázána nižší účinnost 10 mg dapagliflozinu při použití jako přídavná léčba k metforminu ve srovnání s glipizid po použití po dobu 52 týdnů. 10 mg dapagliflozinu nevykázalo ve srovnání s metforminem žádnou horší účinnost, pokud byly oba léky podávány jako monoterapie po dobu 24 týdnů.[4]
Výsledky metaanalýzy při zkoumání kanagliflozinu ukázaly, že ve srovnání s placebem ovlivňuje kanagliflozin HbA1c. Studie metaanalýzy také ukázaly, že 10 mg a 25 mg empagliflozinu zlepšily HbA1c ve srovnání s placebem.[4]
Vztah struktura-aktivita (SAR)
The aglykony phlorizinu i dapagliflozinu mají slabé inhibiční účinky na SGLT-1 a SGLT-2. Dva synergický síly se podílejí na vazbě inhibitorů na SGLT. Různé cukry na aglykonu ovlivní a změní jeho orientaci v přístupovém vestibulu, protože jednou ze sil zapojených do vazby je vazba cukru na místo glukózy. Druhou silou je vazba aglykonu, která ovlivňuje vazebnou afinitu celého inhibitoru.[14]
Objev T-1095 vedl k vyšetřování[když? ] jak zvýšit účinnost, selektivitu a orální biologickou dostupnost přidáním různých substituentů do glykosidového jádra. Jako příklad můžeme vzít změnu o-glykosidů na c-glykosidy vytvořením vazby uhlík-uhlík mezi glukózou a aglykonovou částí. C-glukosidy jsou stabilnější než o-glukosidy, což vede ke změněnému poločasu rozpadu a době působení. Tyto modifikace také vedly k větší specifičnosti pro SGLT-2.[9] C-glukosidy, které mají heterocyklický kroužek na distálním kroužku nebo proximální kroužek jsou lepší, pokud jde o antidiabetický účinek a fyzikálně-chemické všechny funkce dohromady.[3][20] C-glukosidové ložisko thiazol na distálním kruhu na kanagliflozinu prokázal dobré fyzikálně-chemické vlastnosti, které mohou vést ke klinickému vývoji, ale stále má stejnou antidiabetickou aktivitu jako dapagliflozin, jak je uvedeno v tabulkách 1 a 2.
Song a jeho partneři připravili thiazolovou sloučeninu počínaje karboxylovou kyselinou. Při práci s nimi trvalo tři kroky, než dostali sloučeninu jako dapagliflozin s thiazolovým kruhem. Inhibiční účinky sloučenin na SGLT-2 byly testovány Songem a jeho partnery. V tabulkách 1, 2 a 3 IC50 hodnota se mění v závislosti na tom, jaká sloučenina je v poloze kruhu, v oblasti C-4 proximálního fenylového kruhu a jak souvisí thiazolový kruh.[3]
Mnoho sloučenin poskytlo různé IC50 hodnota v poloze vyzvánění v an in vitro aktivita. Například tam byl velký rozdíl, kdyby existovala n-pentylová skupina (IC50 = 13,3 nM), n-butyl (IC50 = 119 nM), fenyl s 2-furylem (IC50 = 0,720) nebo 3-thiofenyl (IC50 = 0,772). Jak je vidět z tabulky 1, in vitro aktivita se zvyšuje v závislosti na tom, jaká sloučenina je navázána na distální kruh (vzhledem k tomu, že v oblasti C-4 proximálního fenylového kruhu je atom Cl).[3]
Stůl 1: Rozdíly v in vitro aktivita v závislosti na tom, která sloučenina je vázána k distálnímu kruhu.
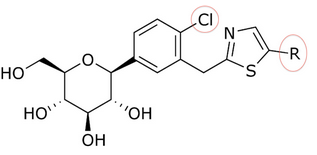
| R | IC50 (nM)[3] | Aktivita[3] |
|---|---|---|
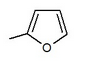 | 0.720 | in vitro aktivita vylepšena * |
 | 1.14 | in vitro aktivita vylepšena * |
| 13.3 | Jak se zvyšuje počet uhlíků, hodnota IC-50 kolísá | |
| 19.6 | in vitro aktivita snížena * | |
 | 21.2 | in vitro aktivita snížena * |
* komparátor s ethylovou skupinou (IC50 = 16,7)
V tabulce 2 je in vitro aktivita se mění v závislosti na sloučenině v C-4 oblasti proximálního fenylového kruhu (X). Malé methylové skupiny nebo jiné atomy halogenu v poloze C-4 poskytly IC50 v rozmezí od 0,72 do 36,7 (vzhledem k tomu, že fenyl s 2-furylem je v poloze kruhu).[3]
Tabulka 2: Rozdíly v in vitro aktivita v závislosti na tom, jaká sloučenina je v C-4 oblasti proximálního fenylového kruhu.

| X[3] | IC50 (nM)[3] |
|---|---|
| Cl | 0.720 |
| Mě | 1.43 |
| F | 6.11 |
| H | 22.6 |
| CN | 36.7 |
Tabulka 3: Rozdíl v IC50 hodnota v závislosti na tom, jak souvisí thiazolový kruh (nic jiného se ve struktuře nezmění (X = Cl, R = fenyl s 2-furylem).
| Sloučenina | IC50 (nM)[3] |
|---|---|
 | 0.720 |
 | 1.11 |
Viz také
- Transportní proteiny sodík-glukóza
- SLC5A2
- SGLT1
- SGLT2
- Dapagliflozin
- Empagliflozin
- Kanagliflozin
- Ipragliflozin
Reference
- ^ A b C d E F G h i j Nair, S .; Wilding, J.P.H. (2010). „Inhibitory sodné glukózy Cotransporter 2 jako nová léčba cukrovky“. Journal of Clinical Endocrinology & Metabolism. 95 (1): 34–42. doi:10.1210 / jc.2009-0473. PMID 19892839.
- ^ Wright, E.M .; Hirayama, B.A .; Loo, D.F. (2007). "Aktivní transport cukru ve zdraví a nemoci". Journal of Internal Medicine. 261 (1): 32–43. doi:10.1111 / j.1365-2796.2006.01746.x. PMID 17222166.
- ^ A b C d E F G h i j k Song, Kwang-Seop; Lee, Suk Ho; Kim, Min Ju; Seo, Hee Jeong; Lee, Junwon; Lee, Sung-Han; Jung, Myung Eun; Syn, Eun-Jung; Lee, MinWoo; Kim, Jeongmin; Lee, Jinhwa (10. února 2011). "Syntéza a SAR thiazolylmethylfenylglukosidu jako nových inhibitorů arylglukosidu SGLT2". Dopisy ACS pro léčivou chemii. 2 (2): 182–187. doi:10.1021 / Ml100256c. PMC 4018110. PMID 24900297.
- ^ A b C d E F Nauck, Michael (2014). „Aktualizace vývoje s inhibitory SGLT2 v léčbě diabetu 2. typu“. Návrh, vývoj a terapie léčiv. 8: 1335–1380. doi:10.2147 / DDDT.S50773. PMC 4166348. PMID 25246775.
- ^ Kasichayanula, Sreeneeranj; Liu, Xiaoni; Pe Benito, Melanie; Jao Ming; Pfister, Marc; LaCreta, Frank P .; Humphreys, William Griffith; Boulton, David W. (2013). „Vliv funkce ledvin na expozici, metabolismus a farmakodynamiku dapagliflozinu u zdravých subjektů a u pacientů s diabetes mellitus 2. typu“. British Journal of Clinical Pharmacology. 76 (3): 432–444. doi:10.1111 / bcp.12056. PMC 3769670. PMID 23210765.
- ^ Mediavilla Bravo, J.J. (Červenec 2014). „Aportaciones de los SGLT-2 y nuevos fármacos en investigación“. SEMERGEN - Medicina de Familia. 40: 34–40. doi:10.1016 / S1138-3593 (14) 74388-6.
- ^ Whaley, Jean; Tirmenstein; Reilly; Poucher; Saye; Parikh; Seznam (2012). „Cílení na vylučování ledvin a glukózy dapagliflozinem: preklinické a klinické důkazy o inhibici SGLT2 jako nová možnost léčby diabetes mellitus 2. typu“. Cukrovka, metabolický syndrom a obezita: Cíle a terapie. 5: 135–48. doi:10,2147 / DMSO.S22503. PMC 3422910. PMID 22923998.
- ^ A b Thomas, M. C. (24. července 2014). „Účinky dapagliflozinu na ledviny u pacientů s diabetem 2. typu“. Terapeutické pokroky v endokrinologii a metabolismu. 5 (3): 53–61. doi:10.1177/2042018814544153. PMC 4132377. PMID 25126408.
- ^ A b C d E F G Idris, Iskandar; Donnelly, Richard (2009). „Inhibitory sodík-glukóza co-transportér-2: objevující se nová třída perorálních antidiabetik“. Cukrovka, obezita a metabolismus. 11 (2): 79–88. doi:10.1111 / j.1463-1326.2008.00982.x. PMID 19125776.
- ^ A b Ehrenkranz, Joel R. L .; Lewis, Norman G .; Ronald Kahn, C .; Roth, Jesse (2005). "Florizin: recenze". Výzkum a recenze týkající se cukrovky / metabolismu. 21 (1): 31–38. doi:10,1002 / dmrr.532. PMID 15624123.
- ^ A b Chao, Edward C .; Henry, Robert R. (28. května 2010). „Inhibice SGLT2 - nová strategie pro léčbu cukrovky“. Recenze přírody Objev drog. 9 (7): 551–559. doi:10.1038 / nrd3180. PMID 20508640.
- ^ A b C McGill, Janet B. (12. dubna 2014). „Inhibitor SGLT2 empagliflozin pro léčbu diabetes mellitus 2. typu: Bench to Bedside Review“. Terapie diabetu. 5 (1): 43–63. doi:10.1007 / s13300-014-0063-1. PMC 4065283. PMID 24729157.
- ^ A b Bhartia, Mithun; Tahrani, Abd A .; Barnett, Anthony H. (2011). „Inhibitory SGLT-2 ve vývoji léčby diabetu 2. typu“. Recenze diabetických studií. 8 (3): 348–354. doi:10.1900 / RDS.2011.8.348. PMC 3280669. PMID 22262072.
- ^ A b Hummel, C. S .; Lu, C .; Liu, J .; Ghezzi, C .; Hirayama, B. A .; Loo, D. D. F .; Kepe, V .; Barrio, J. R .; Wright, E. M. (21. září 2011). "Strukturální selektivita lidských inhibitorů SGLT". AJP: Buněčná fyziologie. 302 (2): C373 – C382. doi:10.1152 / ajpcell.00328.2011. PMC 3328840. PMID 21940664.
- ^ Li, An-Rong; Zhang, Jian; Greenberg, Joanne; Lee, TaeWeon; Liu, Jiwen (2011). "Objev ne-glukosidových inhibitorů SGLT2". Dopisy o bioorganické a léčivé chemii. 21 (8): 2472–2475. doi:10.1016 / j.bmcl.2011.02.056. PMID 21398124.
- ^ Cuypers, J; Mathieu, C; Benhalima, K (2013). „Inhibitory SGLT2: nová třída pro léčbu diabetu typu 2, zavedení inhibitorů SGLT-2 v klinické praxi“. Acta Clinica Belgica. 68 (4): 287–93. doi:10,2143 / acb.3349. PMID 24455799.
- ^ Lv, Binhua; Xu, Baihua; Feng, Yan; Peng, Kun; Xu, Ge; Du, Jiyan; Zhang, Lili; Zhang, Wenbin; Zhang, Ting; Zhu, Liangcheng; Ding, Haifeng; Sheng, Zelin; Welihinda, Ajith; Semeno, Brian; Chen, Yuanwei (prosinec 2009). „Průzkum O-spiroketal C-arylglukosidů jako nových a selektivních inhibitorů renálního sodíku závislého glukózového kotransportéru 2 (SGLT2)“. Dopisy o bioorganické a léčivé chemii. 19 (24): 6877–6881. doi:10.1016 / j.bmcl.2009.10.088. PMID 19896374.
- ^ „Isis zahajuje klinickou studii fáze 1 s antisense drogou SGLT2“.
- ^ van Meer L, van Dongen M, Moerland M, de Kam M, Cohen A, Burggraaf J (únor 2017). „Nový inhibitor SGLT2: první studie antisense sloučeniny u člověka jsou spojeny s neočekávanými účinky na ledviny“. Pharmacol Res Perspect. 5 (1): e00292. doi:10.1002 / prp2.292. PMC 5461644. PMID 28596840.
- ^ Park, Eun-Jung; Kong, Younggyu; Lee, Jun Sung; Lee, Sung-Han; Lee, Jinhwa (leden 2011). "Průzkum SAR týkající se glukózové skupiny v nových C-arylglukosidových inhibitorech SGLT2". Dopisy o bioorganické a léčivé chemii. 21 (2): 742–746. doi:10.1016 / J.Bmcl.2010.11.115. PMID 21193308.
