Objev a vývoj cefalosporinů - Discovery and development of cephalosporins - Wikipedia
Cefalosporiny jsou širokou třídou baktericidní antibiotika které zahrnují β-laktamový kruh a sdílejí strukturální podobnost a mechanismus účinku s jinými β-laktamovými antibiotiky (např. peniciliny, karbapenemy a monobaktamy ).[1] Cefalosporiny (a další β-laktamy) mají schopnost zabíjet bakterie tím, že inhibují základní kroky syntézy bakteriální buněčné stěny, což nakonec vede k osmotickým lýza a smrt bakteriální buňky.[2] Cefalosporiny jsou široce používaná antibiotika kvůli jejich klinické účinnosti a požadovanému bezpečnostnímu profilu.[3]
Cefalosporiny mají různé antibakteriální vlastnosti spektrum, voda rozpustnost, snášenlivost s kyselinami, orální biologická dostupnost, biologický poločas a další vlastnosti. Proto lze cefalosporiny dále klasifikovat do generací podle toho antibakteriální aktivita, doba vynálezu a strukturální základ.
Základní struktura cefalosporinů

Jádro základní molekuly cefalosporinu sestává ze dvou kruhového systému, který zahrnuje β-laktamový kruh kondenzovaný s dihydrothiazinovým kruhem. Samotné jádro lze také označit jako Kyselina 7-aminocefalosporanová které lze odvodit pomocí hydrolýza z přírodní sloučeniny cefalosporin C.. Chemické sloučeniny obsahující toto jádro jsou relativně stabilní vůči kyselé hydrolýze a toleranci vůči β-laktamázy. Cefalosporin C obsahuje postranní řetězec, který je odvozen od kyseliny D-aminoadipové. Úpravy boční řetězy na příslušných pozicích byla použita k vytvoření zcela nové třídy cefalosporinových antibiotik. Zdá se, že úprava postranních řetězců v poloze 7 laktamového kruhu ovlivňuje antibakteriální aktivitu, zatímco poloha 3 dihydrothiazinového kruhu se mění farmakokinetické vlastnosti a vazebná afinita k receptoru.[4][5]
Objev
První chemické sloučeniny ze skupiny cefalosporinů byly izolovány z Cephalosporium acremonium, houba produkující cefalosporiny poprvé objevená Giuseppe Brotzu v roce 1948 z odtoku splašků z Sardinský pobřeží.[1] Ze surových filtrátů z Cephalosporium acremonium vědci v oblasti kultury získali novou antibakteriální aktivitu. Bylo zjištěno, že surový filtrát může inhibovat růst Zlatý stafylokok.[3]
Vyšetřování

b) 7-ADCA
Další vyšetřování Sir Edward Abraham a Guy Newton byly vyrobeny v Anglie a izolace kultivačních tekutin ze sardinské houby poskytla cefalosporin P, N a C. Nebylo zjištěno, že by tyto přírodní sloučeniny byly silný dost k použití jako antimikrobiální látky, ale chemickými metodami a odstraněním přirozeného postranního řetězce bylo možné vyrobit kyselinu 7-aminocefalosporanovou (7-ACA ), které by mohly být dále přizpůsobeny nepřirozeným bočním řetězům. 7-ACA je analogický s kyselinou 6-aminopenicilanovou (6-APA ), výchozí blok pro výrobu několika derivátů penicilinů.[1]
V roce 1959 Abraham uvedl, že jeho N-fenylacetylový derivát cefalosporinu C byl mnohem účinnější proti Zlatý stafylokok kmeny než původní sloučenina. Tento derivát byl později pojmenován Cephaloram, analog cefalosporinu benzylpenicilin.
Eli Lilly vyvinul způsob výroby 7-ACA založený na štěpení postranního řetězce a-aminoadipoyl cefalosporinu C.[6] Další práce Roberta Morina vedla k polosyntéza 3-deacetoxy-7-ACA (7-ADCA) z penicilinů, což je výhodné, protože peniciliny mohou být fermentovaný snadněji než cefalosporiny. Například 7-ADCA lze polosyntetizovat v sedmi krocích chemické reakce od fenoxymethylpenicilin.[1]
Výsledek
Cefalothin, první generace cefalosporinu pro parenterální použití bylo prvním cefalosporinem, který byl k dispozici pacientům v EU NÁS v roce 1964. To bylo vybráno pro klinické studie ze série 7-ACA derivátů připravených v Eli Lilly.[7] Druhý cefalosporin pro parenterální použití byl k dispozici o něco později a byl uveden na trh v USA pod tímto názvem Cefaloridin. Klinické úspěchy těchto dvou cefalosporinů vyzvaly vědce ke zlepšení farmakologických vlastností a vývoji více látek.[8][9] Dnes nám zbývají tisíce polosyntetizovaných analogů přírodních cefalosporinových sloučenin na základě znalostí získaných intenzivním výzkumem chemie těchto dvou výchozích materiálů.[1]
Mechanismus účinku

Baktericidní účinky β-laktamových antibiotik jsou dosaženy inhibicí syntézy bakteriální buněčné stěny. The buněčná stěna oba grampozitivní a gramnegativní bakterie je těsná kovalentně vázán a zesítěný peptidoglykan síť a zásadní pro bakteriální růst, buněčné dělení a buněčná struktura. Proto bakterie potřebují enzymy které mohou štěpit buněčnou stěnu během růstu bakterií a dělení buněk. Buněčná stěna bakterií je vytvořena ve dvou krocích z vnějšku buňky. V prvním kroku molekuly disacharid jednotky spojené s peptidy na svých koncích jsou přepravovány z cytoplazma bakterií a spojeny dohromady na vnější straně stěny pomocí a transglykoláza. Ve druhém kroku, a transpeptidáza spojuje dohromady dlouho polysacharid řetězy, které jsou navzájem spojeny peptidové vazby. The aminokyselina sekvence D-alanyl-D-alaninu je rozpoznána transpeptidázou na konci peptidového řetězce. Enzym se odštěpuje alanin na terminálním konci a připojí zbytek k peptidovému řetězci ze sousedního polysacharidu.[10] Tato transpeptidační reakce je inhibována beta-laktamovými antibiotiky, jako jsou cefalosporiny. Díky této inhibici jsou antibiotika nejúčinnější, když jsou bakterie v logaritmické fázi růstu, kdy syntetizují buněčnou stěnu. Pokud jsou bakterie ve stacionární fázi růstu, neprobíhá syntéza žádné stěny a antibiotika mají mnohem menší účinek.[3]
Ačkoli mechanismus účinku pro β-laktamová antibiotika není zcela znám, předpokládá se, že uplatňují svůj mechanismus účinku napodobováním struktury přechodného stavu chemické reakce, když je transpeptidáza vázána na sekvenci D-alanyl-D-alaninu. .[10] Tyto proteiny jsou často označovány jako proteiny vázající penicilin (PBP). Otevření β-laktamového kruhu serinovým zbytkem ve vazebném místě pro enzym vede k kovalentní vazbě antibiotika molekula s aktivním místem enzymu. Výsledkem je neaktivní nevratně vázaný komplex enzymů, který není schopen další syntézy buněčné stěny a buňka zemře na osmotickou lýzu.[2][10][11]
Návrh léku
Vztah aktivity a struktury

Molekulární strukturu cefalosporinu lze za účelem zlepšení změnit různými způsoby in vitro stabilita, antibakteriální aktivita a rezistence vůči β-laktamázám. V kyselých podmínkách žaludku in vitro stabilita může být zvýšena přidáním amino a a vodík do poloh α1 a α2 cefalosporinové struktury. Výsledkem je základní sloučenina, an amonný ion to je protonoval za těchto podmínek nám poskytuje stabilnější β-laktam, který vede k perorálně aktivnímu léčivu. Antibakteriální aktivita může být zvýšena, pokud je A2 alkoxyskupina místo vodíku. 7-aminoskupina je zásadní pro antibakteriální aktivitu. V některých případech přidání a methoxyskupina v poloze A2 se stabilita cefalosporinu zvyšuje směrem k β-laktamázám. v poloze A1 síra a kyslík lze umístit do kruhu. Síra vykazuje lepší antibakteriální aktivitu, ale kyslík vykazuje lepší stabilitu vůči β-laktamázám. V poloze C6 je pro biologickou aktivitu zásadní vodík. V poloze A3 je antibakteriální aktivita větší, když A3 je 5členný heterocyklus místo šestičlenného. V poloze α1 a α2 je L-izomer je 30–40krát stabilnější vůči β-laktamáze než D-izomer. Stabilitu vůči β-laktamáze lze zvýšit přibližně stokrát přidáním methoxyoxim. Z-oxim je téměř 20 000krát stabilnější než E-oxim.[1]
Závazný web
Pokroky v oblasti rekombinantní proteinové inženýrství a výraz, čištění bílkovin, NMR, Rentgenová krystalografie a výpočetní chemie zlepšili dovednosti konstruktérů léků používat údaje shromážděné o trojrozměrných strukturách léku proteinový ligand komplexy.[12]
Většina bakteriálních druhů má různé typy PBP, které se liší různými způsoby, jako je enzymatická funkce, molekulární váha a afinita pro β-laktamová antibiotika. Existují dva typy enzymů, které jsou obzvláště zajímavé, pokud jde o vazebné místo β-laktamů, PBP a β-laktamázy. Cílové změny ve vazebném místě PBP vedly k vysoké úrovni rezistence β-laktamů u podobných bakterií stafylokoky, enterokoky a pneumokoky.[13]Například vazebné místo PBP2 v Neisseria gonorrhoeae byl strukturálně určen a má tři sekvence motivy které lze vidět téměř ve všech enzymech interagujících s β-laktamem.
- Motiv SXXK umístěný na N-terminálním konci α2 šroubovice a zahrnuje dva zbytky, které jsou důležité pro funkci enzymu.
- Motiv SXN, který zahrnuje Ser-362, Ser-363 a Asn-364
- Motiv KTG, který zahrnuje Lys-497, Thr-498 a Gly-499
Výzkum také naznačuje, že přilehlé oblasti k aktivnímu místu, které se liší mezi různými PBP, mají významný vliv na rychlost rychlosti acylace β-laktamu.[14]
Antimikrobiální rezistence
Bakteriální rezistence ke sloučeninám cefalosporinu může docházet třemi mechanismy.
- Úpravy v cílovém PBP
- Inaktivace léčiva bakteriálními β-laktamázami
- Lék není schopen dosáhnout cílového PBP v bakteriální buňce
Cefalosporiny musí projít bakteriální buněčnou stěnou, aby dosáhly cílového PBP. Pro srovnání je snazší proniknout do buněčné stěny grampozitivních bakterií než do buněčné stěny gramnegativních bakterií. Struktura buněčné stěny grampozitivních bakterií je běžně vytvářena peptidoglykanem, který umožňuje průchod molekul o velikosti cefalosporinu. Struktura buněčné stěny gramnegativních bakterií je složitější, skládá se z polysacharidů, lipidů a bílkovin a je těžší proniknout. Částice procházejí vnější membránou kanály naplněnými vodou, nebo poriny, což jsou transmembránové proteiny.[15]Během expozice cefalosporinům mohou bakterie vytvářet rezistenci samy nebo jako výběr další generace bakterií poté, co se samy rozmnožují, mutace.[16]Druhy bakterií jako např pneumokoky a meningokoky může získat exogenní genetický materiál, a začlenit ji do své vlastní chromozomy což vede k antimikrobiální rezistenci.[17]Tímto způsobem lze změnit cílové PBP tak, aby se snížila jejich přitažlivost pro cefalosporiny a jiná β-laktamová antibiotika.[18][19] Bakterie mohou také nahradit PBP, který je citlivý na beta-laktamová antibiotika, za PBP, který je méně citlivý.[20]β-laktamová antibiotika mohou být inaktivována mnoha typy β-laktamázy, které jsou produkovány bakteriemi. Enzymy hydrolyzují vazbu mezi uhlík a dusík atom β-laktamového kruhu. Existuje mnoho beta laktamáz, které se liší specificitou substrátu a rozsahem hostitele.[21][22] Aktivní místo enzymů se snadno hydrolyticky regeneruje, takže je mnohokrát znovu použitelné, čímž může poměrně malé množství beta-laktamáz zničit velké množství léčiva. Grampozitivní bakterie, jako jsou stafylokoky, mají vysoké uvolňování beta-laktamáz do svého extracelulárního prostoru, kde se setkávají s léčivem mimo buněčnou stěnu. Gramnegativní bakterie na druhé straně sledují konzervativnější průběh. Vylučují své beta-laktamázy do periplazmatický prostor mezi vnitřní a vnější membránou, takže nemohou snadno uniknout do extracelulárního prostoru a nemusí být biosyntetizovány ve velkém množství.[1]
Vývoj léků
Tato část přezkoumá vývoj léků z jedné generace na druhou s důrazem na strukturální rozdíly mezi generacemi. Systém klasifikace generací se opírá o dělení cefalosporinů jejich chemickými vlastnostmi a relativní aktivitou proti gramnegativním versus grampozitivním bakteriím.[5][14]Od první generace cefalosporinů po třetí generaci dochází k vývoji od účinnějšího proti grampozitivním bakteriím k účinnějšímu proti gramnegativním bakteriím a méně účinnému proti grampozitivním bakteriím. Ve čtvrté generaci se však aktivita vrací k vyvážené účinnosti proti gramnegativním a grampozitivním bakteriím.[23]
Klasifikace cefalosporinů
Třída cefalosporinů je velmi rozsáhlá, takže k rozlišení různých cefalosporinů od sebe navzájem je nezbytný dobrý klasifikační systém. Existuje několik chemických a aktivních znaků, které lze použít pro klasifikaci, například chemická struktura, vlastnosti postranního řetězce, farmakokinetika, spektrum aktivity nebo klinický vlastnosti. Přes tyto proměnné vlastnosti je nejběžnějším klasifikačním systémem pro cefalosporiny jejich rozdělení na generace. Generační systém je založen na odlišné antimikrobiální aktivitě, kterou vykazují různé cefalosporiny.[3][4][24]
Cefalosporiny 1. generace

Cefalosporiny první generace byly prvními cefalosporiny na trhu. Mají dobrou antimikrobiální aktivitu proti grampozitivním bakteriím, ale omezenou aktivitu proti gramnegativním druhům.[25] Chemické struktury cefalosporinů první generace jsou poměrně jednoduché. Jako příklad tři léky z této třídy (Cefalexin, Cephradin a Cefadroxil ) všechny mají jednu methylovou skupinu v poloze C-3. Společné postranní skupiny na C-3 pro cefalosporiny první třídy jsou malé nenabité skupiny, jako je methyl.[5] The methylová skupina v poloze C-3 poskytuje nízkou afinitu k běžným PBP, což může částečně vysvětlit relativně nízkou aktivitu těchto prvních léků. Cefaclor má však a Cl skupina v poloze C-3, která jí dává lepší vazbu na PBP a tím lepší antimikrobiální aktivitu. Neexistuje dohoda o klasifikaci Cefacloru jako cefalosporinu první generace kvůli skupině Cl v poloze C-3, a tedy kvůli její zlepšené aktivitě, ale je často klasifikován jako takový kvůli svému postrannímu řetězci C-7, který více souvisí s první generace než druhá. Všechny cefalosporiny první generace mají a-aminoskupinu v poloze C-7. Tato struktura je činí náchylnými k hydrolýze β-laktamázami.[5][9]

Cefalosporiny 2. generace

Počáteční druhá generace cefalosporinů má velmi podobnou základní strukturu jako první generace. Loracarbef nemá však normální dihydrothiazinový kruh, ale je a karbacefém který má v kruhu atom uhlíku místo atomu síry, což z něj dělá tetrahydropyridinový kruh. Tato chemická vlastnost dává Loracarbef lepší stabilitu plazma při zachování orálních absorpčních charakteristik a afinity k vazbě na PBP. 7-fenyl -glycin je orálně dostupný a chlor v poloze C-3 je stejně aktivní jako Cefaclor. Důležitou strukturální změnou ve vývoji cefalosporinů druhé generace bylo zavedení a-iminomethoxyskupiny do postranního řetězce C-7. To poskytlo zvýšenou odolnost vůči β-laktamázám v důsledku stereochemického blokování beta-laktamového kruhu. Cefuroxim byl prvním cefalosporinem, který začlenil tento postranní řetězec. Další velmi důležitou skupinou ve druhé generaci je aminothiazol kroužek k postrannímu řetězu C-3. Tento vývoj drasticky zvýšil vazebnou afinitu k PBP a zvýšil antimikrobiální aktivitu. Aminothiazolový kruh lze vidět ve struktuře Cefotiam.[5][9]
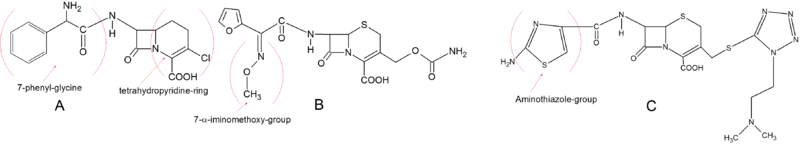
Cefalosporiny 3. generace

Většina cefalosporinů třetí generace má aminothiazolovou skupinu v poloze C-7. Na 7-a-pozici se nacházejí různé skupiny, jako 7-a-iminohydroxy a 7-a-iminomethoxy. Ceftibuten má však 7-a-ethylidenovou skupinu. Tato skupina poskytuje ceftibutenu vyšší odolnost vůči β-laktamázám se zvýšeným spektrem. Mnoho orálních cefalosporinů třetí generace je estery parenterálních forem a jsou hydrolyzovány esterázami v zažívací trakt (Cefteram -pivoxil). Některé z léků třetí generace mohou být absorbovány orálně bez nutnosti esterifikace. To se například provádí pomocí Cefixim a Cefdinir vložením a vinylová skupina v poloze C-3.[5][9]

Cefalosporiny 4. generace
Cefalosporiny čtvrté generace mají větší aktivitu proti gramnegativním bakteriím než druhá a třetí generace. Tento rozdíl se připisuje tomu, že jsou dipolární iontové zwitterion sloučeniny. Boční řetězec C-7 je podobný cefalosporinům třetí generace, obvykle obsahující iminomethoxy-aminothiazolovou skupinu nebo v případě Cefklidin aminothiadiazol. Kvůli pozitivně nabitému kvartérnímu dusíku v postranním řetězci C-3 mohou cefalosporiny čtvrté generace difundovat gramnegativní bakteriální membránou snadněji než dřívější cefalosporiny. Předpokládá se, že kladný náboj orientuje molekulu léčiva ke vstupu do porinového kanálu.[26]

Cefalosporiny 5. generace
V současné době jsou v této kategorii pouze dva léky, Ceftobiprol a Ceftarolin. Tyto nové léky jsou také jedinými β-laktamovými antibiotiky, proti nimž jsou účinné rezistentní na meticilinZlatý stafylokok (MRSA). Ceftobiprol je a pyrrolidinon -3-ylidenmethyl cephem. Boční řetězec C-3 byl speciálně navržen tak, aby měl silnou vazebnou afinitu k PBP2a a PBP2x. Je známo, že PBP2a dává stafylokoky rezistence na jiné β-laktamové léky a PBPx dělá totéž pro pneumokoky. Ceftobiprol má také aminothiazoylhydroxyiminový postranní řetězec v poloze C-7, o kterém je známo, že poskytuje dobrou rezistenci na β-laktamázu z S. aureus. Společně tyto aktivní skupiny způsobují, že Ceftobiprol je baktericidní vůči MRSA. Ceftobiprol má špatnou rozpustnost ve vodě, a proto se podává intravenózně jako esterové proléčivo zvané Ceftobiprol medokaril. Plazmatickými esterázami se rychle rozkládá na aktivní ceftobiprol.[27]Ceftarolin byl vyvinut z cefalosporinu čtvrté generace Cefozopran. Zachovává alkoxyimino skupinu v poloze C-7 z dřívějších generací, takže je v přítomnosti mnoha β-laktamáz poměrně stabilní. Vzhledem k rezistenci na MRSA a penicilin Streptococcus pneumoniae mají odolnost věnovanou novým typům PBP, PBP2a a PBP2x, jak Ceftaroline, tak Ceftobiprole mají C-3 postranní řetězce speciálně konstruované pro vázání těchto nových PBP. V případě ceftarolinu tento postranní řetězec obsahuje 2-thioazolythio spacerovou vazbu optimalizovanou pro jeho anti-MRSA aktivitu. Ceftarolin má nízkou rozpustnost ve vodě, ale tento problém byl překonán připojením N-fosfonoaminové skupiny k molekule, která vytváří intravenózní proléčivo ceftarolin fosamil. Proléčivo je defosforylovaný v plazmě za vzniku aktivního ceftarolinu.[28]

Aktuální stav
Antimikrobiální rezistence je hybnou silou pro vývoj nových antimikrobiálních látek. Složitost a rozmanitost mechanismů rezistence definovala potřebu nových a vylepšených β-laktamových antibiotik.[29] Díky svému širokému spektru dominují β-laktamu cefalosporiny chemoterapie i když jim často chybí orální biologická dostupnost.[9]
Dne 29. Října 2010 byla agenturou schválena nová látka obsahující cefalosporiny - Ceftarolin Úřad pro kontrolu potravin a léčiv (FDA). Teflaro (ceftarolin fosamil) je injekční antibiotické proléčivo k léčbě dospělých s akutními bakteriálními infekcemi kůže a kožních struktur (ABSSI) a komunitní bakteriální pneumonií (CABP).
Ceftobiprol byl schválen pro léčbu dospělých pacientů s nemocniční pneumonií (kromě VAP) a komunitní pneumonií ve 12 evropských zemích, Kanadě a Švýcarsku.[30][31]
Viz také
Reference
- ^ A b C d E F G Lemke, Thomas (2008). Foyeho principy léčivé chemie. Philadelphia: Lippincott Williams & Wilkins. str.1028 –1082. ISBN 978-0-7817-6879-5.
- ^ A b Klein, Lansing M. Prescott, John P. Harley, Donald A. (2005). Mikrobiologie (6. vyd.). Boston, Massachusetts: McGraw-Hill Higher Education. ISBN 978-0-07-111217-8.
- ^ A b C d Singh, Jasjit; Arrieta (leden 1999). "Nové cefalosporiny". Semináře z dětských infekčních nemocí. 10 (1): 14–22. doi:10.1016 / S1045-1870 (99) 80005-3.
- ^ A b Goodman & Gilman's Farmakologický základ terapeutik (12. vydání). New York: McGraw-Hill Medical. 2010-12-20. ISBN 978-0-07-162442-8.
- ^ A b C d E F García-Rodríguez, J.A .; Muñoz Bellido, J.L .; García Sánchez, J.E. (1995). "Perorální cefalosporiny: současné perspektivy". International Journal of Antimicrobial Agents. 5 (4): 231–243. doi:10.1016 / 0924-8579 (95) 00015-Z. ISSN 0924-8579. PMID 18611674.
- ^ Hamilton-Miller, J.M.T. (1. března 2008). "Vývoj polosyntetických penicilinů a cefalosporinů". International Journal of Antimicrobial Agents. 31 (3): 189–192. doi:10.1016 / j.ijantimicag.2007.11.010. PMID 18248798.
- ^ David Greenwood (21. února 2008). Antimikrobiální léky: Kronika lékařského triumfu dvacátého století. OUP Oxford. str. 128–. ISBN 978-0-19-953484-5.
- ^ Hara, Takuji (2003). Inovace ve farmaceutickém průmyslu: proces objevování a vývoje léčiv. Cheltenham [USA]: Elgar. ISBN 978-1-84376-050-4.
- ^ A b C d E Sader, H (1. prosince 1992). „Historický přehled spektra cefalosporinů: Čtyři generace strukturálního vývoje“. Antimikrobní zpravodaj. 8 (12): 75–82. doi:10.1016/0738-1751(92)90022-3.
- ^ A b C Bohlin, Gunnar Samuelsson, Lars (2009). Drogy přírodního původu: pojednání o farmakognozii (6., rev. Vyd.). Stockholm: Apotekarsocieteten. ISBN 978-91-976510-5-9.
- ^ Miguet, Laurence; Zervosen, Astrid; Gerards, Thomas; Pasha, Farhan A .; Luxen, André; Distèche-Nguyen, Martine; Thomas, Aline (2009). „Objev nových inhibitorů rezistentního Streptococcus pneumoniae proteinu vázajícího penicilin (PBP) 2x strukturním virtuálním screeningem“. Journal of Medicinal Chemistry. 52 (19): 5926–5936. doi:10.1021 / jm900625q. ISSN 0022-2623. PMID 19746934.
- ^ King, ed. Frank D. (2002). Léčivá chemie: principy a praxe (2. vyd.). Cambridge: Royal Soc. chemický. ISBN 978-0-85404-631-7.CS1 maint: další text: seznam autorů (odkaz)
- ^ Malouin, F .; Blais, J .; Chamberland, S .; Hoang, M .; Park, C .; Chan, C .; Mathias, K .; Hakem, S .; Dupree, K .; Liu, E .; Nguyen, T .; Dudley, M. N. (1. února 2003). „RWJ-54428 (MC-02 479), nový cefalosporin s vysokou afinitou k proteinům vázajícím penicilin, včetně PBP 2a a stability vůči stafylokokovým beta-laktamázám“. Antimikrobiální látky a chemoterapie. 47 (2): 658–664. doi:10.1128 / Aac.47.2.658-664.2003. PMC 151748. PMID 12543674.
- ^ A b Powell, A. J .; Tomberg, J .; Deacon, A. M .; Nicholas, R. A .; Davies, C. (28. října 2008). „Krystalové struktury proteinu 2 vázajícího penicilin z kmenů Neisseria gonorrhoeae citlivých a rezistentních na penicilin odhalují neočekávaně jemný mechanismus rezistence na antibiotika“. Journal of Biological Chemistry. 284 (2): 1202–1212. doi:10,1074 / jbc.M805761200. PMC 2613624. PMID 18986991.
- ^ Gutmann, L; Williamson, R; Collatz, E (říjen 1984). "Možná role porinů v rezistenci bakteriálních antibiotik". Annals of Internal Medicine. 101 (4): 554–7. doi:10.7326/0003-4819-101-4-554. PMID 6089637.
- ^ Sanders, CC; Sanders WE, Jr. (březen 1985). „Mikrobiální rezistence na β-laktamová antibiotika nové generace: klinické a laboratorní důsledky“. The Journal of Infectious Diseases. 151 (3): 399–406. doi:10.1093 / infdis / 151.3.399. PMID 2982957.
- ^ Spratt, Brian G. (10. března 1988). „Hybridní proteiny vázající penicilin v kmenech Neisseria gonorrhoeae rezistentních na penicilin“. Příroda. 332 (6160): 173–176. doi:10.1038 / 332173a0. PMID 3126399.
- ^ Fontana, R; Grossato, A; Rossi, L; Cheng, YR; Satta, G (listopad 1985). „Přechod z rezistence na hypersusceptibilitu na β-laktamová antibiotika spojený se ztrátou nízkoafinitního proteinu vázajícího penicilin u mutanta Streptococcus faecium vysoce rezistentního na penicilin“. Antimikrobiální látky a chemoterapie. 28 (5): 678–83. doi:10.1128 / aac.28.5.678. PMC 176356. PMID 3853962.
- ^ Hartman, BJ; Tomasz, A (květen 1984). „Nízkoafinitní protein vázající penicilin spojený s rezistencí na β-laktam u Staphylococcus aureus“. Journal of Bacteriology. 158 (2): 513–6. PMC 215458. PMID 6563036.
- ^ Handwerger, S; Tomasz, A (leden 1986). „Změny v proteinech vázajících penicilin klinických a laboratorních izolátů patogenního Streptococcus pneumoniae s nízkou úrovní rezistence na penicilin“. The Journal of Infectious Diseases. 153 (1): 83–9. doi:10.1093 / infdis / 153.1.83. PMID 3941290.
- ^ Bush, K; Jacoby, GA; Medeiros, AA (červen 1995). „Funkční klasifikační schéma pro beta-laktamázy a její korelace s molekulární strukturou“. Antimikrobiální látky a chemoterapie. 39 (6): 1211–33. doi:10.1128 / AAC.39.6.1211. PMC 162717. PMID 7574506.
- ^ Livermore, DM (říjen 1995). „beta-laktamázy v laboratorní a klinické rezistenci“. Recenze klinické mikrobiologie. 8 (4): 557–84. doi:10.1128 / CMR.8.4.557. PMC 172876. PMID 8665470.
- ^ Harrison, C. J .; Bratcher, D. (1. srpna 2008). "Cefalosporiny: recenze". Pediatrie v přehledu. 29 (8): 264–273. doi:10.1542 / pir.29-8-264. PMID 18676578.
- ^ Perez-Inestrosa, E; Suau, R; Montañez, MI; Rodriguez, R; Mayorga, C; Torres, MJ; Blanca, M (srpen 2005). "Chemická reaktivita cefalosporinů a její imunologické důsledky". Aktuální názor na alergii a klinickou imunologii. 5 (4): 323–30. doi:10.1097 / 01.all.0000173788.73401,69. PMID 15985814.
- ^ Kalman, D; Barriere, SL (1990). „Přehled farmakologie, farmakokinetiky a klinického použití cefalosporinů“. Texas Heart Institute Journal / Z Texas Heart Institute of Episcopal Hospital St. Luke, dětská nemocnice v Texasu. 17 (3): 203–15. PMC 324918. PMID 15227172.
- ^ FUNGTOMC, J (1. srpna 1997). „Cefalosporiny čtvrté generace“. Zpravodaj o klinické mikrobiologii. 19 (17): 129–136. doi:10.1016 / S0196-4399 (97) 82485-3.
- ^ Chahine, Elias B .; Nornoo, Adwoa O. (1. února 2011). „Ceftobiprol: První širokospektrální anti-methicilin rezistentní beta-laktam Staphylococcus aureus.“ Journal of Experimental & Clinical Medicine. 3 (1): 9–16. doi:10.1016 / j.jecm.2010.12.007.
- ^ Kaushik, Darpan; Rathi, Sudeep; Jain, Ankit (1. května 2011). „Ceftaroline: komplexní aktualizace“. International Journal of Antimicrobial Agents. 37 (5): 389–395. doi:10.1016 / j.ijantimicag.2011.01.017. PMID 21420284.
- ^ Theuretzbacher, Ursula (1. října 2011). "Odpor řídí vývoj antibakteriálních léků". Současný názor na farmakologii. 11 (5): 433–438. doi:10.1016 / j.coph.2011.07.008. PMID 21862408.
- ^ Basilea Medical Ltd. Souhrn údajů o přípravku: Zevtera 500 mg prášek pro koncentrát pro infuzní roztok. Regulační agentura pro léčivé přípravky a zdravotnické výrobky. http://www.mhra.gov.uk/spc
- ^ „Veřejná hodnotící zpráva“ (PDF). mhra.gov.uk.
