Faktor H - Factor H - Wikipedia
| Faktor komplementu H | |
|---|---|
 Komplement H tetramer, člověk | |
| Identifikátory | |
| Symbol | ? |
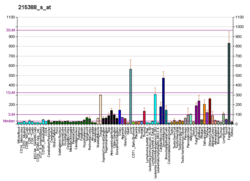
Faktor H je členem regulátorů rodiny aktivace komplementu a je kontrolní protein komplementu. Je to velký (155 kilodaltonů), rozpustný glykoprotein který cirkuluje v člověku plazma (při typických koncentracích 200–300 mikrogramů za mililitr[5][6][7]). Jeho hlavní funkcí je regulace alternativní cesta z doplňkový systém, zajišťující, aby systém doplňků směřoval k patogeny nebo jiný nebezpečný materiál a nepoškozuje tkáň hostitele. Faktor H reguluje aktivaci komplementu na vlastních buňkách a površích tím, že má jak aktivitu kofaktoru pro Faktor I. zprostředkovaný C3b štěpení a rozpad urychlující aktivitu proti alternativní cestě C3-konvertáza, C3bBb. Faktor H působí ochranně na vlastní buňky a vlastní povrchy, ale ne na povrchy bakterie nebo viry. To je považováno za výsledek Faktoru H, který má schopnost přijímat konformace s nižšími nebo vyššími aktivitami jako kofaktor pro aktivitu štěpení nebo rozpadu C3.[8] Konformace s nižší aktivitou je převládající formou v roztoku a je dostatečná pro řízení amplifikace kapalné fáze. Předpokládá se, že aktivnější konformace je indukována, když se váže faktor H glykosaminoglykany (GAG) a nebo kyseliny sialové které jsou obecně přítomny na hostitelských buňkách, ale ne normálně na patogenních površích, což zajišťuje ochranu vlastních povrchů, zatímco komplement pokračuje v nezmenšené míře na cizí povrchy.[9][10]
Struktura
Molekula se skládá z 20 kontrolní protein komplementu (CCP) moduly (označované také jako Short Consensus Repeats nebo sushi domény) vzájemně propojené krátkými linkery (mezi třemi a osmi aminokyselina zbytky) a uspořádány prodlouženým způsobem od hlavy po ocas. Každý z modulů CCP se skládá z přibližně 60 aminokyseliny se čtyřmi cystein zbytky disulfidově vázaný v uspořádání 1–3 2-4 a hydrofobní jádro postavené kolem téměř invariantu tryptofan zbytek. Moduly CCP jsou očíslovány od 1–20 (od N-konce proteinu); Komunikují CCP 1–4 a CCP 19–20 C3b zatímco CCP 7 a CCP 19–20 se vážou na GAG a kyselina sialová.[11] Dosud byly atomové struktury stanoveny pro CCP 1–3,[12] CCP 5,[13] CCP 7 (oba 402H a 402Y),[14] CCP 10–11 a CCP 11–12,[15] CCP 12–13,[16] CCP 15, CCP 16,[17] CCP 15–16,[18] CCP 18–20,[19] a CCP 19–20.[20][21] Atomová struktura pro CCP 6–8 (402H) vázaná na GAG napodobující oktasulfát sacharózy,[22] CCP 1–4 v komplexu s C3b[23] a CCP 19–20 v komplexu s C3d (což odpovídá thiosterové doméně C3b)[24][25] byly také stanoveny. Ačkoli struktura atomového rozlišení pro intaktní faktor H ještě nebyla stanovena, techniky s nízkým rozlišením naznačují, že může být v roztoku ohnuta zpět.[26] Dosud dostupné informace naznačují, že CCP moduly 1–4 jsou zodpovědné za aktivity akcelerace kofaktorů a rozpadu faktoru H, zatímco k diskriminaci sebe / ne-sebe dochází převážně prostřednictvím vazby GAG na moduly CCP 7 a / nebo vazbou GAG nebo kyseliny sialové na –20.[26][27]
Klinický význam
Vzhledem k ústřední roli, kterou faktor H hraje v regulaci komplementu, existuje řada klinických důsledků vyplývajících z aberantní aktivity faktoru H. Hyperaktivní faktor H může mít za následek sníženou aktivitu komplementu na patogenních buňkách - což zvyšuje náchylnost k mikrobiálním infekcím. Neaktivní faktor H může mít za následek zvýšenou aktivitu komplementu na zdravých hostitelských buňkách - což má za následek autoimunitní onemocnění. Není proto divu, že mutace nebo jednonukleotidové polymorfismy (SNP) ve faktoru H často vedou k patologiím. Kromě toho patogeny často používají ke zvýšení aktivity komplementu inhibující faktor H a další regulátory komplementu virulence.
Nedávno bylo objeveno, že asi 35% jedinců nese rizikový Single Nucleotide Polymorphism v jedné nebo obou kopiích svého genu pro faktor H. Homozygotní jednotlivci mají přibližně sedmkrát větší šanci na rozvoj Věkem podmíněné makulární degenerace, zatímco heterozygoti mají dvojnásobně až trojnásobně zvýšenou pravděpodobnost vzniku onemocnění. Ukázalo se, že tento SNP, umístěný v CCP modulu 7 faktoru H, ovlivňuje interakci mezi faktorem H a heparin což naznačuje kauzální vztah mezi SNP a nemocí.[14][28]
Delece dvou sousedních genů s vysokým stupněm homologie k faktor komplementu H, pojmenovaný související s faktorem H 3 a související s faktorem H 1, chrání před Věkem podmíněné makulární degenerace kvůli snížené kompetici o vazbu CFH na vazebná místa vaskulárního povrchu.[29][30]
Vzácná funkční kódovací změna R1210C v tomto genu vede k velmi vysokému riziku makulární degenerace.[31]
Schizofrenie
Změny imunitní odpovědi se podílejí na patogenezi mnoha neuropsychiatrických poruch včetně schizofrenie. Nedávné studie naznačily změny v doplňkový systém, včetně hyperaktivace alternativní cesta doplňku u pacientů se schizofrenií. Bylo zkoumáno funkční jedno nukleotidové polymorfismy (SNP) genu kódujícího faktor H (CFH) a bylo zjištěno, že CFH rs424535 (2783-526T> A) SNP byl pozitivně spojen se schizofrenií, takže rs424535 * Malá alela genu CFH může představovat rizikový faktor pro schizofrenii.[32]
Cévní mozková příhoda
Bylo zjištěno, že rs800292 (184G> A) SNP byl pozitivně spojen s cévní mozkovou příhodou a rs800912 minoritní alela genu CFH může být považována za rizikový faktor pro ischemickou cévní mozkovou příhodu.[32]
Atypický hemolyticko-uremický syndrom
Hemolyticko-uremický syndrom (HUS) je onemocnění spojené s mikroangiopatickou hemolytickou anémií, trombocytopenií a akutním selháním ledvin. Vzácná podmnožina tohoto onemocnění (označovaná jako atypický hemolyticko-uremický syndrom, aHUS) byla silně spojena s mutacemi v genech systému komplementu (včetně faktoru H, faktor I. a membránový kofaktorový protein ), přičemž mutace faktoru H jsou nejpočetnější. Tyto mutace faktoru H mají tendenci se shromažďovat směrem k C-konci faktoru H - oblasti odpovědné za diskriminaci sebe od sebe - a bylo prokázáno, že narušují heparin (modelová sloučenina pro glykosaminoglykany) a C3d (ekvivalent thioesterové domény C3b ) vazba.[33][34]
Nábor patogeny
Vzhledem k ústřední roli faktoru H při ochraně buněk před komplementem není divu, že několik důležitých lidí patogeny vyvinuli mechanismy pro nábor faktoru H. Toto nábor faktoru H patogeny poskytuje významnou odolnost proti napadení komplementem, a proto zvyšuje virulenci. Patogeny, u nichž bylo prokázáno, že získávají faktor H, zahrnují: Aspergillus spp .; Borrelia burgdorferi; B. duttonii; B. recurrentis; Candida albicans;[35] Francisella tularensis; Haemophilus influenzae; Neisseria meningitidis; Streptococcus pneumoniae;[8] a Streptococcus pyogenes Gramnegativní bakterie B.burgdorferi má pět proteinů vázajících faktor H: CRASP-1, CRASP-2, CRASP-3, CRASP-4 a CRASP-5.[36] Každý protein CRASP také váže plazminogen.[36]
Interakce
Bylo prokázáno, že faktor H. komunikovat s Doplňte komponentu 3.[37][38]
Rekombinantní produkce
Biologicky aktivní faktor H byl produkován Ralf Reski a spolupracovníky v mechový bioreaktor,[39] v procesu zvaném molekulární zemědělství. Velké množství biologicky aktivního lidského faktoru H, potenciálně vhodného pro terapeutické účely, bylo vyrobeno pomocí syntetické látky kodon optimalizovaný gen exprimovaný v droždí hostitel výrazu, Pichia pastoris.[40]
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000000971 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000026365 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Sofat R, Mangione PP, Gallimore JR, Hakobyan S, Hughes TR, Shah T a kol. (Duben 2013). "Distribuce a determinanty koncentrace faktoru H v oběhu stanovené vysokovýkonným imunonephelometrickým testem". Journal of Immunological Methods. 390 (1–2): 63–73. doi:10.1016 / j.jim.2013.01.009. PMID 23376722.
- ^ Hakobyan S, Harris CL, Tortajada A, Goicochea de Jorge E, García-Layana A, Fernández-Robredo P a kol. (Květen 2008). „Měření variant faktoru H v plazmě pomocí variantně specifických monoklonálních protilátek: aplikace k hodnocení rizika věkem podmíněné makulární degenerace“. Investigativní oftalmologie a vizuální věda. 49 (5): 1983–90. doi:10.1167 / iovs.07-1523. PMID 18436830.
- ^ Scholl HP, Charbel Issa P, Walier M, Janzer S, Pollok-Kopp B, Börncke F a kol. (Červenec 2008). "Systémová aktivace komplementu u makulární degenerace související s věkem". PLOS ONE. 3 (7): e2593. Bibcode:2008PLoSO ... 3.2593S. doi:10,1371 / journal.pone.0002593. PMC 2440421. PMID 18596911.
- ^ A b Herbert AP, Makou E, Chen ZA, Kerr H, Richards A, Rappsilber J, Barlow PN (listopad 2015). „Únik doplňku zprostředkovaný vylepšením zachyceného faktoru H: Důsledky pro ochranu vlastních povrchů před doplňkem“. Journal of Immunology. 195 (10): 4986–98. doi:10,4049 / jimmunol.1501388. PMC 4635569. PMID 26459349.
- ^ Pangburn MK (srpen 2000). "Rozpoznání hostitele a diferenciace cíle podle faktoru H, regulátoru alternativní cesty doplňku". Imunofarmakologie. 49 (1–2): 149–57. doi:10.1016 / S0162-3109 (00) 80300-8. PMID 10904114.
- ^ Rodríguez de Córdoba S, Esparza-Gordillo J, Goicoechea de Jorge E, Lopez-Trascasa M, Sánchez-Corral P (červen 2004). "Lidský faktor komplementu H: funkční role, genetické variace a asociace nemocí". Molekulární imunologie. 41 (4): 355–67. doi:10.1016 / j.molimm.2004.02.005. PMID 15163532.
- ^ Schmidt CQ, Herbert AP, Kavanagh D, Gandy C, Fenton CJ, Blaum BS a kol. (Srpen 2008). „Nová mapa glykosaminoglykanu a vazebných míst pro C3b na faktoru H“. Journal of Immunology. 181 (4): 2610–9. doi:10,4049 / jimmunol.181.4.2610. PMID 18684951.
- ^ Hocking HG, Herbert AP, Kavanagh D, Soares DC, Ferreira VP, Pangburn MK a kol. (Duben 2008). „Struktura N-koncové oblasti faktoru komplementu H a konformační důsledky variací sekvencí spojených s onemocněním“. The Journal of Biological Chemistry. 283 (14): 9475–87. doi:10,1074 / jbc.M709587200. PMC 2276370. PMID 18252712.
- ^ Barlow PN, Norman DG, Steinkasserer A, Horne TJ, Pearce J, Driscoll PC, et al. (Duben 1992). "Struktura řešení pátého opakování faktoru H: druhý příklad proteinového modulu kontroly komplementu". Biochemie. 31 (14): 3626–34. doi:10.1021 / bi00129a011. PMID 1533152.
- ^ A b Herbert AP, Deakin JA, Schmidt CQ, Blaum BS, Egan C, Ferreira VP a kol. (Červen 2007). „Struktura ukazuje, že místo pro rozpoznávání glykosaminoglykanů a proteinů ve faktoru H je narušeno polymorfismem jednoho nukleotidu spojeného s věkem souvisejícím s makulární degenerací.“. The Journal of Biological Chemistry. 282 (26): 18960–8. doi:10,1074 / jbc.M609636200. PMID 17360715.
- ^ Makou E, Mertens HD, Maciejewski M, Soares DC, Matis I, Schmidt CQ a kol. (Prosinec 2012). „Struktura řešení CCP modulů 10-12 osvětluje funkční architekturu regulátoru komplementu, faktor H“. Journal of Molecular Biology. 424 (5): 295–312. doi:10.1016 / j.jmb.2012.09.013. PMC 4068365. PMID 23017427.
- ^ Schmidt CQ, Herbert AP, Mertens HD, Guariento M, Soares DC, Uhrin D a kol. (Leden 2010). „Centrální část faktoru H (moduly 10-15) je kompaktní a obsahuje strukturálně odlišný modul CCP“. Journal of Molecular Biology. 395 (1): 105–22. doi:10.1016 / j.jmb.2009.10.010. PMC 2806952. PMID 19835885.
- ^ Norman DG, Barlow PN, Baron M, Day AJ, Sim RB, Campbell ID (červen 1991). "Trojrozměrná struktura proteinového modulu kontroly komplementu v roztoku". Journal of Molecular Biology. 219 (4): 717–25. doi:10.1016 / 0022-2836 (91) 90666-T. PMID 1829116.
- ^ Barlow PN, Steinkasserer A, Norman DG, Kieffer B, Wiles AP, Sim RB, Campbell ID (červenec 1993). "Struktura řešení dvojice doplňkových modulů nukleární magnetickou rezonancí". Journal of Molecular Biology. 232 (1): 268–84. doi:10.1006 / jmbi.1993.1381. PMID 8331663.
- ^ Morgan HP, Mertens HD, Guariento M, Schmidt CQ, Soares DC, Svergun DI a kol. (2012). "Strukturální analýza C-terminální oblasti (moduly 18-20) faktoru H regulátoru komplementu (FH)". PLOS ONE. 7 (2): e32187. Bibcode:2012PLoSO ... 732187M. doi:10.1371 / journal.pone.0032187. PMC 3289644. PMID 22389686.
- ^ Herbert AP, Uhrín D, Lyon M, Pangburn MK, Barlow PN (červen 2006). „Varianty sekvencí spojené s nemocí se shromažďují v uzlu pro rozpoznávání polyanionů na lidském faktoru H odhaleném v trojrozměrné struktuře“. The Journal of Biological Chemistry. 281 (24): 16512–20. doi:10,1074 / jbc.M513611200. PMID 16533809.
- ^ Jokiranta TS, Jaakola VP, Lehtinen MJ, Pärepalo M, Meri S, Goldman A (duben 2006). „Struktura karboxylového konce faktoru komplementu H odhaluje molekulární základ atypického hemolyticko-uremického syndromu“. Časopis EMBO. 25 (8): 1784–94. doi:10.1038 / sj.emboj.7601052. PMC 1440827. PMID 16601698.
- ^ Prosser BE, Johnson S, Roversi P, Herbert AP, Blaum BS, Tyrrell J a kol. (Říjen 2007). „Strukturální základ pro makulární degeneraci související s věkem související s faktorem H“. The Journal of Experimental Medicine. 204 (10): 2277–83. doi:10.1084 / jem.20071069. PMC 2118454. PMID 17893204.
- ^ Wu J, Wu YQ, Ricklin D, Janssen BJ, Lambris JD, Gros P (červenec 2009). "Struktura fragmentu komplementu C3b-faktor H a důsledky pro ochranu hostitele regulátory komplementu". Přírodní imunologie. 10 (7): 728–33. doi:10.1038 / ni.1755. PMC 2713992. PMID 19503104.
- ^ Morgan HP, Schmidt CQ, Guariento M, Blaum BS, Gillespie D, Herbert AP a kol. (Duben 2011). „Strukturální základ pro zapojení faktorem komplementu H C3b na vlastní povrch“. Přírodní strukturní a molekulární biologie. 18 (4): 463–70. doi:10.1038 / nsmb.2018. PMC 3512577. PMID 21317894.
- ^ Kajander T, Lehtinen MJ, Hyvärinen S, Bhattacharjee A, Leung E, Isenman DE a kol. (Únor 2011). „Duální interakce faktoru H s C3d a glykosaminoglykany při diskriminaci hostitel-nehostitel komplementem“. Sborník Národní akademie věd Spojených států amerických. 108 (7): 2897–902. Bibcode:2011PNAS..108,2897 tis. doi:10.1073 / pnas.1017087108. PMC 3041134. PMID 21285368.
- ^ A b Aslam M, Perkins SJ (červen 2001). „Skládaná struktura řešení monomerního faktoru H lidského komplementu pomocí synchrotronového rentgenového záření a rozptylu neutronů, analytická ultracentrifugace a omezené molekulární modelování“. Journal of Molecular Biology. 309 (5): 1117–38. doi:10.1006 / jmbi.2001.4720. PMID 11399083.
- ^ Kirkitadze MD, Barlow PN (duben 2001). "Struktura a flexibilita proteinů s více doménami, které regulují aktivaci komplementu". Imunologické recenze. 180: 146–61. doi:10.1034 / j.1600-065X.2001.1800113.x. PMID 11414356.
- ^ Hageman GS, Anderson DH, Johnson LV, Hancox LS, Taiber AJ, Hardisty LI a kol. (Květen 2005). „Společný haplotyp v komplementárním regulačním genovém faktoru H (HF1 / CFH) předurčuje jedince k makulární degeneraci související s věkem“. Sborník Národní akademie věd Spojených států amerických. 102 (20): 7227–32. doi:10.1073 / pnas.0501536102. PMC 1088171. PMID 15870199.
- ^ Hughes AE, Orr N, Esfandiary H, Diaz-Torres M, Goodship T, Chakravarthy U (říjen 2006). „Běžný haplotyp CFH s delecí CFHR1 a CFHR3 je spojen s nižším rizikem makulární degenerace související s věkem.“ Genetika přírody. 38 (10): 1173–7. doi:10.1038 / ng1890. PMID 16998489.
- ^ Fritsche LG, Lauer N, Hartmann A, Stippa S, Keilhauer CN, Oppermann M a kol. (Prosinec 2010). „Nerovnováha lidských regulačních proteinů komplementu CFHR1, CFHR3 a faktoru H ovlivňuje riziko věkem podmíněné makulární degenerace (AMD)“. Lidská molekulární genetika. 19 (23): 4694–704. doi:10,1093 / hmg / ddq399. PMID 20843825.
- ^ Raychaudhuri S, Iartchouk O, Chin K, Tan PL, Tai AK, Ripke S a kol. (Říjen 2011). „Vzácná penetrační mutace v CFH přináší vysoké riziko věkem podmíněné makulární degenerace“. Genetika přírody. 43 (12): 1232–6. doi:10.1038 / ng.976. PMC 3225644. PMID 22019782.
- ^ A b Boyajyan A, Ghazaryan H, Stepanyan A, Zakharyan R (prosinec 2013). "Genetické polymorfismy faktoru komplementu H u schizofrenie a ischemické cévní mozkové příhody". Mol. Immunol. 56 (3): 294. doi:10.1016 / j.molimm.2013.05.154.
- ^ Atkinson JP, Goodship TH (červen 2007). "Doplňkový faktor H a hemolyticko-uremický syndrom". The Journal of Experimental Medicine. 204 (6): 1245–8. doi:10.1084 / jem.20070664. PMC 2118604. PMID 17548524.
- ^ de Jorge EG, Macor P, Paixão-Cavalcante D, Rose KL, Tedesco F, Cook HT a kol. (Leden 2011). „Vývoj atypického hemolyticko-uremického syndromu závisí na komplementu C5“. Časopis Americké nefrologické společnosti. 22 (1): 137–45. doi:10.1681 / ASN.2010050451. PMC 3014042. PMID 21148255.
- ^ Luo S, Poltermann S, Kunert A, Rupp S, Zipfel PF (prosinec 2009). „Imunitní únik lidských patogenních kvasinek Candida albicans: Pra1 je faktor H, FHL-1 a povrchový protein vázající plazminogen“. Molekulární imunologie. 47 (2–3): 541–50. doi:10.1016 / j.molimm.2009.07.017. PMID 19850343.
- ^ A b Zipfel PF, Hallström T, Riesbeck K (prosinec 2013). „Kontrola lidského komplementu a únik komplementu patogenními mikroby - vyvážení rovnováhy“. Molekulární imunologie. 56 (3): 152–60. doi:10.1016 / j.molimm.2013.05.222. PMID 23810413.
- ^ Soames CJ, Sim RB (září 1997). „Interakce mezi složkami lidského komplementu, faktorem H, faktorem I a C3b“. The Biochemical Journal. 326 (Pt 2) (Pt 2): 553–61. doi:10.1042 / bj3260553. PMC 1218704. PMID 9291131.
- ^ Jokiranta TS, Westin J, Nilsson UR, Nilsson B, Hellwage J, Löfås S a kol. (Březen 2001). "Komplementární interakce C3b studovány technikou povrchové plazmonové rezonance". Mezinárodní imunofarmakologie. 1 (3): 495–506. doi:10.1016 / S1567-5769 (00) 00042-4. PMID 11367533.
- ^ Büttner-Mainik A, Parsons J, Jérôme H, Hartmann A, Lamer S, Schaaf A a kol. (Duben 2011). "Produkce biologicky aktivního lidského faktoru H ve Physcomitrella". Plant Biotechnology Journal. 9 (3): 373–83. doi:10.1111 / j.1467-7652.2010.00552.x. PMID 20723134.
- ^ Schmidt CQ, Slingsby FC, Richards A, Barlow PN (duben 2011). „Produkce biologicky aktivního faktoru komplementu H v terapeuticky užitečných množstvích“. Exprese a čištění proteinů. 76 (2): 254–63. doi:10.1016 / j.pep.2010.12.002. PMC 4067574. PMID 21146613.
Další čtení
- Bradley DT, Zipfel PF, Hughes AE (červen 2011). „Doplněk k věkem podmíněné makulární degeneraci: důraz na funkci“. Oko. 25 (6): 683–93. doi:10.1038 / oko.2011.37. PMC 3178140. PMID 21394116.
- Kardys I, Klaver CC, Despriet DD, Bergen AA, Uitterlinden AG, Hofman A, et al. (Duben 2006). „Běžný polymorfismus v genu faktoru komplementu H je spojen se zvýšeným rizikem infarktu myokardu: Rotterdamská studie“. Journal of the American College of Cardiology. 47 (8): 1568–75. doi:10.1016 / j.jacc.2005.11.076. PMID 16630992.
- Pío R, Elsasser TH, Martínez A, Cuttitta F (duben 2002). "Identifikace, charakterizace a fyziologické působení faktoru H jako proteinu vázajícího adrenomedullin přítomného v lidské plazmě". Mikroskopický výzkum a technika. 57 (1): 23–7. doi:10.1002 / jemt.10047. PMID 11921353.
- Walport MJ (duben 2001). "Doplněk. První ze dvou částí". The New England Journal of Medicine. 344 (14): 1058–66. doi:10.1056 / NEJM200104053441406. PMID 11287977.
- Walport MJ (duben 2001). "Doplněk. Druhá ze dvou částí". The New England Journal of Medicine. 344 (15): 1140–4. doi:10.1056 / NEJM200104123441506. PMID 11297706.
externí odkazy
- GeneReviews / NCBI / NIH / UW záznam o atypickém hemolyticko-uremickém syndromu
- GeneReviews / NCBI / NIH / UW záznam o nemoci s hustým depozitem / Membranoproliferativní glomerulonefritida typu II
- Položky OMIM týkající se atypického hemolyticko-uremického syndromu
- Doplněk + Faktor + H v americké národní lékařské knihovně Lékařské předměty (Pletivo)