Ribonukleáza T. - Ribonuclease T
| Ribonukleáza T. | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Dimer ribonukleázy T v komplexu s DNA (oranžový), z PDB ID 3NH1.[1] | |||||||||
| Identifikátory | |||||||||
| Symbol | rnt | ||||||||
| Pfam | PF00929 | ||||||||
| InterPro | IPR013520 | ||||||||
| CHYTRÝ | SM00479 | ||||||||
| |||||||||
Ribonukleáza T. (RNase T, exonukleáza T, exo T) je ribonukleáza enzym podílí se na zrání přenos RNA a ribozomální RNA v bakterie,[2] stejně jako v Oprava DNA cesty.[3] Je členem DnaQ rodina exonukleázy a ne-procesně působí na 3' konec jednovláknové nukleové kyseliny. RNáza T je schopná štěpit obojí DNA a RNA, s extrémem sekvence diskriminační specifičnost cytosin na 3 'konci Podklad.[1][2]
Struktura a mechanismus
RNAáza T katalyzuje odstranění nukleotidů z 3 'konce RNA i DNA. Inhibuje ji jak dvouvláknová DNA, tak RNA cytosin zbytky na 3 'konci RNA. Zdá se, že dva cytosiny na 3 'konci RNA zcela odstraňují aktivitu RNAsy T.[3] Tento cytosinový účinek je však u ssDNA pozorován méně. Tento nedostatek sekvenční specificity v ssDNA v kombinaci s jeho schopností působit na ssDNA v blízkosti duplexní oblasti vedl k jeho použití při vytváření tupých konců pro klonování DNA.[4] Strukturálně RNAse T existuje jako antiparalelní dimer[5][6] a vyžaduje dvojmocný kationt, aby fungoval.[7]
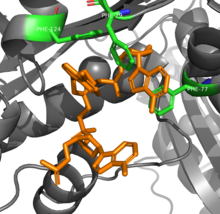
RNAse T je schopna dosáhnout své sekvenční specificity při trávení RNA prostřednictvím několika aromatický zbytky, které se sendvičují mezi nukleobázemi. The π -π interakce mezi čtyřmi fenylalanin zbytky a dva nukleotidy na 3 'konci se liší v závislosti na identifikaci nukleotidů, což mění konformaci a tím i aktivitu enzymu.[8] Další kyselina glutamová zbytek rotuje na vodíkovou vazbu na cytosin ne jinými bázemi, což dále zvyšuje specificitu.[9]
Funkce
Jako člen větší rodiny exoribonukleáz DEDD hraje RNAse T klíčovou roli při zrání tRNA.[10] stejně jako zrání 5S[11] a 23S[12] rRNA domény. Konkrétně RNAse T štěpí 3 ' AMP zbytek ze 3 'CCA sekvencí na konci tRNA, což vysvětluje specificitu sekvence RNAse T pro zastavení na 3' CC sekvenci.[13] Kromě toho může RNAse T hrát roli v opravě DNA štěpením 3 'konce vyduté DNA.[3]
Zatímco E-coli může přežít bez RNAsy T, jeho absence vede k pomalejším životním cyklům a oslabené reakci na hladovění.[14] Přítomnost RNAsy T v E. coli je navíc spojena se zvýšenou odolností proti UV poškození.[15] Předpokládalo se, že zatímco jiné ribonukleázy mohou vykonávat funkci RNAse T, skutečnost, že RNAse T je účinnější při štěpení DNA a RNA v blízkosti dvouvláknových oblastí, znamená, že alternativy jsou méně účinné.[16] Přes zjevnou užitečnost RNAsy T se enzym nachází pouze v gamaproteobakterie.[17]
V E. coli je RNAáza T kódována genem rnt a předpokládá se, že se lišila od korekturních podjednotek polymeráza III během vzniku gamaproteobakterií.[16][17]
Reference
- ^ A b Hsiao YY, Duh Y, Chen YP, Wang YT, Yuan HS (září 2012). „Jak exonukleáza rozhodne, kde se zastaví v ořezávání nukleových kyselin: krystalové struktury komplexů T-produktů RNázy“. Výzkum nukleových kyselin. 40 (16): 8144–54. doi:10.1093 / nar / gks548. PMC 3439924. PMID 22718982.
- ^ A b Zuo Y, poslanec Deutscher (srpen 2002). „Fyziologickou roli RNázy T lze vysvětlit její neobvyklou specificitou substrátu“. The Journal of Biological Chemistry. 277 (33): 29654–61. doi:10,1074 / jbc.M204252200. PMID 12050169.
- ^ A b C Hsiao YY, Fang WH, Lee CC, Chen YP, Yuan HS (březen 2014). „Strukturální pohledy na opravu DNA pomocí RNázy T - exonukleázy zpracovávající 3 'konec strukturované DNA v opravných drahách“. PLOS Biology. 12 (3): e1001803. doi:10.1371 / journal.pbio.1001803. PMC 3942315. PMID 24594808.
- ^ Zuo Y, poslanec Deutscher (říjen 1999). „DNázová aktivita RNázy T a její aplikace na klonování DNA“. Výzkum nukleových kyselin. 27 (20): 4077–82. doi:10.1093 / nar / 27.20.4077. PMC 148676. PMID 10497273.
- ^ Li Z, Zhan L, Deutscher MP (leden 1996). „RNáza T Escherichia coli funguje in vivo jako dimer závislý na cysteinu 168“. The Journal of Biological Chemistry. 271 (2): 1133–7. doi:10.1074 / jbc.271.2.1133. PMID 8557641.
- ^ Zuo Y, Zheng H, Wang Y, Chruszcz M, Cymborowski M, Skarina T a kol. (Duben 2007). „Krystalová struktura RNázy T, exoribonukleázy zapojené do zrání tRNA a koncového obratu“. Struktura. 15 (4): 417–28. doi:10.1016 / j.str.2007.02.004. PMC 1907377. PMID 17437714.
- ^ Deutscher MP, Marlor CW (červen 1985). "Čištění a charakterizace Escherichia coli RNase T". The Journal of Biological Chemistry. 260 (11): 7067–71. PMID 3888994.
- ^ Duh Y, Hsiao YY, Li CL, Huang JC, Yuan HS (prosinec 2015). "Aromatické zbytky v RNase T stack s nukleobázemi pro vedení sekvenčně specifického rozpoznávání a štěpení nukleových kyselin". Věda o bílkovinách. 24 (12): 1934–41. doi:10,1002 / pro.2800. PMC 4815224. PMID 26362012.
- ^ Hsiao YY, Yang CC, Lin CL, Lin JL, Duh Y, Yuan HS (duben 2011). "Strukturální základ pro ořezávání RNA pomocí RNázy T ve stabilní zrání 3'-konce RNA". Přírodní chemická biologie. 7 (4): 236–43. doi:10.1038 / nchembio.524. PMID 21317904.
- ^ Li Z, Deutscher MP (srpen 1996). "Maturační dráhy pro prekurzory tRNA E. coli: náhodný multienzymový proces in vivo". Buňka. 86 (3): 503–12. doi:10.1016 / s0092-8674 (00) 80123-3. PMID 8756732.
- ^ Li Z, poslanec Deutscher (červenec 1995). „Enzym tRNA zpracovávající RNázu T je nezbytný pro zrání 5S RNA“. Sborník Národní akademie věd Spojených států amerických. 92 (15): 6883–6. Bibcode:1995PNAS ... 92,6883L. doi:10.1073 / pnas.92.15.6883. PMC 41434. PMID 7542780.
- ^ Li Z, Pandit S, Deutscher MP (leden 1999). „Zrání ribozomální RNA 23S vyžaduje exoribonukleázu RNasu T“. RNA. 5 (1): 139–46. doi:10.1017 / s1355838299981669. PMC 1369746. PMID 9917073.
- ^ Deutscher MP, Marlor CW, Zaniewski R (červenec 1984). „Ribonukleáza T: nová exoribonukleáza pravděpodobně zapojená do konečného obratu tRNA“. Sborník Národní akademie věd Spojených států amerických. 81 (14): 4290–3. Bibcode:1984PNAS ... 81.4290D. doi:10.1073 / pnas.81.14.4290. PMC 345573. PMID 6379642.
- ^ Kelly KO, poslankyně Deutscher (říjen 1992). „Přítomnost pouze jedné z pěti exoribonukleáz je dostatečná pro podporu růstu Escherichia coli.“. Journal of Bacteriology. 174 (20): 6682–4. doi:10.1128 / jb.174.20.6682-6684.1992. PMC 207653. PMID 1400219.
- ^ Viswanathan M, Lanjuin A, Lovett ST (březen 1999). „Identifikace RNázy T jako potlačovače vysoké citlivosti na UV záření spojené s nedostatkem jednovláknové exonukleázy DNA v Escherichia coli“. Genetika. 151 (3): 929–34. PMC 1460521. PMID 10049912.
- ^ A b Bechhofer DH, Deutscher MP (červen 2019). "Bakteriální ribonukleázy a jejich role v metabolismu RNA". Kritické recenze v biochemii a molekulární biologii. 54 (3): 242–300. doi:10.1080/10409238.2019.1651816. PMC 6776250. PMID 31464530.
- ^ A b Zuo Y, poslanec Deutscher (březen 2001). „Superrodiny exoribonukleázy: strukturní analýza a fylogenetická distribuce“. Výzkum nukleových kyselin. 29 (5): 1017–26. doi:10.1093 / nar / 29.5.1017. PMC 56904. PMID 11222749.
