Arginin: glycinaminidinotransferáza - Arginine:glycine amidinotransferase - Wikipedia
| Glycin amidinotransferáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Stereo pohled na AGAT ve standardní orientaci s úchyty koše v horní části modelu[1] | |||||||||
| Identifikátory | |||||||||
| EC číslo | 2.1.4.1 | ||||||||
| Číslo CAS | 9027-35-4 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
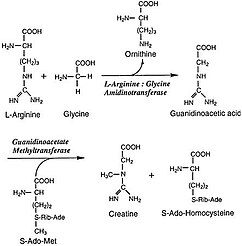

L-Arginin: glycinaminidinotransferáza (AGAT; ES 2.1.4.1 ) je enzym který katalyzuje přenos amidino skupina z L-arginin na glycin. Výrobky jsou L-ornitin a glykocyamin, známý také jako guanidinoacetát, bezprostřední předchůdce kreatin. Kreatin a jeho fosforylovaná forma hrají ústřední roli v energetickém metabolismu svalových a nervových tkání. Kreatin je v nejvyšší koncentraci v buňkách kosterního svalu, srdce, spermií a fotoreceptorů. Kreatin pomáhá tlumit rychlé změny ADP /ATP poměr ve svalových a nervových buňkách během aktivních období. Kreatin je také syntetizován v jiných tkáních, jako je např slinivka břišní, ledviny, a játra, kde se amidinotransferáza nachází v cytoplazma, včetně mezimembránový prostor z mitochondrie buněk, které tyto tkáně tvoří.[2]
Funkce
L-Arginin: glycinaminidinotransferáza katalyzuje první, která je také odhodlaný krok při tvorbě kreatinu. Druhý krok procesu, při kterém se produkuje vlastní molekula kreatinu, se vyskytuje pouze v cytosol, kde se nachází druhý enzym, S-adenosylmethionin: guanidinoacetát methyltransferáza (GAMT). Kreatin je poté transportován krevním řečištěm a přijímán transportéry kreatinu závislými na sodíku buňkami, které vyžadují kreatin.[1]
Struktura
The Krystalická struktura AGAT určili Humm, Fritsche, Steinbacher a Huber z Institut biochemie Maxe Plancka v Martinsried, Německo v roce 1997. Rentgenové vyšetření struktury odhalilo novou symetrii s pětinásobnou pseudosymetrií modulů beta beta abecedy. Celková struktura molekuly připomíná koš s úchyty. Aktivní místo leží na dně dlouhého úzkého kanálu a zahrnuje katalytickou triádu Cys-His-Asp. Mezilehlá struktura zahrnuje amidino skupinu dočasně kovalentně vázající se na zbytek Cys na katalytické triádě, zatímco zbytek His se podílí na obecné kyselé / bazické katalýze, což znamená, že působí jako donor / příjemce samotného protonu.[2]
Reakce
Skutečnou reakcí katalyzovanou AGATem je syntéza guanidinoacetátu z argininu a glycinu s ornithinem jako vedlejší produkt. Vyrobený guanidinoacetát se poté spojí s S-Adenosyl-L-methionin, reakce katalyzovaná GAMT, na produkci kreatinu a S-Adenosyl-L-homocystein. Mechanismus, kterým AGAT katalyzuje tento spáchaný krok, sleduje a ping-pongový mechanismus, a zahrnuje přenos amidinové skupiny na zbytek Cys407 na proteinu z L-arginin, který opouští jako L-ornitin. Zbytek His303 poté extrahuje proton z glycinu, který poté zachytí amidinoskupinu z Cys407 výměnou za proton, aby se stal guanidinoacetátem a obnovil katalyzátor.[2]
Regulace projevu a činnosti
Tvorba guanidinoacetátu je obvykle krokem omezujícím rychlost biosyntézy kreatinu.[3] V důsledku toho je AGAT reakce nejpravděpodobnějším kontrolním krokem v cestě, hypotéza, která je podporována velkou experimentální prací. Nejdůležitější v tomto ohledu je zpětnovazební represi AGAT kreatinem, konečným produktem dráhy. Cyklocreatin, N-acetimidoylsarkosin a N-ethylguanidinoacetát vykazují represorovou aktivitu stejně jako kreatin. L-Arginin a guanidinoacetát mají pouze „zjevnou“ represorovou aktivitu. Samy o sobě nemají žádný účinek na expresi AGAT, ale snadno se převádějí na kreatin, který pak působí jako pravý represor.[4] Bylo navrženo, že aktivita AGAT v tkáních je regulována mnoha způsoby, včetně indukce růstový hormon a tyroxin,[5] inhibice enzymu ornitinem,[6] a potlačování jeho syntézy kreatinem.[7][8]
Pohlavní hormony mohou regulovat aktivitu přípravku AGAT.[9] Ošetření samců potkanů testosteron propionát zvyšuje aktivitu AGAT. V porovnání, estrogen léčba snižuje aktivitu AGAT a vyvolává úbytek hmotnosti. V současné době není jasné, zda změny v úrovni transkriptu AGAT vyplývají ze změněné stability mRNA nebo zvýšené rychlosti transkripce. Pokud je estrogenem zprostředkovaná změna výsledkem transkripční regulace, je třeba ještě určit místo působení estrogenu.[10]
Ukázalo se, že výraz GATM v placentě myši je potištěn, což znamená pouze jeho mateřskou kopii GATM je vyjádřen. Z tohoto důvodu se předpokládá, že GATM působí jako látka potlačující růst v placentě.
Klinický význam
Nedostatek
V roce 2000 The American Journal of Human Genetics uvedl dvě sourozenkyně ve věku 4 a 6 let s mentální retardací a těžkým nedostatkem kreatinu v mozku.[11] Arginin: glycinaminidinotransferáza (AGAT) katalyzuje první krok syntézy kreatinu, což vede k tvorbě guanidinoacetátu, který je substrátem pro tvorbu kreatinu. U dvou sourozenců s mentální retardací, které měly nedostatek kreatinu v mozku, který byl reverzibilní pomocí orálního doplňování kreatinu a měl nízké koncentrace guanidinoacetátu v moči, Arginin: nedostatek glycin amidinotransferázy byl identifikován jako nový genetický defekt v metabolismu kreatinu. Je to jeden ze tří nedostatek kreatinu v mozku.
Pacienti s nedostatkem kreatinu v mozku mají nespecifické neurologické příznaky, včetně mentální retardace, jazykové poruchy, epilepsie, autistický chování, neurologické zhoršení a poruchy hybnosti. Nedostatek AGAT má za následek nedostatek kreatinu v těle. Léčba je kreatinovými doplňky, protože tělo si kreatin nedokáže samo vyrobit. Pozitivní výsledky léčby kreatinem (u deficitů AGAT) a pozorování, že fetální a časný postnatální vývoj jsou u těchto pacientů normální, podporují hypotézu, že dřívější diagnostika a léčba může podstatně zlepšit konečnou prognózu těchto onemocnění. Mozek 1H-PANÍ vyšetření je spolehlivá a minimálně invazivní technika pro hodnocení poruch kreatinu v mozku. Kvůli omezené dostupnosti a vysokým nákladům nelze techniku 1H-MRS navrhnout pro všechny děti, jejichž klinický stav naznačuje diagnózu vyčerpání mozkového kreatinu.[12]
Deficit AGAT je spolu s defektem transportéru kreatinu jedním ze tří vrozených chyb biosyntetické / transportní dráhy kreatinu. Prevalence těchto defektů není známa, nicméně u mentálně retardovaných dětí bylo pozorováno, že se vyskytují častěji. Skutečná genetická mutace spojená s AGAT zahrnuje a tryptofan kodon se převádí na stop kodon ve zbytku 149.[11]
Srdeční selhání
Microarray analýza z jedné zprávy ukazuje významné snížení genové exprese myokardu arginin: glycinaminidinotransferáza (AGAT) během srdečního selhání v pozdním stadiu. To naznačuje, že snížený AGAT může korelovat se ztrátou srdeční funkce. Zvýšení exprese AGAT v myokardu po srdečním selhání v důsledku zvýšení syntézy kreatinu bylo spojeno s příznivým výsledkem.[13]
Reference
- ^ A b C d Humm A, Fritsche E, Steinbacher S, Huber R (červen 1997). „Krystalová struktura a mechanismus lidského L-argininu: glycinaminidinotransferáza: mitochondriální enzym podílející se na biosyntéze kreatinu“. EMBO J.. 16 (12): 3373–85. doi:10.1093 / emboj / 16.12.3373. PMC 1169963. PMID 9218780.
- ^ A b C Humm A, Fritsche E, Mann K, Göhl M, Huber R (březen 1997). „Rekombinantní exprese a izolace lidského L-argininu: glycinaminidinotransferáza a identifikace jeho cysteinového zbytku v aktivním místě“. Biochem. J. 322 (3): 771–6. doi:10.1042 / bj3220771. PMC 1218254. PMID 9148748.
- ^ Walker JB (1979). "Kreatin: biosyntéza, regulace a funkce". Adv. Enzymol. Relat. Oblasti Mol. Biol. 50: 177–242. PMID 386719.
- ^ Wyss M, Kaddurah-Daouk R (červenec 2000). "Kreatin a metabolismus kreatininu". Physiol. Rev. 80 (3): 1107–213. doi:10.1152 / fyzrev.2000.80.3.1107. PMID 10893433.
- ^ McGuire DM, CD Tormanen, Segal IS, Van Pilsum JF (únor 1980). "Vliv růstového hormonu a tyroxinu na množství L-argininu: glycinaminidinotransferázy v ledvinách potkanů hypofyzektomizovaných. Čištění a některé vlastnosti transamidinázy ledvin ledvin." J. Biol. Chem. 255 (3): 1152–9. PMID 6766137.
- ^ Sipilä I (1980). "Inhibice arginin-glycin amidinotransferázy ornithinem. Možný mechanismus pro svalové a chorioretinální atrofie v gyrátové atrofii cévnatky a sítnice s hyperornithinemií". Biochim. Biophys. Acta. 613 (1): 79–84. doi:10.1016/0005-2744(80)90194-1. PMID 7378422.
- ^ McGuire DM, Gross MD, Van Pilsum JF, Towle HC (říjen 1984). "Represe krysí ledviny L-arginin: syntéza glycin amidinotransferázy kreatinem na úrovni před translací". J. Biol. Chem. 259 (19): 12034–8. PMID 6384218.
- ^ Guthmiller P, Van Pilsum JF, Boen JR, McGuire DM (červenec 1994). „Klonování a sekvenování krysí ledviny L-arginin: glycinaminidinotransferáza. Studie mechanismu regulace růstovým hormonem a kreatinem“. J. Biol. Chem. 269 (26): 17556–60. PMID 8021264.
- ^ Kriskó I, Walker JB (prosinec 1966). "Vliv pohlavních hormonů na hladiny amidinotransferázy. Metabolická kontrola biosyntézy kreatinu". Acta Endocrinol. 53 (4): 655–62. doi:10.1530 / acta.0.0530655. PMID 5953691.
- ^ Zhu Y, Evans MI (květen 2001). "Estrogen moduluje expresi L-argininu: glycinaminidinotransferázy v kuřecích játrech". Mol. Buňka. Biochem. 221 (1–2): 139–45. doi:10.1023 / A: 1010946414017. PMID 11506177.
- ^ A b Položka CB, Stöckler-Ipsiroglu S, Stromberger C, Mühl A, Alessandrì MG, Bianchi MC, Tosetti M, Fornai F, Cioni G (listopad 2001). "Arginin: nedostatek glycinaminidinotransferázy: třetí vrozená chyba metabolismu kreatinu u lidí". Dopoledne. J. Hum. Genet. 69 (5): 1127–33. doi:10.1086/323765. PMC 1274356. PMID 11555793.
- ^ Carducci C, Birarelli M, Leuzzi V, Carducci C, Battini R, Cioni G, Antonozzi I (říjen 2002). „Hodnocení guanidinoacetátu a kreatinu plus kreatininu ve fyziologických tekutinách: účinný diagnostický nástroj pro biochemickou diagnostiku argininu: nedostatky glycinaminidinotransferázy a guanidinoacetátu methyltransferázy“. Clin. Chem. 48 (10): 1772–8. PMID 12324495.
- ^ Cullen ME, Yuen AH, Felkin LE, Smolenski RT, Hall JL, Grindle S, Miller LW, Birks EJ, Yacoub MH, Barton PJ (červenec 2006). „Exprese genu arginin: glycinaminidinotransferáza v myokardu je při srdečním selhání zvýšena a po zotavení normalizována: potenciální důsledky pro místní syntézu kreatinu“. Oběh. 114 (1 příloha): I16–20. doi:10.1161 / CIRCULATIONAHA.105.000448. PMID 16820567.
