Ochrana skupiny - Protecting group

A chránící skupina nebo ochranná skupina je zaveden do molekuly chemickou modifikací a funkční skupina získat chemoselektivita v následné chemické reakci. Hraje důležitou roli v vícestupňová organická syntéza.[1]
V mnoha přípravách choulostivých organických sloučenin nemohou některé specifické části jejich molekul přežít požadovaná činidla nebo chemické prostředí. Pak tyto části nebo skupiny musí být chráněný. Například, lithiumaluminiumhydrid je vysoce reaktivní, ale užitečné činidlo schopné redukce estery na alkoholy. Vždy bude reagovat s karbonyl skupiny, a to nelze žádným způsobem odradit. Je-li požadována redukce esteru v přítomnosti karbonylu, je třeba zabránit útoku hydridu na karbonylovou skupinu. Například karbonyl se převede na acetal, který nereaguje s hydridy. Acetal se pak nazývá a chránící skupina pro karbonyl. Po dokončení kroku zahrnujícího hydrid se acetal odstraní (reakcí s vodnou kyselinou), čímž se získá původní karbonyl. Tento krok se nazývá deprotekce.
Ochranné skupiny se běžně používají v laboratorních pracích a počátečním vývoji v malém měřítku než v průmyslových výrobních procesech, protože jejich použití přidává procesu další náklady a náklady na materiál. Dostupnost levného chirálního stavebního bloku však může tyto dodatečné náklady překonat (např. kyselina shikimová pro oseltamivir ).
Běžné chránící skupiny
Skupiny chránící alkohol
Ochrana alkoholy:
 Ochrana alkoholu jako tetrahydropyranyletheru s následnou deprotekcí. Oba kroky vyžadují kyselé katalyzátory.
Ochrana alkoholu jako tetrahydropyranyletheru s následnou deprotekcí. Oba kroky vyžadují kyselé katalyzátory.
- Acetyl (Ac) - odstraněno kyselinou nebo zásadou (viz Acetoxyskupina ).
- Benzoyl (Bz) - Odstraněno kyselinou nebo zásadou, stabilnější než skupina Ac.
- Benzyl (Bn) - Odstraněno uživatelem hydrogenolýza. Skupina Bn je široce používána v chemii cukru a nukleosidů.
- β-methoxyethoxymethylether (MEM) - Odstraněno kyselinou.
- Dimethoxytrityl, [bis- (4-methoxyfenyl) fenylmethyl] (DMT) - odstraněno slabou kyselinou. Skupina DMT je široce používána pro ochranu 5'-hydroxyskupiny v nukleosidech, zejména v syntéza oligonukleotidů.
- Methoxymethylether (MOM) - Odstraněno kyselinou.
- Methoxytrityl [(4-methoxyfenyl) difenylmethyl] (MMT) - odstraněn kyselinou a hydrogenolýzou.
- p-Methoxybenzylether (PMB) - Odstraněno kyselinou, hydrogenolýzou nebo oxidací.
- p-Methoxyfenylether (PMP) - odstraněn oxidací.
- Methylthiomethylether - Odstraněno kyselinou.
- Pivaloyl (Piv) - Odstraněno kyselinou, zásadou nebo redukčním činidlem. Je podstatně stabilnější než jiné chránící skupiny acylu.
- Tetrahydropyranyl (THP) - Odstraněno kyselinou.
- Tetrahydrofuran (THF) - Odstraněno kyselinou.
- Trityl (trifenylmethyl, Tr) - odstraněno kyselinou a hydrogenolýzou.
- Silylether (mezi nejoblíbenější patří trimethylsilyl (TMS), tert-butyldimethylsilyl (TBDMS), tri-iso-propylsilyloxymethyl (TOM) a triisopropylsilyl (TIPS) ethery) - odstraněno kyselinou nebo fluorid ion. (jako NaF, TBAF (tetra-n-butylamoniumfluorid, HF-Py nebo HF-NEt3)). Skupiny TBDMS a TOM se používají k ochraně 2'-hydroxylové funkce v nukleosidech, zejména v syntéza oligonukleotidů.
- Methylethery - Štěpení probíhá pomocí TMSI v dichlormethanu nebo acetonitrilu nebo chloroformu. Alternativní metodou štěpení methyletherů je BBr3 v DCM
- Ethoxyethyl ethery (EE) - Štěpení je triviálnější než jednoduché ethery, např. 1N kyselina chlorovodíková[2]
Skupiny chránící amin
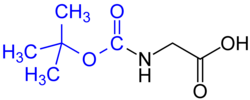
Ochrana aminy:
- Karbobenzyloxy Skupina (Cbz) - Odstraněno uživatelem hydrogenolýza
- p-Methoxybenzylkarbonyl Skupina (Moz nebo MeOZ) - Odstraněno uživatelem hydrogenolýza, labilnější než Cbz
- tert-Butyloxykarbonyl (BOC) skupina (běžná v syntéza peptidů na pevné fázi ) - Odstraněno koncentrovanou silnou kyselinou (jako je HCl nebo CF)3COOH) nebo zahřátím na> 80 ° C.
- 9-fluorenylmethyloxykarbonyl (Fmoc ) skupina (běžná v syntéza peptidů na pevné fázi ) - Odebráno základnou, například piperidin
- Acetyl (Střídavý proud) skupina je běžná v syntéza oligonukleotidů pro ochranu N4 v cytosin a N6 v adenin nukleové báze a odstraní se působením báze, nejčastěji vodné nebo plynné amoniak nebo methylamin. Ac je příliš stabilní na to, aby se snadno odstranil z alifatických amidů.
- Benzoyl (B z) skupina je běžná v syntéza oligonukleotidů pro ochranu N4 v cytosin a N6 v adenin nukleové báze a odstraní se působením báze, nejčastěji vodným nebo plynným amoniakem nebo methylaminem. Bz je příliš stabilní na to, aby se snadno odstranil z alifatických amidů.
- Benzyl (Bn) group - Removed by hydrogenolýza
- Karbamát skupina - Odstraněno kyselinou a mírným zahříváním.
- p-Methoxybenzyl (PMB) - Odstraněno uživatelem hydrogenolýza, labilnější než benzyl
- 3,4-dimethoxybenzyl (DMPM) - Odstraněno uživatelem hydrogenolýza, labilnější než p-methoxybenzyl
- p-Methoxyfenyl (PMP) group - Removed by amonný dusičnan ceričitý (UMĚT)
- Tosyl (Ts) skupina - odstraněna koncentrovanou kyselinou (HBr, H2TAK4) & silná redukční činidla (sodík v kapalině amoniak nebo naftalenid sodný )
- Troc Skupina (trichlorethylchlorformiát) - odstraněna inzercí Zn v přítomnosti kyseliny octové
- Ostatní sulfonamidy (Nosyl & Nps) groups - Removed by samarium jodide, tributylcín hydrid[3]
Karbonylové chránící skupiny
Ochrana karbonyl skupiny:
- Acetaly a Ketaly - Odstraněno kyselinou. Obvykle je štěpení acyklických acetalů snadnější než u cyklických acetalů.
- Acylals - Odstraněno uživatelem Lewisovy kyseliny.
- Dithianes - Odstraněno kovovými solemi nebo oxidačními činidly.
Skupiny chránící karboxylovou kyselinu
Ochrana karboxylové kyseliny:
- Methyl estery - Odstraněno kyselinou nebo zásadou.
- Benzyl estery - odstraněny hydrogenolýzou.
- tert-Butyl estery - odstraněny kyselinou, zásadou a některými redukčními činidly.
- Estery 2,6-disubstituovaných fenolů (např. 2,6-dimethylfenol, 2,6-diisopropylfenol, 2,6-di-tert-butylfenol ) - Odstraněno při pokojové teplotě do DBU -katalyzovaná methanolýza za podmínek vysokého tlaku.[4]
- Silyl estery - odstraněny kyselinou, zásadou a organokovový činidla.
- Orthoestery - Odstraní se slabou vodnou kyselinou za vzniku esteru, který se odstraní podle vlastností esteru.
- Oxazolin - Odstraněno silnou horkou kyselinou (pH <1, T> 100 ° C) nebo zásadou (pH> 12, T> 100 ° C), ale ne např. LiAlH4, organolithná činidla nebo Grignardova (organohořečnatá) činidla
Skupiny chránící fosfáty
- 2-kyanoethyl - odstraněn mírným základem. Tato skupina je široce používána v syntéza oligonukleotidů.
- Methyl (Mě) - odstraněny silnými nukleofily e.c.. thiofenol / ČAJ.
Koncové skupiny chránící alkyn
- Propargyl alkoholy v Favorskii reakce,
- Silylové skupiny, zejména při ochraně acetylén sám.[5]
jiný
Ortogonální ochrana

Ortogonální ochrana je strategie umožňující specifickou deprotekci jedné ochranné skupiny ve vícenásobně chráněné struktuře bez ovlivnění ostatních. Například aminokyselina tyrosin může být chráněn jako benzylester na karboxylové skupině, fluorenylmethylenoxykarbamát na aminové skupině a tert-butylether na fenolové skupině. Benzylester lze odstranit hydrogenolýzou, fluorenylmethylenoxyskupinu (Fmoc) zásadami (jako je piperidin) a fenol tert-butylether štěpený kyselinami (např. kyselinou trifluoroctovou).
Běžným příkladem pro tuto aplikaci je velmi důležitá syntéza peptidů Fmoc, při které se peptidy pěstují v roztoku a na pevné fázi.[6] Ochranné skupiny v syntéza na pevné fázi s ohledem na reakční podmínky, jako je reakční doba, teplota a činidla, mohou být standardizovány tak, že jsou prováděny strojem, přičemž lze dosáhnout výtěžku mnohem přes 99%. Jinak je oddělení výsledné směsi reakčních produktů prakticky nemožné.[7]
Tato technika byla zavedena v oblasti syntéza peptidů podle Robert Bruce Merrifield v roce 1977.[8] Jako ověření konceptu ortogonální deprotekce je prokázána v a fotochemické transesterifikace podle trimethylsilyldiazomethan s využitím kinetický izotopový efekt:[9]
Z tohoto důvodu kvantový výnos pro odstranění chránící skupiny na pravé straně je esterová skupina snížena a zůstává nedotčena. Významně se získá druhý monoaren umístěním atomů deuteria vedle esterové skupiny na levé straně nebo změnou vlnové délky na 254 nm.
Kritika
Používání ochranných skupin je všudypřítomné, ale ne bez kritiky.[10] V praxi jejich použití přidává k syntéze dva kroky (ochranná deprotekční sekvence), z nichž jeden nebo oba mohou dramaticky snížit chemický výtěžek. Rozhodující je, že přidaná složitost brání použití syntetické totální syntézy v objev drog. V porovnání biomimetická syntéza nezaměstnává ochranné skupiny. Jako alternativu představil Baran novou syntézu sloučeniny hapalindolu U bez volných ochranných skupin. Dříve publikovaná syntéza[11][12][13] podle Barana obsahoval 20 kroků s více manipulacemi s ochrannou skupinou (dva potvrzeny):
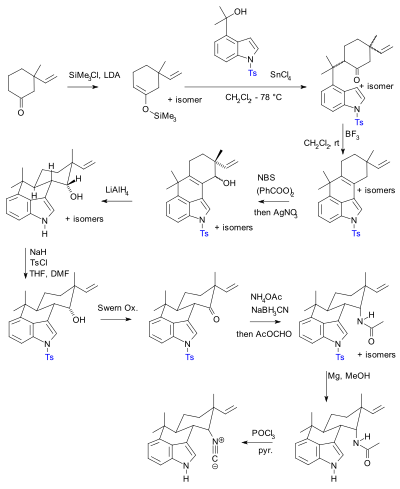 Syntéza Hideaki Muratake z roku 1990 pomocí Tosyl chránící skupiny (zobrazené modře). | 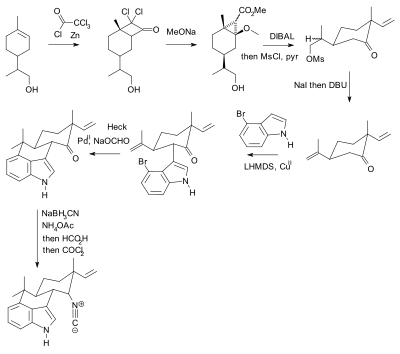 Phil Baran syntéza bez ochranných skupin, hlášená v roce 2007. |
Průmyslové aplikace
Ačkoli použití chránících skupin není v průmyslových syntézách výhodné, stále se používají v průmyslových kontextech, např .:
- Oseltamivir (Tamiflu, antivirotikum) syntéza pomocí Roche
- Sukralóza (sladidlo)
Reference
- ^ Theodora W. Greene, Peter G. M. Wuts (1999). Ochrana skupin v organické syntéze (3. vyd.). J. Wiley. ISBN 978-0-471-16019-9.CS1 maint: používá parametr autoři (odkaz)
- ^ Kamaya, Yasushi; T Higuchi (2006). „Metabolismus 3,4-dimethoxycinamylalkoholu a jeho derivátů Coriolus versicolor“. Mikrobiologické dopisy FEMS. 24 (2–3): 225–229. doi:10.1111 / j.1574-6968.1984.tb01309.x.
- ^ Moussa, Ziad; D. Romo (2006). „Mírná deprotekce primárních N- (p-toluensufonyl) amidů pomocí SmI2 následující trifluoracetylace ". Synlett. 2006 (19): 3294–3298. doi:10.1055 / s-2006-951530.
- ^ Romanski, J .; Nowak, P .; Kosinski, K .; Jurczak, J. (září 2012). "Vysokotlaká transesterifikace stericky bráněných esterů". Tetrahedron Lett. 53 (39): 5287–5289. doi:10.1016 / j.tetlet.2012.07.094.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2000). Organická chemie. Oxford University Press. str.1291. ISBN 978-0198503460.
- ^ Chan, Weng C .; White, Peter D. (2004). Syntéza peptidů Fmoc na pevné fázi. Oxford University Press. ISBN 978-0-19-963724-9.
- ^ Weng C. Chan, Peter D. White: Syntéza peptidů Fmoc na pevné fázi, S. 10–12.
- ^ Merrifield, R. B .; Barany, G .; Cosand, W. L .; Engelhard, M .; Mojsov, S. (1977). „Proceedings of the 5th American Peptide Symposium“. Biochemické vzdělávání. 7 (4): 93–94. doi:10.1016/0307-4412(79)90078-5.
- ^ Blanc, Aurélien; Bochet, Christian G. (2007). „Izotopové efekty ve fotochemii: aplikace na chromatickou ortogonalitu“ (PDF). Org. Lett. 9 (14): 2649–2651. doi:10.1021 / ol070820h. PMID 17555322.
- ^ Baran, Phil S .; Maimone, Thomas J .; Richter, Jeremy M. (22. března 2007). "Celková syntéza mořských přírodních produktů bez použití ochranných skupin". Příroda. 446 (7134): 404–408. Bibcode:2007 Natur.446..404B. doi:10.1038 / nature05569. PMID 17377577.
- ^ Syntetické studie mořských alkaloidů hapalindolů. Část I Celková syntéza (±) -hapalindolů J a M Čtyřstěn, Svazek 46, vydání 18, 1990, Strany 6331–6342 Hideaki Muratake a Mitsutaka Natsume doi:10.1016 / S0040-4020 (01) 96005-3
- ^ Syntetické studie mořských alkaloidů hapalindolů. Část 2. Lithiumaluminiumhydridová redukce elektronově bohaté dvojné vazby uhlík-uhlík konjugované s indolovým jádrem Čtyřstěn, Svazek 46, vydání 18, 1990, Strany 6343–6350 Hideaki Muratake a Mitsutaka Natsume doi:10.1016 / S0040-4020 (01) 96006-5
- ^ Syntetické studie mořských alkaloidů hapalindolů. Část 3 Celková syntéza (±) -hapalindolů H a U Čtyřstěn, Svazek 46, vydání 18, 1990, Strany 6351–6360 Hideaki Muratake, Harumi Kumagami a Mitsutaka Natsume doi:10.1016 / S0040-4020 (01) 96007-7
externí odkazy
- Zavedení ochranné skupiny a mechanismu deprotekce
- Poznámky k vysokoškolskému studiu na toto téma od profesora Rizza.
- Další sada studijních poznámek ve výukové formě s pokyny a komentáři od Prof. Grossman a Cammers.
- Recenze Prof. Kocienski.
- Uživatelská stránka s výňatkem z klasického textu Greene a Wuts týkající se stability několika klíčových skupin z rozsáhlých tabulek tohoto odkazu.
- Ochrana skupiny ze stránky organ-reaction.com


