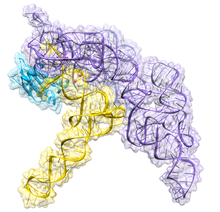
Ribonukleáza P - Ribonuclease P
| Bakteriální RNáza P třída A | |
|---|---|
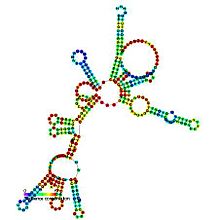 Předpovězeno sekundární struktura a zachování sekvence z RNaseP_bact_a | |
| Identifikátory | |
| Symbol | RNaseP_bact_a |
| Rfam | RF00010 |
| Další údaje | |
| RNA typ | Gen; ribozym |
| Domény | Bakterie |
| JÍT | GO termín musí začínat GO: GO termín musí začínat GO: GO termín musí začínat GO: |
| TAK | SO: 0000386 |
| PDB struktur | PDBe |
| Bakteriální RNáza P třída B | |
|---|---|
 Předpovězeno sekundární struktura a zachování sekvence z RNaseP_bact_b | |
| Identifikátory | |
| Symbol | RNaseP_bact_b |
| Rfam | RF00011 |
| Další údaje | |
| RNA typ | Gen; ribozym |
| Domény | Bakterie |
| JÍT | GO termín musí začínat GO: GO termín musí začínat GO: GO termín musí začínat GO: |
| TAK | SO: 0000386 |
| PDB struktur | PDBe |
| Archaeal RNase P | |
|---|---|
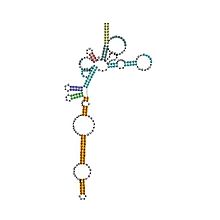 Předpovězeno sekundární struktura a zachování sekvence archaeal RNase P | |
| Identifikátory | |
| Symbol | RNaseP_arch |
| Rfam | RF00373 |
| Další údaje | |
| RNA typ | Gen; ribozym |
| Domény | Archaea |
| JÍT | GO termín musí začínat GO: GO termín musí začínat GO: GO termín musí začínat GO: |
| TAK | SO: 0000386 |
| PDB struktur | PDBe |
| Archaeal RNase P třída T | |
|---|---|
| Identifikátory | |
| Symbol | RNaseP-T |
| Rfam | RF02357 |
| Další údaje | |
| RNA typ | Gen; ribozym |
| Domény | Archaea |
| JÍT | GO termín musí začínat GO: GO termín musí začínat GO: GO termín musí začínat GO: |
| TAK | SO: 0000386 |
| PDB struktur | PDBe |
Ribonukleáza P (ES 3.1.26.5, RNáza P) je typ ribonukleáza který štěpí RNA. RNáza P je od ostatních RNáz jedinečná v tom, že se jedná o a ribozym - ribonukleová kyselina, která působí jako katalyzátor stejným způsobem jako a protein enzym na bázi. Jeho funkcí je odštěpení další nebo prekurzorové sekvence RNA tRNA molekuly.[1] Dále je RNáza P jedním ze dvou známých vícerozměrových ribozymů v přírodě (druhým je ribozom ), jehož objev získal Sidney Altman a Thomas Čech the Nobelova cena za chemii v roce 1989: v 70. letech Altman objevil existenci prekurzorové tRNA s přilehlými sekvencemi a jako první charakterizoval RNázu P a její aktivitu při zpracování 5 'vedoucí sekvence prekurzorové tRNA. Nedávná zjištění také ukazují, že RNáza P má novou funkci.[2] Ukázalo se, že lidská jaderná RNáza P je nutná pro normální a efektivní transkripci různých malé nekódující RNA, jako je tRNA, 5S rRNA, SRP RNA a U6 snRNA geny,[3] které jsou přepisovány RNA polymeráza III, jedna ze tří hlavních nukleárních RNA polymeráz v lidských buňkách.
V bakteriích
Bakteriální RNáza P má dvě složky: řetězec RNA nazývaný M1 RNA a polypeptidový řetězec nebo protein nazývaný protein C5.[4][5] In vivo, obě složky jsou nezbytné pro správnou funkci ribozymu, ale in vitro může M1 RNA působit samostatně jako katalyzátor.[1] Primární rolí proteinu C5 je zvýšit vazebnou afinitu k substrátu a katalytickou rychlost enzymu M1 RNA pravděpodobně zvýšením afinity kovových iontů v aktivním místě. Krystalová struktura bakteriálního holoenzymu RNázy P s tRNA byla nedávno vyřešena, což ukazuje, jak velké, koaxiálně naskládané spirálovité domény RNázy P RNA zapojují do tvarově selektivního rozpoznávání cíle pre-tRNA. Tato krystalová struktura potvrzuje dřívější modely rozpoznávání a katalýzy substrátu, identifikuje umístění aktivního místa a ukazuje, jak proteinová složka zvyšuje funkčnost RNázy P.[6][7]
Bakteriální RNáza P třídy A a B
Ribonukleáza P (RNáza P) je všudypřítomná endoribonukleáza, která se nachází v archaeách, bakteriích a eukaryích, stejně jako v chloroplastech a mitochondriích. Jeho nejlépe charakterizovanou aktivitou je tvorba zralých 5'-konců tRNA štěpením 5'-vedoucích prvků prekurzorových tRNA. Buněčné RNasy Ps jsou ribonukleoproteiny (RNP). RNA z bakteriální RNasy Ps si zachovává svou katalytickou aktivitu v nepřítomnosti proteinové podjednotky, tj. Je to ribozym. Ukázalo se, že izolovaná eukaryotická a archaální RNáza P RNA si nezachovává svou katalytickou funkci, ale je stále nezbytná pro katalytickou aktivitu holoenzymu. Ačkoli archeaální a eukaryotické holoenzymy mají mnohem větší obsah bílkovin než eubakteriální, RNA jádra ze všech tří linií jsou homologní - helixy odpovídající P1, P2, P3, P4 a P10 / 11 jsou společné pro všechny buněčné RNasy P RNA. Přesto existuje značná variabilita sekvencí, zejména mezi eukaryotickými RNA.
V Archaei
v archaea, RNáza P ribonukleoproteiny sestávají ze 4 až 5 proteinových podjednotek, které jsou asociovány s RNA. Jak odhalil in vitro rekonstituční experimenty jsou tyto proteinové podjednotky individuálně postradatelné pro zpracování tRNA, které je v podstatě zprostředkováno RNA složkou.[8][9][10] Struktury proteinových podjednotek archaální RNázy P byly vyřešeny rentgen krystalografie a NMR, čímž se odhalují nové proteinové domény a skládání základů pro funkci.
Použitím komparativní genomiky a vylepšených výpočetních metod byla ve všech úplných genomech crenarcheální fylogenetické rodiny Thermoproteaceae, včetně druhů v rodech Pyrobaculum, Caldivirga a Vulcanisaeta, nalezena radikálně minimalizovaná forma RNA RNasy P, nazývaná „typ T“.[11] Všechny si zachovávají konvenční katalytickou doménu, ale chybí jim rozpoznatelná doména specificity. Experimentálně byla potvrzena aktivita zpracování 5 'tRNA samotné RNA. Pyrobaculum a Caldivirga RNase P RNA jsou nejmenší přirozeně se vyskytující formou, o které bylo dosud zjištěno, že funguje jako trans-působící ribozymy.[11] Ztráta domény specificity v těchto RNA naznačuje potenciálně změněnou specificitu substrátu.
Nedávno se tvrdilo, že archaebacteriium Nanoarchaeum equitans nemá RNázu P. Výpočtové a experimentální studie nenalezly důkazy o její existenci. V tomto organismu je promotor tRNA blízký genu tRNA a předpokládá se, že transkripce začíná na první bázi tRNA, čímž se odstraňuje požadavek na RNázu P.[12]
U eukaryot
v eukaryoty, jako jsou lidé a droždí, většina RNázy P sestává z řetězce RNA, který je strukturálně podobný řetězci nalezenému v bakteriích [13] stejně jako devět až deset asociovaných proteinů (na rozdíl od jediného bakteriálního proteinu RNázy P, C5).[2][14] Pět z těchto proteinových podjednotek vykazuje homologii s archaálními protějšky. Tyto proteinové podjednotky RNázy P jsou sdíleny s RNáza MRP,[14][15][16] katalytický ribonukleoprotein podílející se na zpracování ribozomální RNA v jádro.[17] RNáza P z eukaryot byla teprve nedávno prokázána jako ribozym.[18] Četné proteinové podjednotky eukaryální RNázy P mají tedy malý příspěvek ke zpracování tRNA jako takové,[19] zatímco se jeví jako nezbytné pro funkci RNázy P a RNázy MRP v jiných biologických podmínkách, jako je genová transkripce a buněčný cyklus.[3][20] Přes bakteriální původ mitochondrií a chloroplastů se nezdá, že by plastidy z vyšších zvířat a rostlin obsahovaly RNázu P. založenou na RNA. Ukázalo se, že lidská mitochondriální RNáza P je protein a neobsahuje RNA.[21] Špenát chloroplast Bylo také prokázáno, že RNáza P funguje bez RNA podjednotky.[22]
| Podjednotka | Funkce / interakce (při zpracování tRNA) |
|---|---|
| RPP14 | Vazba RNA |
| RPP20 | ATPáza, helikáza / Hsp27, SMN, Rpp25 |
| RPP21 | Vazba RNA, aktivita g / Rpp29 |
| RPP25 | RNA vázání / Rpp20 |
| RPP29 | vazba tRNA, aktivita / Rpp21 |
| RPP30 | Vazba RNA, aktivita / Pop5 |
| RPP38 | Vazba RNA, aktivita |
| RPP40 | |
| hPop1 | |
| hPop5 | Vazba RNA, aktivita / Rpp30 |
| H1 RNA | Aktivita / Rpp21, Rpp29, Rpp30, Rpp38 |
Terapie pomocí RNázy P
RNáza P je nyní studována jako potenciální léčba onemocnění, jako je virus herpes simplex,[23] cytomegalovirus,[23][24] chřipka a další infekce dýchacích cest,[25] HIV-1[26] a rakovina způsobená fúzním genem BCR-ABL.[23][27] Externí vodicí sekvence (EGS) jsou vytvořeny pomocí doplňkovost na virovou nebo onkogenní mRNA a struktury, které napodobují T smyčku a akceptorový kmen tRNA.[25] Tyto struktury umožňují RNase P rozpoznat EGS a štěpit cílovou mRNA. Ukázalo se, že terapie EGS jsou účinné v kultuře a u živých myší.[28]
Reference
- ^ A b Guerrier-Takada C, Gardiner K, Marsh T, Pace N, Altman S (1983). „RNA část ribonukleázy P je katalytickou podjednotkou enzymu“. Buňka. 35 (3 Pt 2): 849–57. doi:10.1016/0092-8674(83)90117-4. PMID 6197186.
- ^ A b C Jarrous N, Reiner R (2007). „Lidská RNáza P: enzym zpracovávající tRNA a transkripční faktor“. Nucleic Acids Res. 35 (11): 3519–24. doi:10.1093 / nar / gkm071. PMC 1920233. PMID 17483522.
- ^ A b Reiner R, Ben-Asouli Y, Krilovetzky I, Jarrous N (2006). „Role pro katalytický ribonukleoprotein RNázu P v transkripci RNA polymerázy III“. Genes Dev. 20 (12): 1621–35. doi:10,1101 / gad.386706. PMC 1482482. PMID 16778078.
- ^ Evans D, Marquez SM, Pace NR (2006). "RNáza P: rozhraní světů RNA a proteinů". Trends Biochem. Sci. 31 (6): 333–41. doi:10.1016 / j.tibs.2006.04.007. PMID 16679018.
- ^ Tsai HY, Masquida B, Biswas R, Westhof E, Gopalan V (2003). „Molekulární modelování trojrozměrné struktury bakteriálního holoenzymu RNázy P“ (PDF). J. Mol. Biol. 325 (4): 661–75. doi:10.1016 / S0022-2836 (02) 01267-6. PMID 12507471.
- ^ Reiter N, Osterman A, Torres-Larios A, Swinger KK, Pan T, Mondragon A, Nicholas J .; Osterman, Amy; Torres-Larios, Alfredo; Swinger, Kerren K .; Pan, Tao; Mondragón, Alfonso (2010). "Struktura bakteriálního ribonukleázy P holoenzymu v komplexu s tRNA". Příroda. 468 (7325): 784–789. Bibcode:2010Natur.468..784R. doi:10.1038 / nature09516. PMC 3058908. PMID 21076397.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Masquida B, Westhof E, B .; Westhof, E. (2011). „RNase P: Nakonec klíč najde svůj zámek“. RNA. 17 (9): 1615–1618. doi:10,1261 / rna.2841511. PMC 3162327. PMID 21803972.
- ^ Hall TA, Brown JW (2002). „Archaeal RNase P má několik proteinových podjednotek homologních s eukaryotickými nukleárními proteiny RNase P“. RNA. 8 (3): 296–306. doi:10.1017 / S1355838202028492. PMC 1370252. PMID 12003490.
- ^ Fukuhara H, Kifusa M, Watanabe M, Terada A, Honda T, Numata T, Kakuta Y, Kimura M (2006). „Pátá proteinová podjednotka Ph1496p zvyšuje optimální teplotu pro aktivitu ribonukleázy P z Pyrococcus horikoshii OT3.“ Biochem. Biophys. Res. Commun. 343 (3): 956–64. doi:10.1016 / j.bbrc.2006.02.192. PMID 16574071.
- ^ Tsai HY, Pulukkunat DK, Woznick WK, Gopalan V (2006). "Funkční rekonstituce a charakterizace Pyrococcus furiosus RNase P". Proc. Natl. Acad. Sci. USA. 103 (44): 16147–52. Bibcode:2006PNAS..10316147T. doi:10.1073 / pnas.0608000103. PMC 1637551. PMID 17053064.
- ^ A b Lai LB, Chan PP, Cozen AE a kol. (Prosinec 2010). „Objev minimální formy RNasy P v Pyrobaculu“. Proc. Natl. Acad. Sci. USA. 107 (52): 22493–8. Bibcode:2010PNAS..10722493L. doi:10.1073 / pnas.1013969107. PMC 3012483. PMID 21135215.
- ^ Randau L, Schröder I, Söll D (květen 2008). "Život bez RNázy P". Příroda. 453 (7191): 120–3. Bibcode:2008 Natur.453..120R. doi:10.1038 / nature06833. PMID 18451863.
- ^ Marquez SM, Chen JL, Evans D, Pace NR (2006). "Struktura a funkce eukaryotické ribonukleázy P RNA". Mol. Buňka. 24 (3): 445–56. doi:10.1016 / j.molcel.2006.09.011. PMC 1716732. PMID 17081993.
- ^ A b Chamberlain JR, Lee Y, Lane WS, Engelke DR (1998). „Purifikace a charakterizace komplexu holoenzymu nukleární RNázy P odhaluje rozsáhlé překrývání podjednotek s RNázou MRP“. Genes Dev. 12 (11): 1678–90. doi:10.1101 / gad.12.11.1678. PMC 316871. PMID 9620854.
- ^ Salinas K, Wierzbicki S, Zhou L, Schmitt ME (2005). „Charakterizace a čištění Saccharomyces cerevisiae RNase MRP odhaluje novou jedinečnou proteinovou složku“. J. Biol. Chem. 280 (12): 11352–60. doi:10,1074 / jbc.M409568200. PMID 15637077.
- ^ Welting TJ, Kikkert BJ, van Venrooij WJ, Pruijn GJ (2006). „Diferenciální asociace proteinových podjednotek s komplexy lidské RNázy MRP a RNázy P“. RNA. 12 (7): 1373–82. doi:10,1261 / rna.2293906. PMC 1484433. PMID 16723659.
- ^ Clayton DA (2001). "Velký vývoj pro malou RNA". Příroda. 410 (6824): 29–31. doi:10.1038/35065191. PMID 11242026.
- ^ Kikovska E, Svärd SG, Kirsebom LA (2007). „Eukaryotická RNáza P RNA zprostředkovává štěpení v nepřítomnosti proteinu“. Proc. Natl. Acad. Sci. USA. 104 (7): 2062–7. doi:10.1073 / pnas.0607326104. PMC 1892975. PMID 17284611.
- ^ Willkomm DK, Hartmann RK (2007). "Důležitý kus skládačky RNase P vyřešen". Trends Biochem. Sci. 32 (6): 247–50. doi:10.1016 / j.tibs.2007.04.005. PMID 17485211.
- ^ Gill T, Cai T, Aulds J, Wierzbicki S, Schmitt ME (2004). „RNáza MRP štěpí mRNA CLB2 za účelem podpory progrese buněčného cyklu: nová metoda degradace mRNA“. Mol. Buňka. Biol. 24 (3): 945–53. doi:10.1128 / MCB.24.3.945-953.2004. PMC 321458. PMID 14729943.
- ^ J. Holzmann; P. Frank; E. Löffler; K. Bennett; C. Gerner; W. Rossmanith (2008). "RNáza P bez RNA: Identifikace a funkční rekonstituce lidského mitochondriálního tRNA zpracovávajícího enzymu". Buňka. 135 (3): 462–474. doi:10.1016 / j.cell.2008.09.013. PMID 18984158.
- ^ B. C. Thomas; X. Li; P. Gegenheimer (2000). „Chloroplastová ribonukleáza P nevyužívá mechanismus štěpení pre-tRNA typu ribozymu“. RNA. 6 (4): 545–553. doi:10.1017 / S1355838200991465. PMC 1369935. PMID 10786845.
- ^ A b C Trang, P; Kim, K; Liu, F (6. června 2004). "Vývoj ribozymů RNázy P pro genové cílení a antivirovou terapii". Buněčná mikrobiologie. 6 (6): 499–508. doi:10.1111 / j.1462-5822.2004.00398.x. PMID 15104592.
- ^ Trang, P; Kilani, A; Lee, J; Hsu, A; Liou, K; Kim, J; Nassi, A; Kim, K; Liu, F (25. srpna 2002). „Ribozymy RNázy P pro studium a léčbu lidských cytomegalovirových infekcí“. J Clin Virol. S2: S63–74. doi:10.1016 / s1386-6532 (02) 00097-5. PMID 12361758.
- ^ A b Dreyfus, David H .; Tompkins, S. Mark; Fuleihan, Ramsay; Ghoda, Lucy Y (2007). „Ztlumení genů při léčbě chřipky a jiných respiračních onemocnění: Cílení na RNázu P pomocí externích sekvencí průvodce (EGS)“. Biologics: Targets and Therapy. 1 (4): 425–32. PMC 2721295. PMID 19707312.
- ^ Zeng, WB; Chen, YC; Bai, Y; Trang, P; Vu, GP; Lu, SW; Wu, JG; Liu, FY (26. prosince 2012). „Účinná inhibice replikace viru lidské imunodeficience 1 inženýr RNáza P ribozym“. PLOS ONE. 7 (12): e51855. Bibcode:2012PLoSO ... 751855Z. doi:10.1371 / journal.pone.0051855. PMC 3530568. PMID 23300569.
- ^ Cobaleda, C; Sanchez-Garcia, I (2000). „In vivo inhibice místně specifickou katalytickou RNA podjednotkou RNázy P navržené proti BCR-ABL onkogenním produktům: nový přístup k léčbě rakoviny“. Krev. 95 (3): 731–7. doi:10,1182 / krev. V95.3.731.003k28_731_737. PMID 10648380.
- ^ Sawyer, AJ; Wesolowski, D; Gandotra, N; Stojadinovic, A; Izadjoo, M; Altman, S; Kyriakides, TR (2013). „Konjugát peptid-morfolino-oligomer zaměřený na mRNA genu staphylococcus aureus zlepšuje hojení v modelu kožní rány infikované myši“. Int. J. Pharm. 453 (2): 651–655. doi:10.1016 / j.ijpharm.2013.05.041. PMC 3756894. PMID 23727592.
Další čtení
- Nobelova přednáška Sidneyho Altmana, Nobelova cena za chemii 1989
- Frank, DN; Pace NR (1998). „Ribonukleáza P: jednota a rozmanitost v ribozymu zpracovávajícím tRNA“. Annu Rev Biochem. 67: 153–180. doi:10.1146 / annurev.biochem.67.1.153. PMID 9759486.
- Brown, JW (1999). „Databáze ribonukleázy P“. Nucleic Acids Res. 27 (1): 314–. doi:10.1093 / nar / 27.1.314. PMC 148169. PMID 9847214.CS1 maint: extra interpunkce (odkaz)
externí odkazy
- Databáze RNase P na ncsu.edu
- Stránka pro nukleární RNázu P na Rfam
- Stránka pro Archaeal RNase P na Rfam
- Stránka pro bakteriální RNázu P třídy A. na Rfam
- Stránka pro bakteriální RNázu P třídy B. na Rfam
- RNase + P v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- ES 3.1.26.5