Plicní alveolární proteinóza - Pulmonary alveolar proteinosis - Wikipedia
| Plicní alveolární proteinóza | |
|---|---|
| Ostatní jména | alveolární proteinóza |
 | |
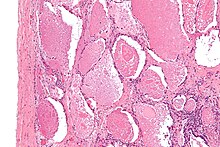
| Mikrograf plicní alveolární proteinózy, vykazující charakteristickou náplň vzdušného prostoru s fokálně hustými globusy označovanými jako klábosení nebo hustá těla. H&E skvrna. | |
| Specialita | Pulmonologie |
Plicní alveolární proteinóza (PAP) je vzácná plicní porucha charakterizovaná abnormální akumulací povrchově aktivní látka -odvozené lipoproteinové sloučeniny v rámci alveoly plic. Nahromaděné látky interferují s normálem výměna plynu a expanze plic, což nakonec vede k obtížným dýcháním a náchylnosti k rozvoji plicních infekcí. Příčiny PAP lze rozdělit na primární (autoimunitní PAP, dědičné PAP), sekundární (mnohočetné nemoci) a vrozené (vícečetné nemoci, obvykle genetické) příčiny, ačkoli nejčastější příčinou je primární autoimunitní stav u jedince.
Příznaky a symptomy
Značky a příznaky PAP zahrnují dušnost,[1] A kašel, nízká známka horečka, a ztráta váhy Klinický průběh PAP je nepředvídatelný. Spontánní prominutí je uznáván a někteří pacienti mají stabilní příznaky. Může dojít k úmrtí v důsledku progrese PAP nebo jakéhokoli souvisejícího souvisejícího onemocnění. Jedinci s PAP jsou náchylnější k plicním infekcím, jako je bakteriální pneumonie, infekce mycobacterium avium-intracellulare nebo plísňové infekce.[Citace je zapotřebí ]
Příčiny
Abnormální akumulace lipoproteinových sloučenin v PAP je způsobena zhoršenou regulací a clearance povrchově aktivní látky. To obvykle souvisí se zhoršenou funkcí alveolárních makrofágů.[2] U dospělých je nejčastější příčinou PAP autoimunita vůči faktor stimulující kolonie granulocytů a makrofágů (GM-CSF), kritický faktor ve vývoji alveolárních makrofágů. Snížená biologická dostupnost GM-CSF má za následek špatný vývoj a funkci alveolárních makrofágů, což má za následek akumulaci povrchově aktivní látky a souvisejících produktů.[2]
Sekundárními příčinami PAP jsou ty, u nichž je akumulace lipoproteinových sloučenin sekundární k jinému chorobnému procesu. To bylo rozpoznáno v nastavení určitých rakoviny (jako myeloidní leukémie ), plicní infekce nebo expozice životního prostředí prachu nebo chemikáliím, jako je nikl.[3]
Ačkoli příčina PAP nebyla původně pochopena, zásadní průlom v chápání příčiny nemoci nastal díky náhodnému pozorování, že myši chované pro experimentální studii postrádají hematologické růstový faktor známý jako faktor stimulující kolonie granulocytů a makrofágů (GM-CSF) vyvinul plic syndrom abnormální akumulace povrchově aktivní látky připomínající lidský PAP.[4]
Dopady tohoto zjištění se stále zkoumají, ale v únoru 2007 byl zaznamenán významný pokrok. Výzkumníci v této zprávě diskutovali o přítomnostiGM-CSF autoprotilátky u pacientů s PAP a tento syndrom duplikovali infuzí těchto autoprotilátek do myší.[5]
Familiární nebo sporadické inaktivující mutace v jednom ze dvou rodičů GATA2 geny vyrábí autosomálně dominantní porucha nazývaná Nedostatek GATA2. The GATA2 gen produkuje GATA2 transkripční faktor což je pro embryonální vývoj, údržba a funkčnost tvorba krve, lymfatické formování a další buňky tvořící tkáň. Jednotlivci s jedním GATA2 inaktivující mutace přítomná u celé řady poruch včetně plicní alveolární proteinózy. GATA2 mutace založená na plicní alveolární proteinóze je spojena s normálními hladinami GM-CSF a běžně se u postižených jedinců, kteří úspěšně dostanou transplantace hematopoetických kmenových buněk.[6][7]
Genetika
Dědičná plicní alveolární proteinóza (PAP) je recesivní genetický stav, při kterém se jedinci rodí s genetickými mutacemi, které zhoršují funkci alfa receptoru CSF2 na alveolárních makrofázích. V důsledku toho poselská molekula známá jako faktor stimulující kolonie granulocytů / makrofágů (GM-CSF) není schopna stimulovat alveolární makrofágy k čištění povrchově aktivní látky, což vede k potížím s dýcháním. Gen pro receptor CSF2 alfa se nachází v oblasti 5q31 chromozomu 5 a genový produkt lze také označovat jako receptor faktoru stimulujícího kolonie granulocytových makrofágů.[8][9]
Diagnóza
The diagnóza PAP se vyrábí pomocí kombinace příznaků člověka, zobrazování hrudníku, a mikroskopické hodnocení mytí plic / tkáně. Pro potvrzení jsou užitečné další testy sérových anti-GM-CSF protilátek.[10]
I když jsou příznaky i zobrazovací nálezy stereotypní a dobře popsané, jsou nespecifické a nerozeznatelné od mnoha jiných podmínek. Například, rentgen hrudníku může vykazovat alveolární opacity a CT může vykazovat a šílená dlažba, které jsou častěji pozorovány v mnoha dalších podmínkách.[11] Diagnóza tedy primárně závisí na nálezech patologie.[Citace je zapotřebí ]
Plíce nebo tkáně pro histopatologickou analýzu se nejčastěji získávají pomocí bronchoalveolární laváž a / nebo plicní biopsie.[12] Charakteristické nálezy biopsie ukazují plnění alveol (a někdy terminálních bronchiolů) amorfním eosinofilním materiálem, který se silně pozitivně zbarví PAS skvrna a Barvivo PAS diastázy. Okolní alveoly a plicní intersticium zůstávají relativně normální.[13] Elektronová mikroskopie vzorku, i když se obvykle neprovádí kvůli nepraktičnosti, ukazuje lamelová tělesa představující povrchově aktivní látku.[14] Alternativní diagnóza s podobnou histomorfologická zjištění je Pneumocystis jirovicii zápal plic.[14]
Promývání plic charakteristicky poskytuje tekutinu, která je „mléčného“ složení. Pod mikroskopem vzorky ukazují 20-50 mikrometrů PAS-pozitivních globulí na pozadí jemně zrnitého nebo amorfního PAS-pozitivního materiálu. Typicky existuje nízký počet makrofágů a zánětlivých buněk (i když je to variabilní).[13][14]
Léčba
Standardní léčba PAP je celá plíce výplach[15][16][17] a podpůrná péče.[18][19][20] Výplach celé plíce je postup prováděný v celkové anestezii, při kterém je jedna plíce čerpána kyslíkem (ventilované plíce) a druhá plíce (nevětraná plíce) je naplněna teplým solným roztokem (až do 20 l) a vypuštěna, spolu s tím odstraňte veškerý proteinový odpad.[21] To je obecně účinné při zlepšování symptomů PAP, často po delší dobu. Mezi další léčby, které se stále studují, patří subkutánní a inhalační GM-CSF a rituximab, intravenózní infuze, která zastavuje produkci autoprotilátek odpovědných za autoimunitní PAP.[18][19][20][22] Transplantace plic byla provedena u jedinců s různými formami PAP; toto se však často používá pouze v případě, že selhaly všechny ostatní možnosti léčby a došlo k významnému poškození plic kvůli rizikům, komplikacím nebo opakování PAP po transplantaci.[20][22][23]
Epidemiologie
Toto onemocnění je častější u mužů au tabák kuřáci.[Citace je zapotřebí ]
V nedávné epidemiologické studii z Japonska[24] Autoimunitní PAP má vyšší incidenci a prevalenci, než se dříve uvádělo, a není silně spojena s kouřením, expozicí z povolání nebo jinými nemocemi. lipoidní pneumonie a nespecifické intersticiální pneumonitida byl pozorován před vývojem PAP u dítěte.[25]
Dějiny
PAP byl poprvé popsán v roce 1958[26] lékaři Samuel Rosen, Benjamin Castleman a Averill Liebow.[27] V jejich případě série publikované v New England Journal of Medicine 7. června téhož roku popsali 27 pacientů s patologickými známkami pozitivního materiálu Schiffova pozitivního materiálu na alveoly. Tento lipid bohatý materiál byl následně rozpoznán jako povrchově aktivní látka.[Citace je zapotřebí ]
Hlášenou léčbu PAP pomocí terapeutického bronchoalveolárního výplachu provedl v roce 1960 Dr. Jose Ramirez-Rivera v nemocnici pro správu veteránů v Baltimoru,[28] který popsal opakované „segmentové zaplavení“ jako prostředek fyzického odstranění nahromaděného alveolárního materiálu.[29]
Výzkum
PAP je jedním ze vzácných plicních onemocnění, které v současné době studuje The Rare Lung Diseases Consortium (RLDC). RLDC je součástí Síť klinického výzkumu pro vzácná onemocnění (RDCRN), iniciativa Úřad pro vzácná onemocnění Výzkum (ORDR) Národní centrum pro rozvoj translačních věd (NCATS). RLDC se zaměřuje na vývoj nové diagnostiky a terapie pro pacienty se vzácnými plicními chorobami prostřednictvím spolupráce mezi Národní institut zdraví, pacientské organizace a klinické zkoušející.[Citace je zapotřebí ]
Reference
- ^ Shah PL, Hansell D, Lawson PR, Reid KB, Morgan C (leden 2000). „Plicní alveolární proteinóza: klinické aspekty a současné pojmy patogeneze“. Hrudník. 55 (1): 67–77. doi:10.1136 / hrudník.55.1.67. PMC 1745595. PMID 10607805.
- ^ A b Kumar A, Abdelmalak B, Inoue Y, Culver DA (červenec 2018). „Plicní alveolární proteinóza u dospělých: patofyziologie a klinický přístup“. Lancet. Respirační medicína. 6 (7): 554–565. doi:10.1016 / s2213-2600 (18) 30043-2. PMID 29397349.
- ^ Oller AR, Kirkpatrick DT, Radovsky A, Bates HK (prosinec 2008). „Inhalační studie karcinogenity s práškem niklového kovu u potkanů Wistar“. Toxikologie a aplikovaná farmakologie. 233 (2): 262–75. doi:10.1016 / j.taap.2008.08.017. PMID 18822311.
- ^ Stanley E, Lieschke GJ, Grail D, Metcalf D, Hodgson G, Gall JA a kol. (Červen 1994). „Myši s deficitem faktoru stimulujícího kolonie granulocytů / makrofágů nevykazují žádné závažné narušení hematopoézy, ale vyvinou se charakteristická plicní patologie“. Sborník Národní akademie věd Spojených států amerických. 91 (12): 5592–6. Bibcode:1994PNAS ... 91.5592S. doi:10.1073 / pnas.91.12.5592. PMC 44042. PMID 8202532.
- ^ Uchida K, Beck DC, Yamamoto T, Berclaz PY, Abe S, Staudt MK a kol. (Únor 2007). „Autoprotilátky proti GM-CSF a dysfunkce neutrofilů u plicní alveolární proteinózy“. The New England Journal of Medicine. 356 (6): 567–79. doi:10.1056 / NEJMoa062505. PMID 17287477.
- ^ Crispino JD, Horwitz MS (duben 2017). „Mutace faktoru GATA u hematologické choroby“. Krev. 129 (15): 2103–2110. doi:10.1182 / krev-2016-09-687889. PMC 5391620. PMID 28179280.
- ^ Hirabayashi S, Wlodarski MW, Kozyra E, Niemeyer CM (srpen 2017). „Heterogenita myeloidních novotvarů souvisejících s GATA2“. International Journal of Hematology. 106 (2): 175–182. doi:10.1007 / s12185-017-2285-2. PMID 28643018.
- ^ "Plicní alveolární proteinóza." NORD (Národní organizace pro vzácné poruchy), 16. ledna 2020, rarediseases.org/rare-diseases/pulmonary-alveolar-proteinosis/.
- ^ Whitsett JA, Wert SE, Weaver TE (2015). „Nemoci homeostázy plicních povrchově aktivních látek“. Výroční přehled patologie. 10: 371–93. doi:10.1146 / annurev-pathol-012513-104644. PMC 4316199. PMID 25621661.
- ^ Uchida K, Nakata K, Carey B, Chalk C, Suzuki T, Sakagami T a kol. (Leden 2014). "Standardizované sérum GM-CSF testování protilátek pro rutinní klinickou diagnostiku autoimunitní plicní alveolární proteinózy". Journal of Immunological Methods. 402 (1–2): 57–70. doi:10.1016 / j.jim.2013.11.011. PMID 24275678.
- ^ Holbert JM, Costello P, Li W, Hoffman RM, Rogers RM (květen 2001). "CT rysy plicní alveolární proteinózy". AJR. American Journal of Roentgenology. 176 (5): 1287–94. doi:10.2214 / ajr.176.5.1761287. PMID 11312196.
- ^ Das M, Salzman GA (únor 2010). „Plicní alveolární proteinóza: přehled pro internisty a nemocniční lékaře“. Nemocniční praxe. 38 (1): 43–9. doi:10,3810 / hp.2010.02.277. PMID 20469623. S2CID 21084414.
- ^ A b Mikami T, Yamamoto Y, Yokoyama M, Okayasu I (prosinec 1997). „Plicní alveolární proteinóza: diagnostika pomocí rutinně zpracovaných nátěrů tekutiny z bronchoalveolární laváže“. Journal of Clinical Pathology. 50 (12): 981–4. doi:10.1136 / jcp.50.12.981. PMC 500376. PMID 9516877.
- ^ A b C Maygarden SJ, Iacocca MV, Funkhouser WK, Novotny DB (červen 2001). „Plicní alveolární proteinóza: spektrum cytologických, histochemických a ultrastrukturálních nálezů v bronchoalveolární lavážní tekutině“. Diagnostická cytopatologie. 24 (6): 389–95. doi:10.1002 / dc.1086. PMID 11391819.
- ^ Ceruti M, Rodi G, Stella GM, Adami A, Bolongaro A, Baritussio A a kol. (Březen 2007). „Úspěšná výplach plic u plicní alveolární proteinózy sekundární k intoleranci lysinurových proteinů: kazuistika“. Orphanet Journal of Rare Diseases. 2: 14. doi:10.1186/1750-1172-2-14. PMC 1845139. PMID 17386098.
- ^ Menard KJ (duben 2005). „Výplach celé plíce při léčbě plicní alveolární proteinózy“. Journal of Perianesthesia Nursing. 20 (2): 114–26. doi:10.1016 / j.jopan.2005.01.005. PMID 15806528.
- ^ Griese M, Ripper J, Sibbersen A, Lohse P, Lohse P, Brasch F a kol. (Srpen 2011). „Dlouhodobé sledování a léčba vrozené alveolární proteinózy“. BMC Pediatrics. 11 (1): 72. doi:10.1186/1471-2431-11-72. PMC 3175167. PMID 21849033.
- ^ A b „Léčba a léčba plicní alveolární proteinózy (PAP)“. Clevelandská klinika. Citováno 2020-12-02.
- ^ A b „UpToDate“. www.uptodate.com. Citováno 2020-12-01.
- ^ A b C "Plicní alveolární protein". NORD (Národní organizace pro vzácné poruchy). Citováno 2020-12-01.
- ^ Michaud G, Reddy C, Ernst A (prosinec 2009). „Výplach plic pro plicní alveolární proteinózu“. Hruď. 136 (6): 1678–1681. doi:10,1378 / hrudník.09-2295. PMID 19995769.
- ^ A b Griese M (srpen 2017). „Plicní alveolární protein: komplexní klinická perspektiva“. Pediatrie. 140 (2). doi:10.1542 / peds.2017-0610. PMID 28771412.
- ^ Huddleston CB, Bloch JB, Sweet SC, de la Morena M, Patterson GA, Mendeloff EN (září 2002). „Transplantace plic u dětí“. Annals of Surgery. 236 (3): 270–6. doi:10.1097/00000658-200209000-00003. PMC 1422580. PMID 12192313.
- ^ Inoue Y, Trapnell BC, Tazawa R, Arai T, Takada T, Hizawa N a kol. (Duben 2008). „Charakteristika velké skupiny pacientů s autoimunitní plicní alveolární proteinózou v Japonsku“. American Journal of Respiratory and Critical Care Medicine. 177 (7): 752–62. doi:10,1164 / rccm. 200708-1271OC. PMC 2720118. PMID 18202348.
- ^ Antoon JW, Hernandez ML, Roehrs PA, Noah TL, Leigh MW, Byerley JS (Březen 2016). „Endogenní lipoidní pneumonie předcházející diagnóze plicní alveolární proteinózy“. The Clinical Respiratory Journal. 10 (2): 246–9. doi:10.1111 / crj.12197. PMID 25103284.
- ^ Seymour JF, Presneill JJ (červenec 2002). „Plicní alveolární proteinóza: pokrok v prvních 44 letech“. American Journal of Respiratory and Critical Care Medicine. 166 (2): 215–35. doi:10,1164 / rccm.2109105. PMID 12119235.
- ^ Rosen SH, Castleman B, Liebow AA (červen 1958). "Plicní alveolární proteinóza". The New England Journal of Medicine. 258 (23): 1123–42. doi:10.1056 / NEJM195806052582301. PMID 13552931.
- ^ Ramirez J, Nyka W, McLaughlin J (leden 1963). "Plicní alveolární proteinóza. Diagnostické techniky a pozorování". The New England Journal of Medicine. 268 (4): 165–71. doi:10.1056 / NEJM196301242680401. PMID 13990655.
- ^ Ramirez J, Schultz RB, Dutton RE (září 1963). „Plicní alveolární proteinóza: nová technika a racionální léčba“. Archiv vnitřního lékařství. 112 (3): 419–31. doi:10.1001 / archinte.1963.03860030173021. PMID 14045290.
externí odkazy
| Klasifikace | |
|---|---|
| Externí zdroje |
