Periferně působící antagonista μ-opioidního receptoru - Peripherally acting μ-opioid receptor antagonist
Periferně působící μ-opioidní receptor antagonisté (PAMORA) jsou třídou chemické sloučeniny které se používají ke zpětnému chodu nepříznivé účinky zapříčiněno opioidy interakce s receptory mimo centrální nervový systém (CNS), zejména těch, které se nacházejí v gastrointestinální trakt. PAMORA jsou navrženy tak, aby specificky inhibovaly určité opioidní receptory v gastrointestinálním traktu a s omezenou schopností překonávat hematoencefalická bariéra. Proto PAMORA neovlivňují analgetikum účinky opioidů v centrálním nervovém systému.[1]
Objev a vývoj
Je známo, že opioidní léky způsobují opioidy vyvolaná zácpa (OIC) inhibicí vyprazdňování žaludku a klesá peristaltické vlny vedoucí k opožděné absorpci léků a vyšší absorpci vody z výkaly. To může mít za následek tvrdou a suchou stolici a zácpa u některých pacientů.[2]
OIC je jedním z nejběžnějších nepříznivé účinky způsobené opioidy, takže objev PAMORA může zabránit účinkům, které často ohrožují ovládnutí bolesti.[3]
Methylnaltrexoniumbromid byl první lék v drogová třída schváleno FDA.[4] Objevil ji v roce 1979 Leon Goldberg, a farmakolog na University of Chicago. Poté, co byl Goldberg svědkem utrpení umírajícího přítele s OIC, testoval různé deriváty z naltrexon, lék, o kterém je známo, že blokuje účinky opioidů. Jeho cílem bylo najít lék, který by nemohl projít hematoencefalická bariéra, aniž by byly ovlivněny analgetické účinky opioidů. Poté, co Goldberg zemřel, jeho kolegové na univerzitě pokračovali ve vývoji sloučeniny. To bylo schváleno FDA v dubnu 2008, původně pro OIC u dospělých pacientů s pokročilým onemocněním a později u dospělých pacientů s chronickou nerakovinovou bolestí.[5]
Na konci 70. let Dennis M. Zimmerman a jeho spolupracovníci z Lilly Research Laboratories, Indiana, provedl výzkum strukturních konceptů pro narkotické antagonisty definované v sérii 4-fenylpiperidinu.[6] Hlásili se N-methyl-trans-3,4-dimethyl-4-fenylpiperidin je čistý opioidní receptor antagonista s novým farmakofor. Chcete-li zvýšit potence připojili a fenolová skupina do aromatický kruh, N-methyl-trans-3,4-dimethyl-4- (3-hydroxyfenyl) piperidin. Tato struktura byla použita k návrhu a vývoji dalších antagonistů opioidních receptorů, jako jsou alvimopan.[5] Později v roce 2008 byl přípravek Alvimopan schválen pro použití v nemocnici ke zvýšení gastrointestinální funkce po částečném velkém nebo tenké střevo resekce s primární anastomóza. Naloxegol byl schválen v září 2014 a naldemedin v březnu 2017, a to jak k léčbě OIC u dospělých pacientů s chronickým karcinomem.[7][8][9][10]
Mechanismus účinku
PAMORA působí inhibicí vazby opioidů agonista do μ-opioidní receptor (MOR). Cílem léčby přípravkem PAMORA je obnovit střevní nervový systém funkce (ENS). MOR se nachází na několika místech v těle a PAMORA je konkurenční antagonista pro vazbu na receptor. MOR v gastrointestinálním traktu jsou hlavními receptory, které mají PAMORA blokovat a zabraňovat vazbě opioidních agonistů.[11] PAMORA se používají při léčbě opioidy indukované dysfunkce střev (OIBD), což je potenciální nepříznivý účinek způsobený chronickým užíváním opioidů. PAMORA působí na všechny tři patofyziologické mechanismy tohoto nepříznivého účinku. Jednají podle motilita střev, střevní sekrece a svěrač funkce.[12]
PAMORA účinkem na motilitu střev je, že může zvýšit klidový tón ve vrstvě kruhového svalu. Antagonista zvyšuje účinek na tonickou inhibici svalový tonus. Tím se normalizuje tón ve vrstvě kruhového svalu, a tím se zabrání rytmickým kontrakcím vyvolaným opioidy. Když se tyto dva faktory spojí, vede to ke snížení doba přepravy. Tyto účinky implicitně sníží pasivní absorpci tekutin, což pomáhá při snižování symptomů OIBD, jako je zácpa, střevní křeč a břišní křeče.[13]
Účinek PAMORA na sekreci střeva pomůže zvrátit pokles tábor tvorba, kterou indukují opioidní agonisté.[14] Antagonista také vytvoří normální sekreci chlorid. Agonisté opioidů mohou také snížit vylučování z peptidy zvýšením podpůrný nervový systém přes μ-receptory v ENS, což může vést k suchší a tvrdší stolici. PAMORA působí proti tomu, takže stolice je měkčí a méně suchá.[13]
PAMORA ovlivňuje funkci svěrač je teoreticky regulovat pohybovou koordinaci. Antagonista může zabránit sfinkter Oddiho dysfunkce to je způsobeno opioidy.[15] Antagonisté mohou také snížit dysfunkci análního svěrače vyvolanou opioidy. Dysfunkce je spojena s namáhání, hemoroidy a neúplné vyprázdnění.[16]
Vztah struktura-aktivita
I když se léky zaměřené na μ-opioidní receptory (MOR) používají již dlouhou dobu, není o nich známo mnoho vztah struktura-aktivita a ligand -receptorové interakce na základě dobře definované biologické účinky na aktivaci nebo inhibici receptoru. Rozdíl ve vzorcích interakce receptor-ligand agonistů a antagonistů také není jistý. Jedna teorie uvádí, že morfinany biologická aktivita může být určena velikostí N-substituentů. Například antagonisté mají obvykle větší substituenty, jako jsou allyl - nebo cyklopropylmethyl na morfinanovém dusíku, zatímco agonisté obecně obsahují a methylová skupina. Na druhou stranu je agonistická aktivita také prokázána u ligandů s většími skupinami na morfinanovém dusíku, a proto je tato hypotéza zpochybněna.[17]
Struktura

Methylnaltrexoniumbromid, naloxegol a naldemedin mají všechny podobné struktury, které nejsou daleko od chemické struktury morfium a další agonisté MOR. Všechny obsahují rigidní pentacyklický struktura, která zahrnuje benzenový kruh (A), tetrahydrofuran kroužek (B), dva cyklohexan kroužky (C a D) a a piperidin kroužek (E).[18] Nejdůležitější funkční skupiny pro biologické působení opioidů jsou hydroxylová skupina na fenol, N-methylová skupina, éter most mezi C4 a C5, dvojná vazba mezi uhlík počet C7 a C8 a hydroxylové skupiny na C3 a C6. Fenolový kruh a jeho 3-hydroxylová skupina jsou životně důležité pro analgetické účinky, protože odstranění skupiny OH 10krát snižuje analgetickou aktivitu. Existuje další princip pro hydroxylovou skupinu na C6, protože odstranění zvyšuje její aktivitu. Zvýšená aktivita je hlavně kvůli zvýšené lipofilita a zvýšenou schopnost překonat hematoencefalickou bariéru. Naldemedin má hydroxylovou skupinu, zatímco methylnaltrexoniumbromid má keton skupina a naloxegol má ester. Dvojitá vazba mezi C7 a C8 není nutná pro analgetický účinek a redukce dvojné vazby zvýší aktivitu. Žádný z antagonistů nemá ve své struktuře dvojnou vazbu. Předpokládá se, že N-substituent na kostře určuje farmakologické chování a jeho interakci s MOR. Rovněž se předpokládá, že hraje klíčovou roli při rozlišování antagonistů od agonistů. Allyl group, a methylcyklopropylová skupina nebo a methylcyklobutyl protože se předpokládá, že N-substituční skupiny vedou antagonistickou aktivitu.[19][20][21]
Závazný web
Agonisté a antagonisté jsou jistí chemické vazby s aminokyseliny které vytvářejí MOR. Předpokládá se, že se vytvoří většina antagonistů i agonistů nabitá interakce s Asp147 a a vodíková vazba s Tyr148. Většina antagonistů však také tvoří další polární interakce s dalšími aminokyselinovými zbytky, jako jsou Lys233, Gln124, Gln229, Asn150, Trp318 a Tyr128. Pouze malá menšina agonistů tvoří stejné další polární interakce. Je známo, že agonisté i antagonisté vytvářejí vodíkové vazby s His297.[22]
Lze vyvodit závěr, že interakce s aminokyselinovými zbytky, Asp147 a Tyr148 jsou pro ligand vázat se na receptor a molekuly, které tvoří další polární interakce s jinými zbytky, jsou častěji antagonisty než agonisty.[17]
Může se vytvořit N-substituční skupina hydrofobní vazby s Tyr326 a Trp293 a aromatické a cyklohexanové kruhy mohou tvořit podobné vazby jako Met151. Zadní strana ligandu může také tvořit hydrofobní vazbu, ale s Val300 a Ile296.[22]
Methylnaltrexoniumbromid
Methylnaltrexoniumbromid je bromid solná forma methylnaltrexonu, a kvartérní methylderivát noroxymorfon. Methylová skupina a tvorba kvartérní soli zvyšují polarita a snížit rozpustnost lipidů tím omezuje průnik hematoencefalickou bariérou. Methylnaltrexon má osmkrát vyšší afinita pro MOR než pro κ-opioidní receptor (KOR) a 5-opioidní receptor (DOR).[23] Naltrexon tvoří interakci s Asp147 a Tyr148 spolu s a vodíková vazba s Lys233.[24]

Alvimopan

Periferně selektivní trans-3,4-dimethyl-4- (3-hydroxylfenyl) piperidinové opioidní antagonisty byly vyvinuty pro léčbu gastrointestinální motilita porucha Zimmermana a jeho spolupracovníků. Z toho odvozili 4- (3-hydroxyfenyl) -3,4-dimethylpiperidinový skelet s funkčními skupinami zahrnujícími různé velikosti, náboj a polaritu, aby dosáhli antagonismu periferních opioidních receptorů při snížení expozice léčivu CNS. The in vitro μ-Ki, in vivo AD50, a ED50 a periferní index (poměr) byl zkoumán pro několik selektivních analogů a z toho zjistili, že nejlepší výsledky poskytl trans-3,4-dimethyl-4- (3-hydroxyfenyl) piperidin, Alvimopan.[5] Ten velký zwitterionický struktura a vysoká polarita brání Alvimopanu v překročení hematoencefalické bariéry, účinnost při vázání periferních MOR je tedy 200krát větší než u centrálních MOR.[25]
Naloxegol
Naloxegol je a polyethylenglykol -modifikovaný derivát α-naloxol. Naloxegol má podobnou formu jako naloxon jako heteropentacyklický sloučenina, která oba mají allylová skupina připojený k amin z piperidin prsten. Naloxegol má však monomethoxy zakončený n = 7 oligomer z KOLÍK připojený k 6-alfa-hydroxylové skupině ɑ-naloxolu prostřednictvím éter vazba. PEG skupina zvyšuje molekulární váha a proto omezuje absorpci naloxegolu do CNS.[26] Z pegylovaného naloxegolu se dále stává Podklad pro P-glykoprotein výtok transportér, který transportuje sloučeninu z CNS.[27]
Naldemedine
Naldemedin má podobnou chemickou strukturu jako naltrexon, ale s dalším postranním řetězcem, který zvyšuje molekulární váha a polární povrch látky. Podobně jako naloxegol je i naldemedin substrátem efluxního transportéru P-glykoproteinu. Tyto vlastnosti vedou k menšímu pronikání do CNS a snižují možné závěry s účinky opioidních agonistů.[28]Naldemedine je dvojitým antagonistou pro MOR a DOR. Je známo, že aktivace DOR způsobuje nevolnost a / nebo zvracení, takže duální antagonista může snížit jak OIC, tak nevolnost / zvracení.[29]
Farmakokinetika
The molekulární váha, biologická dostupnost, vazba na bílkoviny, eliminační poločas, čas k dosažení maximální plazmatické koncentrace a vazebná afinita jsou uvedeny v tabulce níže.[26][23]
| Chemický název | Chemická struktura | Molekulová hmotnost (g / mol) | Biologická dostupnost (%) | Vazba na plazmatické bílkoviny (%) | t1/2 (h) | tmax | Ki μ (nM) | Ki κ (nM) | Ki δ (nM) |
|---|---|---|---|---|---|---|---|---|---|
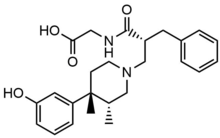
| Methylnaltrexon bromid | 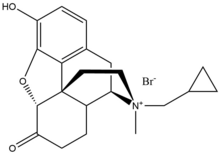 | 436,3 | Nízký | 11-15 | 8 | 30 min | 5.50 | 32.1 | 3453.8 |
| Alvimopan |
| 424,53 | 6 | 80-90 | 10-17 | 2 h | 0.77 | 40 | 4.4 |
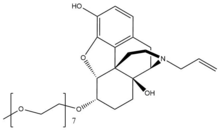
| Naloxegol |
| 651,798 | NA | 4,2 | 6-11 | 2 h | 7.42 | 8.65 | 203.0 |
| Naldemedine |
| 570,6 | 29 | 93-94 | 11 | 45 min | 0.34 | 0.94 | 0.43 |
- t1/2: Biologický poločas
- tmax: Čas k dosažení maximální koncentrace v plazmě
- pKi: měření vazba ligandu afinita
Methylnaltrexoniumbromid má špatnou orální biologickou dostupnost, a proto se podává každý druhý den subkutánně. Přibližně polovina dávky se vylučuje močí a o něco méně stolicí, přičemž 85% je vyloučeno beze změny.[24]
Alvimopan má díky své vysoké značně nízkou biologickou dostupnost (6%) vazebná afinita a nízko disociační rychlost. Alvimopan je v zásadě zprostředkován biliární sekrece s průměrnou plazmatickou clearance 400 ml / min. Metabolismus alvimopanu je přes střevní flóra což má za následek hydrolýza alvimopanu na aktivní amidový metabolit (ADL 08-0011). Metabolit je však považován za klinicky irelevantní kvůli své nízké vazebné afinitě.[25]
Pokud se naloxegol podává s tučným jídlem, vstřebávání zvyšuje. Výprodej je většinou přes jaterní metabolismus (P450-CYP3A) s neznámými účinky metabolitů. Naloxegol má malé fragmenty eliminované vylučování ledvinami.[30]
Naldemedin metabolity hlavně prostřednictvím CYP3A k nor-naldemedinu také metabolizuje prostřednictvím UDP-glukuronosyltransferáza 1A3 na naldemedin 3-G, ale v menší míře. Tyto metabolity jsou oba antagonisty opioidních receptorů, ale jsou méně účinné než mateřská sloučenina.[35]
PAMORA ve vývoji

Axelopran je orální PAMORA, která je vyvíjena společností Theravane Biopharma. Dokončila fázi II v roce 2006 klinické testy u více než 400 pacientů s OIC. Axelopran má jinou chemickou strukturu než jiné PAMORA, ale s podobnou mechanismus účinku. Působí jako antagonista pro MOR, KOR a DOR, ale s vyšší afinitou k MOR a KOR než k DOR. Stejně jako ostatní PAMORA je hlavním cílem léčba OIC.[36]Axelopran je také zkoumán v kombinaci s fixní dávkou (FDC) s oxykodon. Dělá se to pomocí technologie nanášení stříkáním k vytvoření FDC axelopranu a oxykodonu s řízeným uvolňováním.[37]
Existuje poptávka po optimalizaci receptoru selektivita a afinitu doprovázenou zkoumáním kandidátských sloučenin, pokud jde o jejich způsob podání. To jsou hlavní cíle a budoucí strategie pro objevování léků a vývoj PAMORA. Převážně MOR vykazují funkčně selektivní agonismus. Proto budoucí možné kandidátské sloučeniny, které cílí na OIC, jsou PAMORA s optimalizovanou selektivitou a afinitou.[27]
Reference
- ^ Floettmann, Eike; Bui, Khanh; Sostek, Mark; Payza, Kemal; Eldon, Michael (květen 2017). „Farmakologický profil naloxegolu, periferně působícího antagonisty µ-opioidních receptorů, pro léčbu zácpy vyvolané opioidy“. The Journal of Pharmacology and Experimental Therapeutics. 361 (2): 280–291. doi:10.1124 / jpet.116.239061. PMC 5399635. PMID 28336575.
- ^ Sizar, Omeed; Gupta, Mohit (2019). „Zácpa vyvolaná opioidy“. Národní centrum pro biotechnologické informace. Publishing StatPearls. PMID 29630236. Citováno 4. června 2019.
- ^ Bui, Khanh; Zhou, Diansong; Xu, Hongmei; Floettmann, Eike; Al-Huniti, Nidal (červen 2017). „Klinická farmakokinetika a farmakodynamika naloxegolu, periferně působícího antagonisty µ-opioidního receptoru“. Klinická farmakokinetika. 56 (6): 573–582. doi:10.1007 / s40262-016-0479-z. PMID 28035588. S2CID 3458268.
- ^ „Droga vyvinutá na University of Chicago získala souhlas FDA“. University of Chicago News. University of Chicago News. Citováno 30. dubna 2008.
- ^ A b C d Carroll, F. Ivy; Dolle, Roland E. (2014). „Objev a vývoj N-substituované trans-3,4-dimethyl-4- (3'-hydroxyfenyl) piperidinové třídy čistých antagonistů opioidních receptorů“. ChemMedChem. 9 (8): 1638–1654. doi:10,1002 / cmdc.201402142. ISSN 1860-7187. PMC 5588862. PMID 24981721.
- ^ Zimmerman, Dennis M .; Nickander, Rodney; Horng, Jong S .; Wong, David T. (září 1978). "Nové strukturální koncepty pro narkotické antagonisty definované v sérii 4-fenylpiperidinu". Příroda. Dotisky a oprávnění. 275 (5678): 332–334. Bibcode:1978Natur.275..332Z. doi:10.1038 / 275332a0. PMID 692714. S2CID 4149532.
- ^ „Balíček pro schválení léčiv: Entereg (Alvinopan) Capsules 21775“. www.accessdata.fda.gov. FDA. Citováno 18. července 2008.
- ^ Crockett, Seth D .; Greer, Katarina B .; Heidelbaugh, Joel J .; Falck-Ytter, Yngve; Hanson, Brian J .; Sultan, Shahnaz (leden 2019). „Směrnice institutu Americké gastroenterologické asociace pro lékařskou péči o zácpu vyvolanou opioidy“. Gastroenterologie. 156 (1): 218–226. doi:10.1053 / j.gastro.2018.07.016. PMID 30340754.
- ^ „Balíček pro schválení léků: tablety MOVANTIC (naloxegol)“. www.accessdata.fda.gov. FDA.
- ^ „Symproické (naldemedinové) tablety“. www.accessdata.fda.gov. FDA. Citováno 4. května 2017.
- ^ Streicher, John M .; Bilsky, Edward J. (2017-09-25). „Periferně působící antagonisté μ-opioidních receptorů pro léčbu vedlejších účinků souvisejících s opioidy: mechanismus účinku a klinické důsledky“. Journal of Pharmacy Practice. 31 (6): 658–669. doi:10.1177/0897190017732263. ISSN 0897-1900. PMC 6291905. PMID 28946783.
- ^ Brock, Christina; Olesen, Søren Schou; Olesen, Anne Estrup; Frøkjaer, Jens Brøndum; Andresen, Trine; Drewes, Asbjørn Mohr (01.10.2012). "Dysfunkce střev vyvolaná opioidy". Drogy. 72 (14): 1847–1865. doi:10.2165/11634970-000000000-00000. ISSN 1179-1950. PMID 22950533. S2CID 173168.
- ^ A b Thomas, Jay (2008). „Dysfunkce střev vyvolaná opioidy“. Journal of Pain and Symptom Management. 35 (1): 103–113. doi:10.1016 / j.jpainsymman.2007.01.017. ISSN 0885-3924. PMID 17981003.
- ^ Ghelardini, Carla; Di Cesare Mannelli, Lorenzo; Bianchi, Enrica (2015). „Farmakologický základ opioidů“. Klinické případy minerálního a kostního metabolismu. 12 (3): 219–221. doi:10.11138 / ccmbm / 2015.12.3.219. ISSN 1724-8914. PMC 4708964. PMID 26811699.
- ^ Torres, Daniele; Parrinello, Gaspare; Trapanština, Caterina; Licata, Giuseppe (2017). „Náhlá silná bolest břicha po jedné nízké dávce paracetamolu / kodeinu u cholecystektomizovaného pacienta: poučení z kazuistiky“. American Journal of Therapeutics. 17 (4): e133–134. doi:10.1097 / MJT.0b013e3181baf253. ISSN 1536-3686. PMID 19829093.
- ^ Brock, Christina; Olesen, Søren Schou; Olesen, Anne Estrup; Frøkjaer, Jens Brøndum; Andresen, Trine; Drewes, Asbjørn Mohr (01.10.2012). „Opioidy indukovaná dysfunkce střev: patofyziologie a léčba“. Drogy. 72 (14): 1847–1865. doi:10.2165/11634970-000000000-00000. ISSN 1179-1950. PMID 22950533. S2CID 173168.
- ^ A b Kaserer, Teresa; Lantero, Aquilino; Schmidhammer, Helmut; Spetea, Mariana; Schuster, Daniela (18. února 2016). „μ Opioidní receptor: noví antagonisté a strukturní modelování“. Vědecké zprávy. 6: 21548. Bibcode:2016NatSR ... 621548K. doi:10.1038 / srep21548. ISSN 2045-2322. PMC 4757823. PMID 26888328.
- ^ DeRuiter, Jack (2000). Zásady protidrogové činnosti (PDF). Kaštanové vzdělávání.
- ^ Haddou, Tanila Ben; Béni, Szabolcs; Hosztafi, Sándor; Malfacini, Davide; Calo, Girolamo; Schmidhammer, Helmut; Spetea, Mariana (11. června 2014). „Farmakologická vyšetření variací N-substituentů v morfinu a oxymorfonu: vazba, signalizace a antinociceptivní aktivita opioidních receptorů“. PLOS ONE. 9 (6): e99231. Bibcode:2014PLoSO ... 999231B. doi:10.1371 / journal.pone.0099231. ISSN 1932-6203. PMC 4053365. PMID 24919067.
- ^ Truong, Phong M .; Hassan, Sergio A .; Lee, Yong-Sok; Kopajtic, Theresa A .; Katz, Jonathan L .; Chadderdon, Aaron M .; Traynor, John R .; Deschamps, Jeffrey R .; Jacobson, Arthur E .; Rice, Kenner C. (15. dubna 2017). „Modulace afinity a účinnosti opioidních receptorů prostřednictvím N-substituce 9β-hydroxy-5- (3-hydroxyfenyl) morfanu: Studie syntézy a počítačové simulace“. Bioorganická a léčivá chemie. 25 (8): 2406–2422. doi:10.1016 / j.bmc.2017.02.064. ISSN 0968-0896. PMC 5407189. PMID 28314512.
- ^ Kawamura, N .; Kataoka, T .; Imai, E .; Iwamura, T .; Hori, M .; Niwa, M .; Nozaki, M .; Fujimura, H. (1. ledna 1981). „Antagonisticko-agonistická aktivita některých N-substituovaných benzomorfanů“. Pokroky v endogenních a exogenních opioidech. Elsevier: 411–413. doi:10.1016 / B978-0-444-80402-0.50138-8. ISBN 9780444804020.
- ^ A b Manglik, Aashish; Kruse, Andrew C .; Kobilka, Tong Sun; Thian, Foon Sun; Mathiesen, Jesper M .; Sunahara, Roger K .; Pardo, Leonardo; Weis, William I .; Kobilka, Brian K .; Granier, Sébastien (květen 2012). „Krystalová struktura µ-opioidního receptoru navázaného na morfinanového antagonistu“. Příroda. 485 (7398): 321–326. Bibcode:2012Natur.485..321M. doi:10.1038 / příroda10954. ISSN 1476-4687. PMC 3523197. PMID 22437502.
- ^ A b "Methylnaltrexoniumbromid". pubchem.ncbi.nlm.nih.gov.
- ^ A b R. William, Hipkin; Dolle, Roland E. (2010). „Kapitola 9 - Antagonisté opioidních receptorů pro gastrointestinální dysfunkci“. Výroční zprávy o léčivé chemii. 45: 142–155. doi:10.1016 / S0065-7743 (10) 45009-5.
- ^ A b Zabirowicz, Eric S .; Gan, Tong J. (2019). 34 - Farmakologie pooperační nevolnosti a zvracení. Elsevier. 671–692. doi:10.1016 / B978-0-323-48110-6.00034-X. ISBN 9780323481106.
- ^ A b "Naloxegol". pubchem.ncbi.nlm.nih.gov.
- ^ A b Streicher, John M .; Bilsky, Edward J. (prosinec 2018). „Periferně působící antagonisté μ-opioidních receptorů pro léčbu vedlejších účinků souvisejících s opioidy: mechanismus účinku a klinické důsledky“. Journal of Pharmacy Practice. 31 (6): 658–669. doi:10.1177/0897190017732263. ISSN 0897-1900. PMC 6291905. PMID 28946783.
- ^ Hu, Kenneth; Bridgeman, Mary Barna (říjen 2018). „Naldemedin (sympatický) pro léčbu zácpy vyvolané opioidy“. Lékárna a terapeutika. 43 (10): 601–627. ISSN 1052-1372. PMC 6152697. PMID 30271103.
- ^ Inagaki, Masanao; Kume, Masaharu; Tamura, Yoshinori; Hara, Shinichiro; Goto, Yoshihisa; Haga, Nobuhiro; Hasegawa, Tsuyoshi; Nakamura, Takashi; Koike, Katsumi; Oonishi, Shuuichi; Kanemasa, Toshiyuki; Kai, Hiroyuki (1. ledna 2019). „Objev naldemedinu: Účinný a orálně dostupný antagonista opioidních receptorů pro léčbu nežádoucích účinků vyvolaných opioidy“. Dopisy o bioorganické a léčivé chemii. 29 (1): 73–77. doi:10.1016 / j.bmcl.2018.11.007. ISSN 0960-894X. PMID 30446313.
- ^ A b Turan, Alparslan; Saasouh, Wael; Hovsepyan, Karen; Ty, Jing. „Pomocné účinky orálního naloxegolu (Movantik)“ (PDF). Clinicaltrials.gov.
- ^ "Alvimopan (ADL 8-2698) | Antagonista opioidních receptorů | MedChemExpress". MedchemExpress.com.
- ^ "Methylnaltrexoniumbromid". pubchem.ncbi.nlm.nih.gov.
- ^ Kanemasa, Toshiyuki; Koike, Katsumi; Arai, Tohko; Ono, Hiroko; Horita, Narumi; Chiba, Hiroki; Nakamura, Atsushi; Morioka, Yasuhide; Kihara, Tsuyoshi; Hasegawa, Minoru (1. května 2019). „Farmakologické účinky naldemedinu, periferně působícího antagonisty μ-opioidních receptorů, v modelech zácpy vyvolané opioidy in vitro a in vivo“. Neurogastroenterologie a motilita. 31 (5): e13563. doi:10.1111 / nmo.13563. ISSN 1365-2982. PMC 6850587. PMID 30821019.
- ^ "Opioidní receptor | kappa, mu Opioidní receptor". www.selleckchem.com. Citováno 2019-10-10.
- ^ Markham, Anthony (květen 2017). „Naldemedine: První globální schválení“. Drogy. 77 (8): 923–927. doi:10.1007 / s40265-017-0750-0. PMID 28466424. S2CID 19271743.
- ^ Pannemans, Jasper; Vanuytsel, Tim; Tack, Jan (říjen 2018). „Nový vývoj v léčbě gastrointestinálních symptomů vyvolaných opioidy“. United European Gastroenterology Journal. 6 (8): 1126–1135. doi:10.1177/2050640618796748. PMC 6169055. PMID 30288274.
- ^ "Theravance Biopharma: Programy | Dysfunkce gastrointestinální motility". WEB.