Organické sloučeniny síry - Organosulfur compounds - Wikipedia
Organické sloučeniny síry jsou organické sloučeniny které obsahují síra.[1] Často jsou spojovány s nepříjemnými pachy, ale mnoho z nejsladších známých sloučenin jsou deriváty organosíry, např. sacharin. Příroda oplývá organosírovými sloučeninami - síra je nezbytná pro život. Z 20 společných aminokyseliny, dva (cystein a methionin ) jsou organické sloučeniny síry a antibiotika penicilin a sulfa léky oba obsahují síru. Zatímco antibiotika obsahující síru zachraňují mnoho životů, sirná hořčice je smrtící agent chemické války. Fosilní paliva, uhlí, ropa, a zemní plyn, které pocházejí ze starověkých organismů, nutně obsahují organosírové sloučeniny, odstranění z nichž je a hlavní zaměření z ropné rafinerie.
Síra sdílí chalkogen skupina s kyslík, selen, a telur Očekává se, že organosírové sloučeniny mají podobnost se sloučeninami uhlík-kyslík, uhlík-selen a uhlík-telur.
Klasika chemický test pro detekci sloučenin síry je Cariusova halogenová metoda.
Třídy
Organické sloučeniny síry lze klasifikovat podle obsahu síry funkční skupiny, které jsou uvedeny (přibližně) v sestupném pořadí podle výskytu.
- Ilustrativní sloučeniny síry

Allicin, aktivní aromatická sloučenina v drceném česneku

(R)-Cystein, an aminokyselina obsahující thiolovou skupinu

Methionin, an aminokyselina obsahující sulfid

Difenyldisulfid, zástupce disulfidu

Dibenzothiofen, složka ropy

Kyselina perfluoroktansulfonová, kontroverzní povrchově aktivní látka
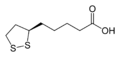
Kyselina lipoová, základní kofaktor čtyř komplexů mitochondriálních enzymů.

Penicilin základní struktura, kde „R“ je skupina proměnných.

Sulfanilamid, a sulfonamid antibakteriální, nazvaný a droga sulfa.

Síra hořčice, typ sulfidu použitého jako a bojový agent.
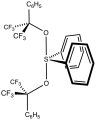
Martinův siran se strukturou houpačky, jako je struktura SF4[2]
Sulfidy
Sulfidy, dříve známé jako thioethery, se vyznačují C-S-C vazby[3][4] Ve vztahu k vazbám C-C jsou vazby C-S delší, protože atomy síry jsou větší než atomy uhlíku a asi o 10% slabší. Zástupce délky vazby ve sloučeninách síry je 183odpoledne pro jednoduchou vazbu S-C v methanthiol a 173 hodin v thiofen. C-S energie disociace vazby pro thiomethan je 89 kcal / mol (370 kJ / mol) ve srovnání s methanem 100 kcal / mol (420 kJ / mol) a když je vodík nahrazen methylovou skupinou, energie klesá na 73 kcal / mol (305 kJ / mol).[5] Singl vazba uhlík na kyslík je kratší než vazba C-C. The energie disociace vazby pro dimethylsulfid a dimethylether jsou 73, respektive 77 kcal / mol (305 a 322 kJ / mol).
Sulfidy se obvykle připravují alkylace thiolů. Mohou být také připraveny prostřednictvím Pummererův přesmyk. V jednom pojmenovaná reakce volal Ferrariova reakce fenylether je převeden na fenoxathiin působením elementární síry a chlorid hlinitý.[6]
Thioacetaly a thioketály mají posloupnost vazeb C − S − C − S − C. Představují podtřídu sulfidů. Thioacetaly jsou užitečné vumpolung „karbonylových skupin. Thioacetaly a thioketály lze také použít k ochraně karbonylové skupiny v organických syntézách.
Výše uvedené třídy sloučenin síry existují také v nasycených a nenasycených heterocyklický struktur, často v kombinaci s jinými heteroatomy, jak dokládá thiiranes, thiireny, thietany, thietes, dithietany, thiolany, thianes, dithianes, thiepanes, thiepines, thiazoly, isothiazoly, a thiofeny, mezi ostatními. Poslední tři sloučeniny představují speciální třídu heterocyklů obsahujících síru aromatický. The rezonanční stabilizace z thiofen je 29 kcal / mol (121 kJ / mol) ve srovnání s 20 kcal / mol (84 kJ / mol) pro analog kyslíku furan. Důvodem tohoto rozdílu je vyšší elektronegativita pro kyslík odtahující elektrony k sobě na úkor proudu aromatického kruhu. Přesto jako aromatický substituent thioskupina méně uvolňuje elektrony než alkoxyskupina. Dibenzothiofeny (viz obrázek), tricyklické heterocykly skládající se ze dvou benzenových kruhů fúzovaných s centrálním thiofenovým kruhem, se hojně vyskytují v těžších frakcích ropy.
Thioly, disulfidy, polysulfidy
Thiol skupiny obsahují funkčnost R − SH. Thioly jsou strukturně podobné alkohol skupina, ale tyto funkce se velmi liší svými chemickými vlastnostmi. Thioly jsou víc nukleofilní, kyselější a snadněji oxidovaný. Tato kyselost se může lišit o 5 pK.A Jednotky.[7]
Rozdíl v elektronegativita mezi sírou (2,58) a vodíkem (2,20) je malý, a proto vodíkové vazby v thiolech není prominentní. Alifatické thioly se tvoří jednovrstvé na zlato, které jsou aktuální v nanotechnologie.
K určitým aromatickým thiolům lze získat přístup prostřednictvím a Herzova reakce.
Disulfidy R − S − S − R s vazbou kovalentní síra k síře jsou důležité pro síťování: v biochemie pro skládání a stabilitu některých proteinů a v polymerní chemie pro zesíťování pryže.
Známé jsou také delší sirné řetězce, například v přírodním produktu varacin který obsahuje neobvyklý pentathiepinový kruh (5-sírový řetězec cyklický na benzenový kruh).
Thioestery
Thioestery mají obecnou strukturu R − C (O) −S − R. Vztahují se k běžným esterům (R − C (O) −O − R), ale jsou náchylnější k hydrolýze a souvisejícím reakcím. Thioestery jsou prominentní v biochemii, zejména v mastné kyseliny syntéza.
Sulfoxidy, sulfony a thiosulfináty
A sulfoxid, R − S (O) −R, je S-oxid sulfidu ("oxid sulfidu"), a sulfon, R − S (O)2−R, je S,S-sulfidový oxid, a thiosulfinát, R − S (O) −S − R, je S-oxid disulfidu a thiosulfonát, R-S (O)2−S − R, je S,S- oxid disulfidový. Všechny tyto sloučeniny jsou dobře známy rozsáhlou chemií, např. dimethylsulfoxid, dimethylsulfon, a alicin (viz výkres).
Sulfimidy, sulfoximidy, sulfondiiminy
Sulfimidy (také nazývané sulfiliminy) jsou sloučeniny síry a dusíku struktury R2S = NR ', dusíkový analog sulfoxidů. Jsou zajímavé částečně kvůli jejich farmakologickým vlastnostem. Pokud jsou k síře připojeny dvě různé skupiny R, jsou sulfimidy chirální. Sulfimidy tvoří stabilní α-karbanionty.[8]
Sulfoximidy (také nazývané sulfoximiny) jsou tetrakoordinační sloučeniny síry a dusíku, isoelektronické se sulfony, ve kterých je jeden atom kyslíku sulfonu nahrazen substituovaným atomem dusíku, např. R2S (O) = NR '. Pokud jsou k síře připojeny dvě různé skupiny R, jsou sulfoximidy chirální. Velká část zájmu o tuto třídu sloučenin je odvozena z objevu, že methioninsulfoximid (methioninsulfoximin) je inhibitorem glutamin syntetáza.[9]
Sulfonediiminy (také nazývané sulfodiiminy, sulfodiimidy nebo sulfonediimidy) jsou tetrakoordinační sloučeniny síry a dusíku, isoelektronické se sulfony, ve kterých jsou oba atomy kyslíku sulfonu nahrazeny substituovaným atomem dusíku, např. R2S (= NR ')2. Zajímají se díky své biologické aktivitě a jako stavební kameny pro syntézu heterocyklů.[10]
S-Nitrosothioly
S-Nitrosothioly, také známé jako thionitrity, jsou sloučeniny obsahující nitroso skupinu vázanou na atom síry thiolu, např. R − S − N = O. V biochemii jim byla věnována značná pozornost, protože slouží jako dárci nitrosoniového iontu, NO+a oxid dusnatý, NO, který může sloužit jako signální molekuly v živých systémech, zejména v souvislosti s vazodilatací.[11]
Halogenidy síry
Je známa široká škála organosírových sloučenin, které obsahují jednu nebo více halogen atom („X“ v následujících chemických vzorcích) navázaný na jeden atom síry, např .: sulfenylhalogenidy, RSX; sulfinylhalogenidy, RS (O) X; sulfonylhalogenidy, RSO2X; alkyl a arylsulfur trichloridy, RSCI3 a trifluoridy, RSF3;[12] a alkyl a arylsulfur pentafluoridy, RSF5.[13] Méně známé jsou dialkylsulfur tetrahalogenidy, představované hlavně tetrafluoridy, např. R2SF4.[14]
Sloučeniny s dvojné vazby mezi uhlíkem a sírou jsou relativně neobvyklé, ale zahrnují důležité sloučeniny sirouhlík, karbonylsulfid, a thiofosgen. Thioketony (RC (= S) R ') jsou u alkylových substituentů neobvyklé, ale jedním příkladem je thiobenzofenon. Thioaldehydy jsou stále vzácnější, což odráží jejich nedostatek sterické ochrany („thioformaldehyd "existuje jako cyklický trimer). Thioamidy, se vzorcem R1C (= S) N (R.2) R3 jsou častější. Obvykle se připravují reakcí amidů s Lawessonovo činidlo. Isothiokyanáty, se vzorcem R − N = C = S, se nacházejí přirozeně. Patří mezi ně zeleninová jídla s charakteristickými příchutěmi díky isothiokyanáty wasabi, křen, hořčice, ředkev, Růžičková kapusta, řeřicha, nasturtiums, a kapary.
S-Oxidy a S,S-dioxidy thiokarbonylových sloučenin
The S-oxidy thiokarbonylových sloučenin jsou známé jako thiokarbonyl S-oxidy nebo sulfiny, R2C = S = O a thiokarbonyl S,S-dioxidy nebo sulfeny, R.2C = SO2. Tyto sloučeniny jsou dobře známy rozsáhlou chemií, např. Viz syn-propanethial-S-kysličník a sulfen.
Trojné vazby mezi uhlíkem a sírou
Trojné vazby mezi sírou a uhlíkem v sulfaalkynech jsou vzácné a lze je najít v monosulfid uhlíku (CS) [15] a byly navrženy pro sloučeniny F3CCSF3 [16][17] a F5SCSF3.[18] Sloučenina HCSOH je také reprezentována sloučeninou, která má formální trojnou vazbu.[19]
Thiokarboxylové kyseliny a thioamidy
Thiokarboxylové kyseliny (RC (O) SH) a dithiokarboxylové kyseliny (RC (S) SH) jsou dobře známy. Jsou strukturně podobné karboxylovým kyselinám, ale jsou kyselější. Thioamidy jsou analogické amidům.
Kyseliny sulfonové mít funkčnost R − S (= O)2-OH.[20] Jsou to silné kyseliny, které jsou obvykle rozpustné v organických rozpouštědlech. Sulfonové kyseliny jako kyselina trifluormethansulfonová je často používaným činidlem v organická chemie. Kyseliny sulfinové mít funkčnost R − S (O) −OH while sulfenové kyseliny mít funkčnost R − S − OH. V řadě sulfonových - sulfinových - sulfenových kyselin se v tomto pořadí snižuje jak pevnost, tak stabilita kyseliny.[21][22] Sulfonamidy, sulfinamidy a sulfenamidy, se vzorci R − SO2NR '2, R − S (O) NR ′2a R − SNR ′2každý má bohatou chemii. Například, sulfa léky jsou sulfonamidy odvozené od aromatická sulfonace. Chirální sulfinamidy se používají v asymetrické syntéze, zatímco sulfenamidy se značně používají v procesu vulkanizace, aby se napomohlo zesíťování. Thiokyanáty, R-S-CN, se vztahují k sulfenylhalogenidům a esterům, pokud jde o reaktivitu.
A sulfoniový ion je kladně nabitý iont se třemi organickými substituenty připojenými k síře, se vzorcem [R3S]+. Spolu s jejich záporně nabitým protějškem, aniontem, se sloučeniny nazývají sulfoniové soli. Oxosulfoniový iont je kladně nabitý iont se třemi organickými substituenty a kyslíkem navázaným na síru, se vzorcem [R3S = O]+. Spolu s jejich záporně nabitým protějškem, aniontem, se sloučeniny nazývají oxosulfoniové soli. Příbuzné druhy zahrnují alkoxysulfoniové a chlorsulfoniové ionty, [R.2SOR]+ a [R.2SCl]+, resp.
Sulfonium, oxosulfonium a thiokarbonyl ylidy
Deprotonace sulfoniových a oxosulfoniových solí poskytuje ylidy, struktury R2S+- C.−−R ′2 a R.2TAK)+- C.−−R ′2. Zatímco sulfoniumylidy, například v Johnson – Corey – Chaykovského reakce používá se k syntéze oxirane, jsou někdy nakresleny dvojnou vazbou C = S, např. R2S = CR ′2, ylidická vazba uhlík-síra je vysoce polarizovaná a je lépe popsána jako iontová. Sulfoniumylidy jsou klíčové meziprodukty synteticky použitelných Stevensův přesmyk. Thiokarbonylylidy (RR'C = S+- C.−−RR ′) může vzniknout otevřením kruhu thiiranes, fotocyklizace arylvinylsulfidů,[23] stejně jako jinými procesy.
Sulfurany a persulfurany
Sulfurany jsou relativně specializované funkční skupiny, které jsou čtyřmocný, hypervalentní sloučeniny síry, se vzorcem SR4[24] a podobně persulfurany jsou šestimocný SR6. Celouhlíkové šestimocné komplexy byly známy pro těžší představitele chalkogen skupina, například sloučenina hexamethylpertelluran (Te (Me)6) byl objeven v roce 1990[25] reakcí tetramethyltelluria s xenon difluorid TeF2(CH3)4 následuje reakce s dimethylzinek. Sírový analog hexamethylpersulfuran (S (CH3)6) byla předpovězena jako stabilní[26] ale dosud nebyl syntetizován.
Vůbec první all-uhlík persulfuran, který byl ve skutečnosti syntetizován v laboratoři, má dva methyl a dva bifenyl ligandy:[27]
Připravuje se z odpovídajícího síranu 1 s xenon difluorid / fluorid boritý v acetonitril na síraanylovou skupinu 2 následuje reakce s methyllithium v tetrahydrofuran na (stabilní) persulfuran 3 jako cis izomer. Rentgenová difrakce ukazuje C − S délky vazby v rozmezí od 189 do 193 hodin (delší než standardní délka vazby) se zkresleným centrálním atomem síry oktaedrická molekulární geometrie.
Počítačová simulace naznačuje, že tyto vazby jsou velmi polární a negativní náboje zůstávají na uhlíku.
Přirozeně se vyskytující organosírové sloučeniny
Ne všechny sloučeniny síry jsou páchnoucí znečišťující látky. Penicilin a cefalosporin jsou život zachraňující antibiotika, odvozené od hub. Gliotoxin je síra mykotoxiny produkováno několika druhy hub, které jsou předmětem šetření, jako antivirové činidlo. Sloučeniny jako alicin a ajoene jsou zodpovědní za zápach česnek, a lenthionin přispívá k chuti houby shiitake. Těkavé organické sloučeniny síry také přispívají k jemným chuťovým vlastnostem víno, ořechy, čedar, čokoláda, káva a příchutě tropického ovoce.[28] Mnoho z těchto přírodních produktů má také důležité léčivé vlastnosti, jako je prevence destička agregace nebo boj proti rakovině.
Ve znečištění
Většina organických sloučenin síry v životním prostředí se přirozeně vyskytuje, což je důsledkem skutečnosti, že síra je nezbytná pro život a že tento prvek obsahují dvě aminokyseliny (cystein a methionin).
Některé sloučeniny síry v životním prostředí jsou generovány jako vedlejší produkty průmyslových procesů, jako je výroba plastů a pneumatik.
Vybranými procesy vytvářejícími pachy jsou organické sloučeniny síry vyrobené koksováním uhlí určené k vytlačení sirných sloučenin a jiných těkavých nečistot za účelem výroby „čistého uhlíku“ (Kola ), který se primárně používá k výrobě oceli.
Ve fosilních palivech
Pachy vyskytují se také v chemikálie zpracování uhlí nebo ropa na prekurzorové chemikálie (suroviny) pro následné průmyslové použití (např. plasty nebo farmaceutická výroba) a všudypřítomné potřeby ropné destilace pro benziny, nafta a další stupně topné oleje Výroba.
Organické sloučeniny síry lze chápat jako aromatické kontaminující látky, které je třeba odstranit ze zemního plynu před komerčním použitím, z výfukových komínů a výdechů před vypuštěním. V tomto posledně uvedeném kontextu lze říci, že organosírové sloučeniny představují škodlivé látky v síře kyselý déšť, nebo ekvivalentně, jsou to znečišťující látky v rámci nejběžnějších fosilních paliv, zejména uhlí.
Nejběžnější organosírovou sloučeninou přítomnou ve všech ropných frakcích je thiofen (C4H4S), cyklická a aromatická kapalina. Kromě toho obsahují těžké frakce oleje benzothiofen (C8H6S, thianaphtene) a dibenzothiofen. Většina posledních sloučenin jsou pevné látky a voní jako naftalen. V motorové naftě a topných olejích je přítomno mnoho methylovaných, dimethyl-, diethylbenzothiofenových derivátů, jejichž čištění je proto velmi obtížné.
Všechny tyto heterocyklické sulfidy tvoří 200–500 ppm přírodního paliva, silně substituované dibenzothiofeny zůstávají po HDS a tvoří 10–20 ppm. Tyto molekuly se také nacházejí v uhlí a před spotřebou musí být vyloučeny.
Redukovaný molybden společně s niklem se v současné době používá k eliminaci thiofenů z ropy (HDS) díky své vysoké afinitě k síře. Kromě toho se wolfram spolu s niklem a kobaltem používá pro hydrodesulfurizace (HDS) ve velkých rafinériích. Adsorpční mechanismus thiofenu na přechodné kovy je navržen nastat v systému π, kde organosírová sloučenina leží téměř rovnoběžně s kovovým povrchem. Mnoho vědců zaměřuje své úsilí na optimalizaci oxidačního stavu přechodných kovů pro HDS, jako je Cu (I ) a Ag (II), které se společně s Pd (0) ukázaly být specifičtější pro vazbu π s thiofeny všeho druhu.
Základ pro zápach
Lidé a jiná zvířata mají k činu mimořádně citlivý čich zápach nízkovalentních organosírových sloučenin, jako jsou thioly, sulfidy a disulfidy. Vonné těkavé thioly jsou produkty rozkladu bílkovin, které se nacházejí v hnilobných potravinách, proto je pro zabránění intoxikace zásadní citlivá identifikace těchto sloučenin. Nízkovalentní těkavé sloučeniny síry se vyskytují také v oblastech, kde jsou nízké hladiny kyslíku ve vzduchu, což představuje riziko udušení. Bylo zjištěno, že měď je vyžadována pro vysoce citlivou detekci určitých těkavých thiolů a příbuzných organosírových sloučenin čichovými receptory u myší. Zda lidé také potřebují měď pro citlivou detekci thiolů, zatím není známo.[29]
Reference
- ^ Block, E. (1978). Reakce organosírových sloučenin. Akademický tisk. ISBN 0-12-107050-6.
- ^ Martin, J. C .; Arhart, R. J .; Franz, J. A .; Perozzi, E. F .; Kaplan, L. J. "Bis [2,2,2-trifluor-l-fenyl-l- (trifluormethyl) ethoxy] difenylsulfan". Organické syntézy. 57: 22. doi:10.15227 / orgsyn.057.0022.
- ^ Organická chemie IUPAC Blue Book. Pravidla C-5: Sloučeniny obsahující bivalentní síru http://www.acdlabs.com/iupac/nomenclature/79/r79_25.htm
- ^ Organická chemie IUPAC Blue Book. Doporučení R-5.7.1.3.4 Thiokarboxylové a thiokarbonové kyseliny.[1]
- ^ Příručka chemie a fyziky (81. vydání). CRC Press. ISBN 0-8493-0481-4.
- ^ Suter, C. M .; Maxwell, Charles E. „Fenoxthin [Phenoxathiin]“. Organické syntézy. 18: 64. doi:10.15227 / orgsyn.018.0064.; Kolektivní objem, 2, str. 485
- ^ Cremlyn, R. J. (1996). Úvod do chemie organosíry. Chichester: John Wiley and Sons. ISBN 0-471-95512-4.
- ^ García Ruano, J. L .; Cid, M. B .; Martín Castro, A. M .; Alemán, J. (2008). „Acyklický S,S-Dialkylsulfimides ". In Kambe, N. (ed.). Science of Synthesis. 39. Thieme. str. 352–375. ISBN 978-1-58890-530-7.
- ^ Drabowicz, J .; Lewkowski, J .; Kudelska, W .; Girek, T. (2008). "S,S-Dialkylsulfoximides ". In Kambe, N. (ed.). Science of Synthesis. 39. Thieme. str. 154–173. ISBN 978-1-58890-530-7.
- ^ Drabowicz, J .; Lewkowski, J .; Kudelska, W .; Girek, T. (2008). "S,S-Dialkylsulfonediimines ". In Kambe, N. (ed.). Science of Synthesis. 39. Thieme. 173–180. ISBN 978-1-58890-530-7.
- ^ Zhang, Y .; Hogg, N. (2005). "S-Nitrosothioly: tvorba a transport buněk ". Volný radikál. Biol. Med. 38 (7): 831–838. doi:10.1016 / j.freeradbiomed.2004.12.016. PMID 15749378.
- ^ Braverman, S .; Cherkinsky, M .; Levinger, S. (2008). „Alkylsulfur Trihalides“. V Kambe, N. (ed.). Science of Synthesis. 39. Thieme. 187–188. ISBN 978-1-58890-530-7.
- ^ Sheppard, W. A. (1962). "Arylsulfur Pentafluorides". J. Am. Chem. Soc. 84: 3064–3072. doi:10.1021 / ja00875a006.
- ^ Drabowicz, J .; Lewkowski, J .; Kudelska, W .; Girek, T. (2008). "Dialkylsulfur Tetrahalogenidy". V Kambe, N. (ed.). Science of Synthesis. 39. Thieme. str. 123–124. ISBN 978-1-58890-530-7.
- ^ Moltzen, E. K .; Klabunde, K. J .; Senning, A. (1988). „Uhlík monosulfid: recenze“. Chem. Rev. 88 (2): 391. doi:10.1021 / cr00084a003.
- ^ Pötter, B .; Seppelt, K. (1984). „Trifluoroethylidynesulfur Trifluoride, F3C-C≡SF3". Angew. Chem. Int. Vyd. Engl. 23 (2): 150. doi:10,1002 / anie.198401501.
- ^ Buschmann, J .; Damerius, R .; Gerhardt, R .; Lentz, D .; Luger, P .; Marschall, R .; Preugschat, D .; Seppelt, K .; Simon, A. (1992). „(Trifluorethylidýn) trifluorid síry, F3CC≡SF3: dvě struktury v pevné fázi a reaktivita jako karben “. J. Am. Chem. Soc. 114 (24): 9465. doi:10.1021 / ja00050a027.
- ^ Gerhardt, R .; Gerlbig, T .; Buschamann, J .; Luger, P .; Seppelt, K. (1988). „SF5- Jednotka jako skupina chránící steric; Syntéza a struktura F5S − C≡SF3". Angew. Chem. Int. Vyd. Engl. 27 (11): 1534. doi:10,1002 / anie.198815341.
- ^ Schreiner, P .; Reisenauer, H .; Romanski, J .; Mloston, G. (2009). „Formální trojná vazba uhlík-síra: H − C≡S − O − H“. Angew. Chem. Int. Vyd. Engl. 48 (43): 8133–8136. doi:10.1002 / anie.200903969. PMID 19768827.
- ^ Organická chemie IUPAC Blue Book. C-6 Sulfurhalogenidy, sulfoxidy, sulfony a kyseliny síry a jejich deriváty http://www.acdlabs.com/iupac/nomenclature/79/r79_26.htm
- ^ Braverman, S .; Cherkinsky, M .; Levinger, S. (2008). "Alkansulfinové kyseliny a soli". V Kambe, N. (ed.). Science of Synthesis. 39. Thieme. str. 196–211. ISBN 978-1-58890-530-7.
- ^ Drabowicz, J .; Kiełbasiński, P .; Łyżwa, P .; Zając, A .; Mikołajczyk, M. (2008). "Alkanesulfenic Acids". V Kambe, N. (ed.). Science of Synthesis. 39. Thieme. str. 550–557. ISBN 978-1-58890-530-7.
- ^ Schultz, A. G .; DeTar, M. B. (1976). „Thiokarbonylylidy. Fotogenerace, přesmyk a cykloadiční reakce“. J. Am. Chem. Soc. 98: 3564–3572. doi:10.1021 / ja00428a029.
- ^ Martin, J. C .; Arhart, R. J .; Franz, J. A .; Perozzi, E. F .; Kaplan, L. J. „Bis [2,2,2-trifluor-l-fenyl-l- (trifluormethyl) ethoxy] difenylsulfan“. Organické syntézy. 57: 22. doi:10.15227 / orgsyn.057.0022.; Kolektivní objem, 6, str. 163
- ^ Ahmed, Latif; Morrison, John A. (1990). "Syntéza a charakterizace hexamethyltelluria (VI)". J. Am. Chem. Soc. 112 (20): 7411–7413. doi:10.1021 / ja00176a061.
- ^ Fowler, J. E.; Schaefer, H.F., III; Raymond, K. N. (1996). „S6 Konformátoři skupiny bodů hexamethylchalkogenu: Já6S, já6Já, já6Te ". Inorg. Chem. 35 (2): 279–281. doi:10.1021 / ic940240d.
- ^ Sato, S .; Matsunaga, K .; Horn, E .; Furukawa, N .; Nabeshima, T. (2006). „Izolace a molekulární struktura organopersulfuranů [12-S-6 (C6)]“. J. Am. Chem. Soc. 128 (21): 6778–6779. doi:10.1021 / ja060497r.
- ^ Qian, M. C .; Fan, X .; Mahattanatawee, K., eds. (2011). Těkavé sloučeniny síry v potravinách. ACS Symposium Series 1068. American Chemical Society. doi:10.1021 / bk-2011-1068. ISBN 978-0-8412-2616-6.
- ^ Duan, X .; Block, E .; Li, Z .; Connelly, T .; Zhang, J .; Huang, Z .; Su, X .; Pan, Y .; Wu, L .; Chi, Q .; Thomas, S .; Zhang, S .; Ma, M .; Matsunami, H .; Chen, G.-Q .; Zhang, H. (2012). „Zásadní role mědi při detekci odorantů koordinujících kovy“. Proc. Natl. Acad. Sci. USA. 109: 3492–3497. Bibcode:2012PNAS..109.3492D. doi:10.1073 / pnas.1111297109. PMC 3295281. PMID 22328155.










