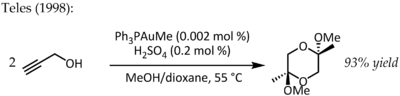Organická chemie zlata - Organogold chemistry
Organická chemie zlata je studium sloučenin obsahujících zlato –uhlík vazby. Jsou studovány v akademickém výzkumu, ale jinak se jim nedostalo širokého využití. Dominantní oxidační stavy pro sloučeniny organického zlata jsou I s koordinační číslo 2 a lineární molekulární geometrie a III s CN = 4 a a čtvercová planární molekulární geometrie.[1][2][3] První objevenou organogoldovou sloučeninou byl karbid zlata (I) Au2C2, který byl poprvé připraven v roce 1900.[4]
Zlato (I)
Komplexy zlata (I) jsou 2-souřadnicové, lineární, diamagnetický, 14 druhů elektronů.[1][2][3] Obvykle existují jako adukty LAuR jako ligand L, například trifenylfosfin nebo isokyanid. Ligand brání redukci Au (I) na kovový Au (0) dimerizací organického zbytku. Zlato (I) může také existovat jako aurovat M [auR2] ( jedl komplex ), přičemž kation je obvykle vybaven komplexotvorným činidlem pro zlepšení stability. AuR2− anion je také lineární stejně jako ostatní M (d10) druhy jako Hg (Me)2 a Pd (já)22+. Je známo, že se tvoří zlato acetylidy (schopné vytvářet polymerní struktury), karbeny a carbynes[Citace je zapotřebí ]. Klasická metoda přípravy LAuR sloučenin je reakcí a Grignardovo činidlo se zlatým (I) halogenidem. Následná reakce s organolithium R-Li tvoří jedlý komplex.
Ve speciální skupině sloučenin, an aryl atom uhlíku funguje jako most mezi dvěma atomy zlata. Jedna taková sloučenina, (MesAu)5, vzniká při reakci mezi Au (CO) Cl a mezityl Grignard. Uhlík lze koordinovat se zlatem až do hodnoty 6. Sloučeniny typu C (AuL)4 jsou isolobal s metanem a látkami typu C (AuL)5+ isolobal s methaniovým iontem. Tyto hyperkoordinované shluky organogoldů jsou často stabilizovány aurofilní interakce mezi formálně uzavřenými středy zlata.[5]
 Některé typické druhy organogold s různými způsoby vazby.
Některé typické druhy organogold s různými způsoby vazby.
Kyanidové sloučeniny zlata (MAu (CN)2) mají určitý význam pro kyanidace zlata, proces těžby zlata z nekvalitní rudy. Vazba uhlík na kov v kyanidech kovů je obvykle iontová, ale existují důkazy, že vazba C-Au v iontu kyanidu zlata je kovalentní.[6]
Zlato (III)
Zlaté (III) komplexy jsou 4 souřadnicové, čtvercové rovinné, diamagnetický, toxický, 16 druhů elektronů. Když je formální koordinační číslo menší než 4, mohou to ligandy, jako je chlor, vynahradit vytvořením můstkového ligandu. Intramolekulární chelatace je další strategie. Obecně jsou sloučeniny zlata (III) toxické, a proto jsou méně studované než zlato (I). Monoarylgold (III) komplexy jsou jednou dobře studovanou třídou komplexů. Často se připravují přímou elektrofilní aurací arenů pomocí AuCl3.[7] Homoleptické komplexy tetraalkylaurátu (III) (např. Li [AuMe4]) jsou také dobře charakterizovány.[8]
Zlatá katalýza
Obecné úvahy
Zlato katalyzované reakce spadají do dvou hlavních kategorií: heterogenní katalýza včetně katalyzátorů zlaté nanočástice (např. Au / TiO2) a zlaté povrchy monovrstvy thiol a katalyzátory na nosiči z oxidu hlinitého, včetně Au / CeO na nosiči z oxidu hlinitého2. Tyto katalyzátory byly zkoumány pro průmyslově důležité procesy, jako je oxidace alkoholů, oxidace oxidu uhelnatého (CO) a různé selektivní hydrogenační reakce (např. Butadien na buten). Ačkoli jsou často účinné a vykazují užitečné nebo jedinečné selektivity, existuje značná nejistota, pokud jde o mechanismus procesů katalyzovaných různými heterogenními katalyzátory zlata, dokonce ve srovnání s jinými heterogenními katalyzátory na bázi přechodných kovů.
V porovnání, homogenní katalýza se zlatem používá jednoduché nebo ligandem vázané sloučeniny zlata (I) nebo zlata (III), které jsou rozpustné v organických rozpouštědlech a používají se k syntéze čistých chemikálií v organické chemii.[9][10] Binární halogenidy zlata a jednoduché komplexy, včetně chlorid zlatý, chlorid zlatý, a kyselina chloraurová, byly použity jako komplexy. Tyto zdroje zlata však rychle způsobují špatně definované a snadno deaktivovatelné (redukcí na Au0) aktivní katalyzátory v roztoku. Vývoj dobře definovaných komplexů zlata (I) vázaného na fosfin nebo NHC byl důležitým pokrokem a vedl k významnému zvýšení zájmu o syntetické aplikace katalýzy zlata. Komplexy ligovaného zlata (I) se obvykle připravují a skladují jako stabilní (ale nereaktivní) chloridy na stole, LAuCl, např. chlor (trifenylfosfin) zlato (I), které se obvykle aktivují pomocí halogenidové abstrakce solemi stříbra, jako jsou AgOTf, AgBF4nebo AgSbF6 pro generování kationtového druhu zlata (I).[11][12] Ačkoli koordinačně nenasycený komplex "LAu+„je teoreticky generován ze směsi LAuCl / AgX, přesná povaha kationtového druhu zlata a role stříbrné soli zůstává poněkud sporná.[13][14][15] The odst-nitrobenzoát, bistriflimid a určité nitrilové komplexy představují katalyticky aktivní, ale izolovatelné preventivní látky neobsahující stříbro.
Kationtové zlato (I) tvoří s komplexy π alken nebo alkyn dluhopisy, v návaznosti na Dewar – Chatt – Duncansonův model. Zlato rozhodně není jediným kovem vykazujícím tento typ vazby a reaktivity, několika kovovými ionty isolobal s jednoduchým protonem (tj. prázdným s-orbitálem) také: například rtuť (II) a platina (II). Elektrofilní ionty a komplexy, jako jsou tyto, se silným sklonem k tvorbě komplexů π jsou obecně známé jako pi (π) -kyseliny (viz také: interakce kation – pi ).[16]
Komplexy zlata (I) -alkenu a -alkinu jsou elektrofilní a náchylné k nukleofilním útokům. v oxymercuration výsledné organokovové sloučeniny jsou generovány stechiometricky a vyžaduje další krok k uvolnění produktu. V případě zlata protonolýza vazby Au-C uzavírá katalytický cyklus a umožňuje koordinaci jiného substrátu. Mezi praktické výhody katalýzy zlata (I) patří: 1) stabilita vzduchu (kvůli vysokému oxidačnímu potenciálu Au (I)), 2) tolerance vůči náhodné vlhkosti (kvůli jeho nízké oxofilitě) a 3) relativně nízká toxicita ve srovnání s jiné pi-kyseliny (např. Pt (II) a Hg (II)). Chemicky komplexy Au (I) obvykle nepodléhají oxidaci na vyšší oxidační stavy a Au (I) -alkyly a -vinyly nejsou náchylné k eliminaci p hydridu.[17]
 Typický mechanismus pro hydrofunkcionalizaci alkynů a allenů katalyzovaných zlatem (I).
Typický mechanismus pro hydrofunkcionalizaci alkynů a allenů katalyzovaných zlatem (I).
Historický vývoj
V roce 1976 Thomas a spolupracovníci ohlásili konverzi fenylacetylen na acetofenon použitím kyselina tetrachloroaurová v 37% výtěžku.[18] V této reakci bylo zlato (III) použito jako homogenní katalyzátor, který nahradil rtuť v oxidační reakci. Stejná studie uvádí publikovaný výtěžek> 150%, což naznačuje katalýzu, kterou chemici možná neuznali.
V roce 1991 Utimoto reagoval na zlato (III) (NaAuCl4) s alkyny a vodou.[19] Teles identifikoval hlavní nevýhodu této metody, protože Au (III) byl rychle redukován na katalyticky mrtvé kovové zlato a v roce 1998 se vrátil k tématu Au (I) podporovaného ligandem pro stejnou transformaci:[20]
Tato konkrétní reakce prokázala fantastickou katalytickou účinnost a v nadcházejících letech by vyvolala příval výzkumu v použití komplexů fosfin-zlato (I) pro aktivaci více vazeb C-C.[21] I přes nižší stabilitu komplexů zlata (III) za katalytických podmínek, jednoduchý AuCl3 Bylo také zjištěno, že je v některých případech účinným katalyzátorem. Například Hashmi ohlásil AuCl3-katalyzovaný alkyn / furan Diels-Alderova reakce - typ cykloadice, který se běžně nevyskytuje - pro syntézu 2,3-disubstituovaného fenoly:[22]
Další mechanistické studie docházejí k závěru, že se nejedná o společnou transformaci, ale spíše o počáteční alkynovou hydroarylaci, po které následuje řada nepostřehnutelných intramolekulárních přesmyků, zakončená 6π elektrocyklizací a rearomatizací.
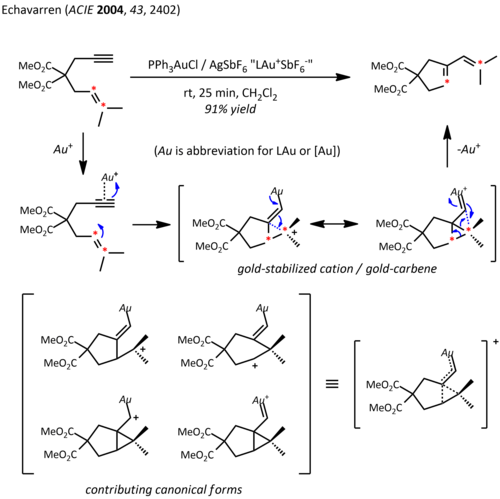
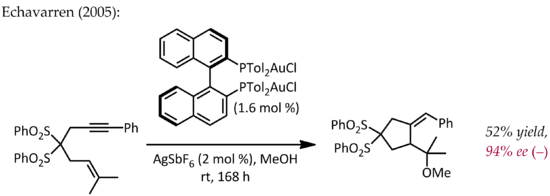
Relativistické účinky jsou významné v chemii organického zlata kvůli velkému jadernému náboji kovu (Z = 79). V důsledku relativisticky rozšířeného 5d orbitalů může fragment LAu stabilizovat sousední karbokation prostřednictvím darování elektronů do prázdného místa str- orbitální typ. Kromě očekávané reaktivity podobné karbokationtu tedy tyto kationy také vykazují významný karbenový charakter, vlastnost, která se využívá při katalytických transformacích, jako je cyklopropanace a inzerce CH.[23] Propargylestery mohou sloužit jako prekurzory kationtových meziproduktů zlato-vinylkarbenu, které mohou společně reagovat s alkeny za vzniku produktu cyklopropanace. Použití chirálního ligandu ((R) -DTBM-SEGPHOS ) vedlo k dobré až vynikající úrovni enantioselektivity.[24]

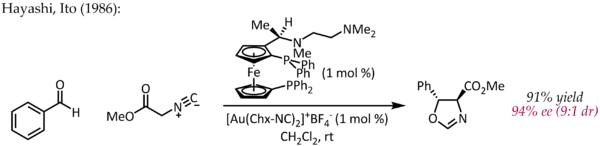
Ačkoli Echavarren poprvé popsal přípravu chirálních komplexů bisfosfindigoldu (I) pro enantioselektivní katalýzu zlata probíhající pomocí typického pi-aktivačního mechanismu,[25] raný, atypický příklad enantioselektivní katalýzy zlatem popsali Hayashi a Ito v roce 1986.[26] V tomto procesu benzaldehyd a methylisokyanoacetát podstoupit cyklizaci v přítomnosti a chirální ferrocenylfosfinový ligand a komplex bis (isokyanid) zlato (I) za vzniku chirální látky oxazolin. Vzhledem k tomu, že oxazoliny lze hydrolyzovat za vzniku 1,2-aminoalkoholu, představuje tato reakce první příklad katalytického, asymetrický aldolová reakce.
Na rozdíl od ostatních výše popsaných reakcí tato reakce nezahrnuje aktivaci dvojné nebo trojné vazby C-C zlatem. V jednoduchém mechanickém obrazu se zlato (I) současně koordinuje se dvěma fosfinovými ligandy a uhlíkovou isokyanátovou skupinou [27] který je poté napaden karbonylovou skupinou. Další studie režimu vazby Au (I) naznačují, že tento jednoduchý obrázek bude možná nutné revidovat.
Heterogenní katalýza zlata je starší věda. Zlato je atraktivní kov, který se používá díky své stabilitě proti oxidaci a rozmanitosti v morfologii zlatý klastr materiály. Ukázalo se, že zlato je účinné při nízkoteplotní oxidaci CO a acetylenové chloraci na vinylchloridy. Přesná povaha katalytického místa v tomto typu procesu je diskutována.[28] Představa, že zlato může katalyzovat reakci, neznamená, že je to jediný způsob. Jiné kovy však mohou levně vykonávat stejnou práci, zejména v posledních letech železo (viz chemie organického železa ).
Zlato katalyzované reakce
I když to nemá žádný komerční význam, zlato katalyzuje mnoho organických transformací, obvykle tvorbu vazeb uhlík-uhlík z Au (I), a tvorbu vazeb CX (X = O, N) ze stavu Au (III), kvůli tvrdší Lewisově kyselosti tohoto iontu . Během uplynulého desetiletí několik studií prokázalo, že zlato může účinně katalyzovat křížové vazebné reakce C-C a C-heteroatom, které probíhají cyklem Au (I) / Au (III).[29] Hong C. Shen shrnul homogenní reakce tvořící cyklické sloučeniny do 4 hlavních kategorií:[30]
- heteroatom nukleofilní adice na nenasycené C-C vazby, zejména za vzniku malých heterocyklů (furany, pyrroly, thiofeny)
- Hydroarylace: v zásadě a Friedel-Craftsova reakce za použití komplexů kov-alkiny. Příklad reakce mesitylen s fenylacetylen:[31]
- Zejména cyklizace Enyne cykloisomerizace jedním z prvních příkladů je cykloizomerizace 5-exo-dig 1,6 enynu:[32]
- cykloadiční reakce s časným příkladem cykloadice a nitrilooxid s alkynem.[33]
Dalšími reakcemi jsou použití zlata v Aktivace vazby C – H[34] a aldolové reakce. Zlato také katalyzuje vazebné reakce.[35]
Omezení
Zatímco hydrofunkcionalizace alkynů, allenů a allylalkoholů katalyzovaná zlatem[36] vyskytuje se snadno za relativně mírných podmínek, neaktivní alken zůstává ve většině případů špatným substrátem,[37] z velké části kvůli rezistenci meziproduktových komplexů alkylgold (I) k protodeauraci.[38] Vývoj intermolekulárních transformací katalyzovaných zlatem také zaostával za vývojem intramolekulárních transformací.[39]
Reference
- ^ A b Elschenbroich, C. a Salzer, A. (1992) Organometallics: Stručný úvod. Wiley-VCH: Weinheim. ISBN 3-527-28165-7
- ^ A b Parish, R. V. (1997). "Chemie organického zlata: II reakce". Zlatý bulletin. 30 (2): 55–62. doi:10.1007 / BF03214757.
- ^ A b Parish, R. V. (1998). "Chemie organického zlata: III aplikace". Zlatý bulletin. 31: 14–21. doi:10.1007 / BF03215470.
- ^ Mathews, J. A .; Watters, L. L. (01.05.2002). „Karbid zlata“. Journal of the American Chemical Society. 22 (2): 108–111. doi:10.1021 / ja02040a010.
- ^ Schmidbaur, Hubert; Schier, Annette (05.12.2011). „Aurofilní interakce jako předmět současného výzkumu: aktuální“. Recenze chemické společnosti. 41 (1): 370–412. doi:10.1039 / C1CS15182G. ISSN 1460-4744. PMID 21863191.
- ^ Wang, X. B .; Wang, Y. L .; Yang, J .; Xing, X. P .; Li, J .; Wang, L. S. (2009). „Důkazy o významném kovalentním bondingu v Au (CN)2−". Journal of the American Chemical Society. 131 (45): 16368–70. doi:10.1021 / ja908106e. PMID 19860420.
- ^ Kharasch, M. S .; Isbell, Horace S. (01.01.1931). „Chemie sloučenin organického zlata. III. Přímé zavedení zlata do aromatického jádra (předběžné sdělení)“. Journal of the American Chemical Society. 53 (8): 3053–3059. doi:10.1021 / ja01359a030. ISSN 0002-7863.
- ^ Rice, Gary W .; Tobias, R. Stuart. (1975-10-01). „Syntéza tetramethylaurátu (III). Struktury dimethylaurátu lithného a tetramethylaurátu lithného v roztoku“. Anorganická chemie. 14 (10): 2402–2407. doi:10.1021 / ic50152a020. ISSN 0020-1669.
- ^ Zlatá katalýza pro organickou syntézu F. Dean Toste (redaktor) Tematická série v otevřeném přístupu Beilstein Journal of Organic Chemistry
- ^ Raubenheimer, H. G .; Schmidbaur, H. (2014). „Pozdní start a úžasný vzestup v chemii zlata“. Journal of Chemical Education. 91 (12): 2024–2036. Bibcode:2014JChEd..91.2024R. doi:10.1021 / ed400782p.
- ^ Ranieri, Beatrice; Escofet, Imma; Echavarren, Antonio M. (2015-06-24). „Anatomie zlatých katalyzátorů: fakta a mýty“. Org. Biomol. Chem. 13 (26): 7103–7118. doi:10.1039 / c5ob00736d. ISSN 1477-0539. PMC 4479959. PMID 26055272.
- ^ Wang, Yi-Ming; Lackner, Aaron D .; Toste, F. Dean (2013-11-14). „Vývoj katalyzátorů a ligandů pro enantioselektivní katalýzu zlata“. Účty chemického výzkumu. 47 (3): 889–901. doi:10,1021 / ar400188g. PMC 3960333. PMID 24228794.
- ^ Zhdanko, Alexander; Maier, Martin E. (09.09.2015). „Vysvětlení„ Stříbrných efektů “ve zlato (I) katalyzované hydroalkoxylaci alkylů“. ACS katalýza. 5 (10): 5994–6004. doi:10.1021 / acscatal.5b01493.
- ^ Homs, Anna; Escofet, Imma; Echavarren, Antonio M. (2013). „O efektu stříbra a vzniku komplexů digoldů přemostěných chloridy“. Organické dopisy. 15 (22): 5782–5785. doi:10.1021 / ol402825v. PMC 3833279. PMID 24195441.
- ^ Wang, Dawei; Cai, Rong; Sharma, Sripadh; Jirak, James; Thummanapelli, Sravan K .; Achmedov, Novruz G .; Zhang, Hui; Liu, Xingbo; Petersen, Jeffrey L. (2012-05-18). ""Stříbrný efekt „v katalýze zlata (I): přehlédnutý důležitý faktor“. Journal of the American Chemical Society. 134 (21): 9012–9019. doi:10.1021 / ja303862z. PMID 22563621.
- ^ Fürstner, A .; Davies, P. W. (2007). „Katalytická karbofilní aktivace: katalýza platinami a zlatými π kyselinami“. Angewandte Chemie International Edition. 46 (19): 3410–3449. doi:10.1002 / anie.200604335. PMID 17427893.
- ^ Shen, H. C. (2008). „Nedávný pokrok v syntéze heterocyklů a karbocyklů prostřednictvím homogenní katalýzy zlata. Část 1: Heteroatomové adiční a hydroarylační reakce alkynů, allenů a alkenů“. Čtyřstěn. 64 (18): 3885–3903. doi:10.1016 / j.tet.2008.01.081.
- ^ Norman, R. O. C .; Parr, W. J. E .; Thomas, C. B. (1976). "Reakce alkynů, cyklopropanů a benzenových derivátů se zlatem (III)". Journal of the Chemical Society, Perkin Transactions 1 (18): 1983. doi:10.1039 / P19760001983.
- ^ Fukuda, Y .; Utimoto, K. (1991). "Efektivní transformace neaktivních alkynů na ketony nebo acetály za použití zlatého (III) katalyzátoru". The Journal of Organic Chemistry. 56 (11): 3729–3731. doi:10.1021 / jo00011a058.
- ^ Teles, J. H .; Brode, S .; Chabanas, M. (1998). „Komplexy kationtového zlata (I): Vysoce účinné katalyzátory pro přidávání alkoholů k alkynům“. Angewandte Chemie International Edition. 37 (10): 1415–1418. doi:10.1002 / (SICI) 1521-3773 (19980605) 37:10 <1415 :: AID-ANIE1415> 3.0.CO; 2-N. PMID 29710887.
- ^ Nugent, W. A. (2012). ""Akce Black Swan „v organické syntéze“. Angewandte Chemie International Edition. 51 (36): 8936–49. doi:10,1002 / anie.201202348. PMID 22893229.
- ^ Hashmi, A. S. K .; Frost, T. M .; Bats, J. W. (2000). „Vysoce selektivní syntéza arenu katalyzovaná zlatem“. Journal of the American Chemical Society. 122 (46): 11553–11554. doi:10.1021 / ja005570d.
- ^ Gorin, David J .; Toste, F. Dean (2007). "Relativistické účinky při homogenní katalýze zlata". Příroda. 446 (7134): 395–403. Bibcode:2007Natur.446..395G. doi:10.1038 / nature05592. PMID 17377576.
- ^ Johansson, Magnus J .; Gorin, David J .; Staben, Steven T .; Toste, F. Dean (2005-11-30). „Stereoselektivní cyklopropanace olefinů katalyzovaná zlatem (I)“. Journal of the American Chemical Society. 127 (51): 18002–18003. doi:10.1021 / ja0552500. PMID 16366541.
- ^ Muñoz, M. Paz; Adrio, Javier; Carretero, Juan Carlos; Echavarren, Antonio M. (12. 2. 2005). „Ligandové efekty v cyklizaci Enynes katalyzované zlatem a platinou: chirální zlaté komplexy pro enantioselektivní alkoxycyklizaci“. Organometallics. 24 (6): 1293–1300. doi:10.1021 / om0491645.
- ^ Ito, Y .; Sawamura, M .; Hayashi, T. (1986). „Katalytická asymetrická aldolová reakce: Reakce aldehydů s isokyanoacetátem katalyzovaná chirálním komplexem ferrocenylfosfin-zlato (I)“. Journal of the American Chemical Society. 108 (20): 6405–6406. doi:10.1021 / ja00280a056.
- ^ Togni, A .; Pastor, S. D. (1990). „Chirální kooperativita: Povaha diastereoselektivního a enantioselektivního kroku v aldolové reakci katalyzované zlatem (I) za použití chirálních ferrocenylaminových ligandů“. The Journal of Organic Chemistry. 55 (5): 1649–1664. doi:10.1021 / jo00292a046.
- ^ Hutchings, G. J .; Brust, M .; Schmidbaur, H. (2008). „Zlato - úvodní perspektiva“. Recenze chemické společnosti. 37 (9): 1759–65. doi:10.1039 / b810747p. PMID 18762825.
- ^ Nijamudheen, A .; Datta, Ayan (2020). „Zlato-katalyzované křížové vazební reakce: Přehled návrhových strategií, mechanistických studií a aplikací“. Chemistry: A European Journal. 26: 1442–1487. doi:10.1002 / chem.201903377. Citovat má prázdný neznámý parametr:
|1=(Pomoc) - ^ Shen, H. C. (2008). „Nedávný pokrok v syntéze karbocyklů a heterocyklů prostřednictvím homogenní katalýzy zlata. Část 2: Cyklizace a cykloadice“. Čtyřstěn. 64 (34): 7847–7870. doi:10.1016 / j.tet.2008.05.082.
- ^ Reetz, M. T .; Sommer, K. (2003). "Zlato katalyzovaná hydrolylace alkynů". European Journal of Organic Chemistry. 2003 (18): 3485–3496. doi:10.1002 / ejoc.200300260.
- ^ Nieto-Oberhuber, C .; Muñoz, M. P .; Buñuel, E .; Nevado, C .; Cárdenas, D. J .; Echavarren, A. M. (2004). „Komplexy kationtového zlata (I): Vysoce alkynofilní katalyzátory pro exo- a endo-cyklizaci Enynes“. Angewandte Chemie International Edition. 43 (18): 2402–2406. doi:10.1002 / anie.200353207. PMID 15114573.
- ^ Gasparrini, F .; Giovannoli, M .; Misiti, D .; Natile, G .; Palmieri, G .; Maresca, L. (1993). „Gold (III) -catalyzed one-pot syntéza isoxazolů z terminálních alkynů a kyseliny dusičné“. Journal of the American Chemical Society. 115 (10): 4401–4402. doi:10.1021 / ja00063a084.
- ^ Hoffmann-Röder, A .; Krause, N. (2005). "Zlatá brána do katalýzy". Organická a biomolekulární chemie. 3 (3): 387–91. doi:10.1039 / b416516k. PMID 15678171.
- ^ Wegner, H. A .; Auzias, M. (2011). „Zlato pro spojovací reakce CC: katalyzátor švýcarské armády?“. Angewandte Chemie International Edition. 50 (36): 8236–47. doi:10,1002 / anie.201101603. PMID 21818831.
- ^ Bandini, Marco (01.02.2011). „Allylické alkoholy: udržitelné zdroje pro katalytické enantioselektivní alkylační reakce“. Angewandte Chemie International Edition. 50 (5): 994–995. doi:10,1002 / anie.201006522. ISSN 1521-3773. PMID 21268189.
- ^ Zhang, Zhibin; Lee, Seong Du; Widenhoefer, Ross A. (2009-04-22). „Intermolekulární hydroaminace ethylenu a 1-alkenů cyklickými močovinami katalyzovanými achirálními a chirálními komplexy zlata“. Journal of the American Chemical Society. 131 (15): 5372–5373. doi:10.1021 / ja9001162. ISSN 0002-7863. PMC 2891684. PMID 19326908.
- ^ LaLonde, Rebecca L .; Jr., William E. Brenzovich; Benitez, Diego; Tkatchouk, Ekaterina; Kelley, Kotaro; III, William A. Goddard; Toste, F. Dean (2010). „Alkylgoldové komplexy intramolekulární aminoaurací neaktivních alkenů“. Chemická věda. 1 (2): 226. doi:10.1039 / C0SC00255K. PMC 3866133. PMID 24358445.
- ^ Muratore, Michael E .; Homs, Anna; Obradors, Carla; Echavarren, Antonio M. (01.11.2014). „Zvládání výzvy mezimolekulárního zlata (I) katalyzovaného cykloadicí alkynů a allenů“. Chemistry: An Asian Journal. 9 (11): 3066–3082. doi:10,1002 / asia.201402395. ISSN 1861-471X. PMC 4676923. PMID 25048645.