Methyllithium - Methyllithium
 | |
| Jména | |
|---|---|
| Název IUPAC Methyllithium | |
| Ostatní jména Methanid lithný | |
| Identifikátory | |
3D model (JSmol ) | |
| 3587162 | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.011.843 |
| Číslo ES |
|
| 288 | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| CH3Li | |
| Molární hmotnost | 21.98 g · mol−1 |
| Reaguje | |
| Nebezpečí | |
| Hlavní nebezpečí | Hořlavý, reaguje s vodou |
| NFPA 704 (ohnivý diamant) | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Methyllithium je nejjednodušší organolithné činidlo s empirickým vzorcem CH3Li. Tento s-blok organokovový sloučenina přijímá oligomerní struktura jak v roztoku, tak v pevném stavu. Tato vysoce reaktivní sloučenina, vždy používaná jako roztok v ethery, je činidlo v organická syntéza stejně jako organokovová chemie. Operace zahrnující methyllithium vyžadují bezvodé podmínky, protože sloučenina je vysoce reaktivní voda. Kyslík a oxid uhličitý jsou také nekompatibilní s MeLi. Methyllithium se obvykle nepřipravuje, ale kupuje se jako roztok v různých etherech.
Syntéza
V přímé syntéze methylbromid je ošetřeno suspenzí lithium v diethylether.
- 2 Li + MeBr → LiMe + LiBr
The bromid lithný tvoří komplex s methyllithiem. Většina komerčně dostupného methyllithia se skládá z tohoto komplexu. Methyllithium bez halogenidů se připravuje z methylchloridu.[1] Chlorid lithný vysráží se z diethyletheru, protože netvoří silný komplex s methyllithiem. Filtrát sestává z poměrně čistého methyllithia.
Reaktivita
Methyllithium je silně základní a velmi nukleofilní kvůli částečnému zápornému náboji uhlík a je proto zvláště reaktivní vůči akceptorům elektronů a donorům protonů. Na rozdíl od n-BuLi, MeLi reaguje jen velmi pomalu THF při pokojové teplotě a roztoky v éter jsou neomezeně stabilní. Voda a alkoholy reagují prudce. Většina reakcí zahrnujících methyllithium se provádí při teplotě místnosti. Přestože MeLi lze použít k deprotonaci, n-butyllithium se běžněji používá, protože je levnější a reaktivnější.
Methyllithium se používá hlavně jako syntetický ekvivalent methyl aniontu synthon. Například ketony reagují za vzniku terciárních alkoholů ve dvoustupňovém procesu:
- Ph2CO + MeLi → Ph2C (já) OLi
- Ph2C (Me) OLi + H+ → Ph2C (Me) OH + Li+
Nekovové halogenidy se převádějí na methylové sloučeniny s methyllithiem:
- PCl3 + 3 MeLi → PMe3 + 3 LiCl
Takové reakce běžně využívají Grignardova činidla methylmagnesiumhalogenidy, které jsou často stejně účinné a levnější nebo snadněji připravitelné in situ.
Reaguje také s oxid uhličitý dát Octan lithný:
- CH3Li + CO2 → CH3CO2−Li+
Přechodný kov methylové sloučeniny lze připravit reakcí MeLi s halogenidy kovů. Obzvláště důležité jsou formování organické sloučeniny mědi (Gilmanova činidla ), z nichž nejužitečnější je lithium dimethylcuprate. Toto činidlo je široce používáno pro nukleofilní substituce epoxidy, alkylhalogenidy a alkylsulfonáty, jakož i pro konjugované adice na a, p-nenasycené karbonylové sloučeniny methylovým aniontem.[2] Bylo připraveno mnoho dalších methylových sloučenin přechodného kovu.[3]
- ZrCl4 + 6 MeLi → Li2ZrMe6 + 4 LiCl
Struktura
Dvě struktury byly ověřeny monokrystalem Rentgenová krystalografie stejně jako 6Li, 7Li a 13C NMR spektroskopie. Tetramerická struktura je zkreslená shluk kubánského typu, s atomy uhlíku a lithia v alternativních rozích. Vzdálenosti Li --- Li jsou 2,68 Å, téměř identické s vazbou Li-Li v plynném skupenství dilithium. Vzdálenosti C-Li jsou 2,31 Å. Uhlík je vázán na tři atomy vodíku a tři atomy Li. Nestálost (MeLi)4 a jeho nerozpustnost v alkanech vyplývá ze skutečnosti, že klastry interagují prostřednictvím dalšího klastru agostické interakce. Naproti tomu objemnější shluk (terciární butylLi)4, kde interakce mezi klastry jsou vyloučeny stérickými účinky, jsou těkavé a také rozpustné v alkanech.[4]
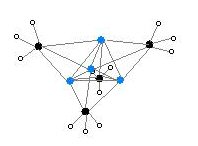
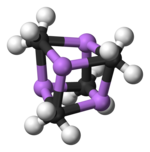

Barevný kód: Li - fialová C - černá H - bílá
Hexamerická forma obsahuje opět šestihranné hranoly s atomy Li a C v alternativních rozích.
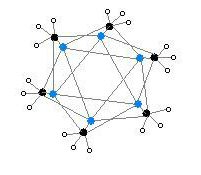

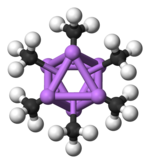
Barevný kód: Li - fialová C - černá H - bílá
Stupeň agregace, „n“ pro (MeLi)n, závisí na rozpouštědle a přítomnosti přísad (jako je bromid lithný). Uhlovodíková rozpouštědla, jako je benzen[5] upřednostněte tvorbu hexameru, zatímco éterický rozpouštědla upřednostňují tetramer.
Lepení
Tyto klastry jsou považovány za „elektronově deficitní“, to znamená, že se neřídí oktetové pravidlo protože molekulám chybí dostatek elektronů k vytvoření čtyř 2-středových 2-elektronových vazeb kolem každého atomu uhlíku, na rozdíl od většiny organické sloučeniny. Hexamer je 30 elektronová sloučenina (30 valenčních elektronů.) Pokud jeden alokuje 18 elektronů pro silné vazby C-H, 12 elektronů zůstane pro vazbu Li-C a Li-Li. Existuje šest elektronů pro šest vazeb kov-kov a jeden elektron na methyl-η3 interakce lithia.
Síla vazby C-Li byla odhadnuta na přibližně 57 kcal / mol z IR spektroskopická měření.[5]
Reference
- ^ Lusch, M. J .; Phillips, W. V .; Sieloff, R. F .; Nomura, G. S .; House, H. O. (1984). „Příprava methyllithia s nízkým obsahem halogenidů“. Organické syntézy. 62: 101.; Kolektivní objem, 7, str. 346
- ^ Lipshutz, B. H .; Sengupta, S. (1992). „Organocopper Reagents: Substitution, Carbo / Metallocupration, and Other Reactions“. Organické reakce. 41. str. 135–631. doi:10.1002 / 0471264180.nebo 041.02. ISBN 9780471264187.
- ^ Morse, P. M .; Girolami, G. S. (1989). „Jsou d0 ML6 Komplexy vždy oktaedrické? Struktura rentgenového záření trigonálně-hranolové [Li (tmed)]2[ZrMe6]". Journal of the American Chemical Society. 111 (11): 4114–4116. doi:10.1021 / ja00193a061.
- ^ Elschenbroich, C. (2006). Organometallics. Weinheim: Wiley-VCH. ISBN 978-3-527-29390-2.
- ^ A b Brown, T. L .; Rogers, M. T. (1957). "Příprava a vlastnosti krystalických lithiových alkylů". Journal of the American Chemical Society. 79 (8): 1859–1861. doi:10.1021 / ja01565a024.

