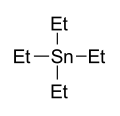Organická chemie cínu - Organotin chemistry

Organotin sloučeniny nebo stannanes jsou chemické sloučeniny na základě cín s uhlovodík substituenty. Organická chemie cínu je součástí širšího pole organokovová chemie. První organickou sloučeninou cínu byl diethyltin dijodid ((C.2H5)2SnI2), objeven Edward Frankland v roce 1849.[1] Tato oblast rychle rostla ve 20. letech 20. století, zejména po objevení Grignardova činidla, které jsou užitečné pro výrobu vazeb Sn-C. Tato oblast zůstává bohatá na mnoho aplikací v průmyslu a pokračující činnost ve výzkumné laboratoři.[2]
Struktura organocínových sloučenin
Organické sloučeniny cínu jsou obecně klasifikovány podle jejich oxidačních stavů. Sloučeniny cínu jsou mnohem běžnější a užitečnější.
Organické deriváty cínu (IV)
Tetraorganické deriváty jsou vždy čtyřboká. Sloučeniny typu SnRR'RR ' byly rozděleny na jednotlivé enantiomery.[3]
Organotinhalogenidy
Chloridy organocínu mají vzorec R.4−nSnCln pro hodnoty n až 3. Bromidy, jodidy a fluoridy jsou také známé, ale méně důležité. Tyto sloučeniny jsou známé pro mnoho R skupin. Vždy jsou čtyřboká. Tri- a dihalogenidy tvoří adukty s dobrými Lewisovými bázemi, jako jsou pyridin. Fluoridy mají tendenci se sdružovat tak, že dimethyltin difluorid tvoří listové polymery. Di- a zejména triorganotinhalogenidy, např. tributylcínchlorid vykazují toxicitu blížící se toxicitě kyanovodík.[4]
Organotin hydridy
Organotinhydridy mají vzorec R.4−nSnHn pro hodnoty n až 4. Mateřský člen této série, stannane (SnH4), je nestabilní bezbarvý plyn. Stabilita koreluje s počtem organických substituentů. Tributylcín hydrid se používá jako zdroj hydridového radikálu v některých organických reakcích.
Oxidy a hydroxidy organocínu
Oxidy a hydroxidy organocínu jsou běžnými produkty hydrolýzy halogenidů organocínu. Na rozdíl od odpovídajících derivátů křemíku a germania si oxidy a hydroxidy cínu často osvojují struktury s penta- nebo dokonce hexakoordinovanými centy cínu, zejména pro diorgano- a monoorganické deriváty. Skupina Sn-O-Sn se nazývá a stannoxan. Strukturálně nejjednodušší z oxidů a hydroxidů jsou deriváty triorganotinu. Komerčně důležitým hydroxidem triorganotinu je akaricid Cyhexatin (také nazývaný Plictran), (C6H11 )3SnOH. Takové hydroxidy triorganotinu existují v rovnováze s distannoxany:
- 2 R.3SnOH ⇌ R3SnOSnR3 + H2Ó
S pouhými dvěma organickými substituenty na každém středu Sn jsou oxidy a hydroxidy diorganotinu strukturně složitější než triorganové deriváty.[5] Jednoduché geminální dioly (R.2Sn (OH)2) a monomerní stannanony (R.2Sn = O) nejsou známy. Oxidy diorganotinu (R.2SnO) jsou polymery, kromě případů, kdy jsou organické substituenty velmi objemné, v tomto případě cyklické trimery nebo v případě R = CH (SiMe3)2 dimery, se Sn3Ó3 a Sn2Ó2 prsteny. Distannoxany existují jako dimery dimerů se vzorcem [R2SnX]2Ó2 kde skupiny X (např. chlorid, hydroxid, karboxylát) mohou být koncové nebo můstkové (viz tabulka). Hydrolýza trihalogenidů monoorganotinů má potenciál generovat kyseliny stannanoové, RSnO2H. Pokud jde o oxidy / hydroxidy diorganotinu, tvoří se druhy monoorganotinů strukturně složitě kvůli výskytu dehydratace / hydratace, agregace. Ilustrativní je hydrolýza butylcín trichloridu za vzniku [(BuSn)12Ó14(ACH)6]2+.
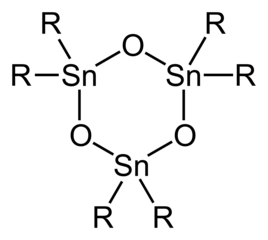
Idealizovaná struktura trimerického oxidu diorganotinu.

Kuličkový model pro (t-Bu2SnO)3.

Struktura oxidu diorganotinu, zdůrazňující rozsáhlou intermolekulární vazbu.
Hyperkoordinované stannany
Na rozdíl od analogů uhlíku (IV), ale poněkud jako sloučeniny křemíku, může být také cín (IV) koordinovaný na pět a dokonce šest atomů místo běžných čtyř. Tyto hyperkoordinované sloučeniny obvykle mají elektronegativní substituenty. Četné příklady hypervalence poskytují organocínoxidy a související karboxyláty a příbuzné deriváty pseudohalogenidů.[5] Halogenidy organocinu pro adukty, např. Mě2SnCl2(bipyridin ).
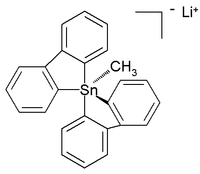
All-organické penta- a hexaorganostannates byly dokonce charakterizovány,[6] zatímco v následujícím roce byla hlášena šest koordinovaná sloučenina tetraorganotinu.[7] Krystalová struktura stabilní při pokojové teplotě (v argon ) all-carbon pentaorganostannane was report as the lithium sůl s touto strukturou:[8]
V tomto zkresleném trigonální bipyramidová struktura uhlík na cín délky vazby (2.26 A apikální, 2,17 Å ekvatoriální) jsou větší než běžné vazby C-Sn (2,14 Å) odrážející jeho hypervalentní Příroda.
Triorganotinové kationty
Některé reakce halogenidů triorganotinu implikují roli meziproduktů R3Sn +. Tyto kationy jsou analogické k karbokationty. Byly charakterizovány krystalograficky, když jsou organické substituenty velké, jako je 2,4,6-triisopropylfenyl.[9]
Cínové radikály (organické deriváty cínu (III))
Cínové radikály vzorce R3Sn, jsou voláni stannylové radikály.[2] Jsou vyvolávány jako meziprodukty v určitých reakcích přenosu atomů. Například, tributylcín hydrid (tri-n-butylstannan) slouží jako užitečný zdroj "atomů vodíku" kvůli stabilitě radikálu tributytinu.[10]
Organické deriváty cínu (II)
Sloučeniny organotinu (II) jsou poněkud vzácné. Sloučeniny s empirickým vzorcem SnR2 jsou poněkud křehké a existují jako kruhy nebo polymery, když R není objemný. Polymery, tzv polystannanes, mít vzorec (SnR2)n.
V zásadě lze očekávat, že sloučeniny dvojmocného cínu budou formovat analogy alkenů dvojná vazba. Sloučeniny vzorce Sn2R4, volala distannenes, jsou známé pro určité organické substituenty. Centra Sn bývají vysoce pyramidální. Monomerní sloučeniny vzorce SnR2, analogy karbeny jsou také známy v několika případech. Jedním příkladem je Sn (SiR3)2, kde R je velmi objemný CH (SiMe3)2 (Me = methyl). Tyto druhy po krystalizaci reverzibilně dimerizují na distannylen:[11]
- 2 R.2Sn ⇌ (R.2Sn)2
Stannenes, sloučeniny s dvojnými vazbami cín-uhlík, jsou příklady derivátů stannabenzen. Stannoles, strukturní analogy z cyklopentadien, vykazují malý charakter dvojné vazby C-Sn.
Organické deriváty cínu (I)
Sloučeniny Sn (I) jsou vzácné a pozorují se pouze s velmi objemnými ligandy. Jedna prominentní rodina klecí je přístupná pyrolýzou 2,6-diethylfenylem substituovaného tristannylenu [Sn (C6H3-2,6-Et2)2]3, který poskytuje shluk kubánského typu a a hranolový. Tyto klece obsahují Sn (I) a mají vzorec [Sn (C6H3-2,6-Et2)]n kde n = 8, 10.[12] A stannyne obsahuje uhlík na cín trojná vazba a distannyn trojná vazba mezi dvěma atomy cínu (RSnSnR). Distannynes existují pouze pro extrémně objemné substituenty. Na rozdíl od alkyny, jádro C-Sn-Sn-C těchto distannynes je nelineární, i když jsou rovinné. Vzdálenost Sn-Sn je 3,066 (1) Å a úhly Sn-Sn-C jsou 99,25 (14) °. Takové sloučeniny se připravují redukcí objemných halogenidů aryltinu (II).[13]

Příprava organociničitých sloučenin
Organické sloučeniny cínu lze syntetizovat mnoha způsoby.[14] Klasická je reakce a Grignardovo činidlo například s halogenidy cínu chlorid cínatý. Příklad poskytuje syntéza tetraethyltinu:[15]
- 4 EtMgBr + SnCl4 → Et4Sn + 4 MgClBr
Symetrické tetraorganotinové sloučeniny, zejména tetraalkylové deriváty, lze poté převést na různé směsné chloridy redistribuční reakce (v případě organociničitých sloučenin také známý jako „Kocheshkovova poměrnost“):
- 3 R.4Sn + SnCl4 → 4 R.3SnCl
- R4Sn + SnCl4 → 2 R2SnCl2
- R4Sn + 3 SnCl4 → 4 RSnCl3
Související metoda zahrnuje redistribuci halogenidů cínu s organoaluminiové sloučeniny.
Směsné organohalogenové sloučeniny cínu lze převést na směsné organické deriváty, jak je znázorněno syntézou dibutyldivinyltinu:[16]
- Bu2SnCl2 + 2 ° C2H3MgBr → Bu2Sn (C.2H3)2 + 2 MgBrCl
Organocínové hydridy jsou generovány redukcí směsných alkylchloridů. Například léčba dibutylcíndichlorid s lithiumaluminiumhydrid dává dibutylcín dihydrid, bezbarvý destilovatelný olej:[17]
The Jako Wurtz spojení alkyl sodné sloučeniny s halogenidy cínu se získá tetraorganotinové sloučeniny.
Hydrostannylace zahrnuje kovem katalyzované přidání hydridů cínu přes nenasycené substráty.[18]
Reakce organociničitých sloučenin
Důležité reakce, diskutované výše, se obvykle zaměřují na halogenidy organocínu a pseudohalogenidy s nukleofily. V oblasti organická syntéza, Stilleho reakce je považován za důležitý. Zahrnuje kopulační reakci s sp2-hybridizovanými organickými halogenidy katalyzovanými palladiem:
a organostananové přísady (nukleofilní přidání allyl-, allenyl- nebo propargylstannanů k aldehydům a iminům). Organocínové sloučeniny se také hojně používají v radikální chemie (např. radikální cyklizace, Barton-McCombieho odkysličení, Bartonova dekarboxylace, atd.).
Aplikace
Organická sloučenina cínu se komerčně používá jako stabilizátor v polyvinyl chlorid. V této funkci potlačují degradaci odstraněním allylchloridových skupin a absorpcí chlorovodíku. Tato aplikace ročně spotřebuje asi 20 000 tun cínu. Hlavní třídou organocínových sloučenin jsou diorganotin dithioláty vzorce R2Sn (SR ')2. Vazba Sn-S je reaktivní složka. Diorganotin karboxyláty, např. dibutylcíndilaurát, se používají jako katalyzátory pro tvorbu polyurethany pro vulkanizaci silikonů a transesterifikace.[2]
chlorid n-butylcín se používá při výrobě oxid cínatý vrstvy na skleněných lahvích o chemická depozice par.
Biologické aplikace
"Tributylciny "se používají jako průmyslové biocidy, např. jako antifungální látky v textilu a papíru, systémech na výrobu buničiny a papíru, v pivovarech a průmyslových chladicích systémech. Deriváty trifenyltinu se používají jako aktivní složky antifungálních barev a zemědělských fungicidů. Ostatní triorganotiny se používají jako miticidy a akaricidy. Tributylcínoxid byl široce používán jako konzervační prostředek na dřevo.[2]
Sloučeniny tributylcínu byly kdysi široce používány jako námořníbiologické znečištění agenti ke zlepšení efektivity zaoceánských lodí. Obavy z toxicity[19] těchto sloučenin (některé zprávy popisují biologické účinky na mořský život v koncentraci 1 nanogram na litr) vedlo k celosvětovému zákazu ze strany Mezinárodní námořní organizace.
Komplexy organotinu byly studovány v protinádorové terapii.[20]
- Organické sloučeniny cínu

Tetrabutylcin bezbarvý olej, prekurzor ostatních sloučenin butylcínu

Tributylcínoxid, bezbarvá až světle žlutá kapalina používaná v konzervace dřeva

Triphenyltinacetát, bělavá krystalická pevná látka, použitá jako insekticid a a fungicid

Trifenyltinchlorid, vysoce toxická bílá pevná látka, používaná jako biocid

Trimethyltinchlorid, toxická bílá pevná látka, jednou použitá jako biocid

Hydroxid trifenyltinu, téměř bílý prášek, používaný jako a fungicid

Azocyklotin, bílá pevná látka, používaná jako dlouhodobě působící akaricid pro ovládání roztoči na rostlinách
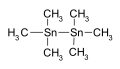
Hexamethylditin používá se jako meziprodukt v chemické syntéze
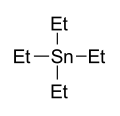
Tetraethyltin, bod varu 63–65 ° / 12 mm je katalyzátor[21]
Toxicita
Toxicita sloučenin derivátů tributylcinu a trifenyltinu je srovnatelná s toxicitou kyanovodík. Kromě tohon-alkyltiny jsou fytotoxický a proto nemohou být použity v zemědělství. V závislosti na organických skupinách mohou být silné baktericidy a fungicidy. Vzhledem k jejich vysoké bioaktivitě se „tributylciny“ kdysi používaly v mořských antivegetativních nátěrech.[2]
Na rozdíl od triorganotinových sloučenin jsou monoorganické, diorgano- a tetraorganotinové sloučeniny mnohem méně nebezpečné.[4]
DBT však může být imunotoxický.[22]
Viz také
Reference
- ^ Caseri, Walter (2014). "Počáteční organotinová chemie". Journal of Organometallic Chemistry. 751: 20–24. doi:10.1016 / j.jorganchem.2013.08.009.
- ^ A b C d E Davies, Alwyn George. (2004) Organotin Chemistry, 2. vydání Weinheim: Wiley-VCH. ISBN 978-3-527-31023-4
- ^ Gielen, Marcel (1973). "Od kinetiky po syntézu chirálních tetraorganotinových sloučenin". Acc. Chem. Res. 6 (6): 198–202. doi:10.1021 / ar50066a004.
- ^ A b G. G. Graf (2005). "Cín, slitiny cínu a sloučeniny cínu". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a27_049.
- ^ A b Chandrasekhar, Vadapalli; Nagendran, Selvarajan; Baskar, Viswanathan (2002). "Sestavy organotinu obsahující vazby Sn / O". Recenze koordinační chemie. 235: 1–52. doi:10.1016 / S0010-8545 (02) 00178-9.
- ^ Reich, Hans J .; Phillips, Nancy H. (1986). "Lithium-metaloidové výměnné reakce. Pozorování komplexů lithium-pentaalkyl / aryl-cín-ate". J. Am. Chem. Soc. 108 (8): 2102–2103. doi:10.1021 / ja00268a067.
- ^ V. G. Kumar Das; Lo Kong Mun; Chen Wei; Thomas C. W. Mak (1987). "Syntéza, spektroskopická studie a rentgenová krystalová struktura bis [3- (2-pyridyl) -2-thienyl-C, N] difenyltinu (IV): První příklad šestikoordinované tetraorganotinové sloučeniny". Organometallics. 6: 10–14. doi:10.1021 / om00144a003.
- ^ Masaichi Saito; Sanae Imaizumi; Tomoyuki Tajima; Kazuya Ishimura & Shigeru Nagase (2007). "Syntéza a struktura pentaorganostanátu s pěti uhlíkovými substituenty". J. Am. Chem. Soc. 129: 10974–10975. doi:10.1021 / ja072478 +. PMID 17705378.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ T. V. RajanBabu, P. C. B. Page B. R. Buckley „Tri-n-butylstanan“ v encyklopedii e-EROS reagencií pro organickou syntézu, 2004. doi:10.1002 / 047084289X.rt181.pub2
- ^ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Anorganická chemie, přeloženo Eaglesonem, Mary; Brewer, William, San Diego / Berlin: Academic Press / De Gruyter, ISBN 0-12-352651-5
- ^ Sita, Lawrence R. (1994). „Organická chemie těžkých kovů: Budování s cínem“. Acc. Chem. Res. 27 (7): 191–197. doi:10.1021 / ar00043a002.
- ^ Moc, Philip P. (2007). "Vazba a reaktivita těžších analogových skupin 14 elementů Alkyně". Organometallics. 26 (18): 4362–4372. doi:10.1021 / om700365p.
- ^ Sander H.L. Thoonen; Berth-Jan Deelman; Gerard van Koten (2004). „Syntetické aspekty tetraorganotinů a halogenidů organocinu (IV)“ (PDF). Journal of Organometallic Chemistry (689): 2145–2157.
- ^ Der Kerk, G. J. M. Van; Luijten, J. G. A. (1956). "Tetraethyltin". Org. Synth. 36: 86ff. doi:10.15227 / orgsyn.036.0086.
- ^ Seyferth, Dietmar (1959). „Di-n-butyldivinyltin“. Org. Synth. 39: 10. doi:10.15227 / orgsyn.039.0010.
- ^ „Organokovové syntézy: sloučeniny nepřechodného kovu“ John Eisch, Ed. Academic Press: New York, 1981. ISBN 0122349504.
- ^ Smith, Nicholas D .; Mancuso, John; Lautens, Mark (2000). „Hydrostanace katalyzované kovem“. Chemické recenze. 100 (8): 3257–3282. doi:10.1021 / cr9902695. PMID 11749320.
- ^ Gajda, M .; Jancso, A. (2010). "Organotiny, tvorba, použití, speciace a toxikologie". Kovové ionty v biologických vědách. Cambridge: Publikování RSC. 7, Organometallics in environment and toxicology: 111–151. doi:10.1039/9781849730822-00111. ISBN 9781847551771.
- ^ S. Gómez-Ruiz; et al. (2008). "Studium cytotoxické aktivity komplexů di a trifenyltin (IV) karboxylát". Journal of Anorganic Biochemistry. 102 (12): 2087–96. doi:10.1016 / j.jinorgbio.2008.07.009. PMID 18760840.
- ^ Organické syntézy, Sb. Sv. 4, str. 881 (1963); Sv. 36, str. 86 (1956). Odkaz
- ^ C Gumy; et al. (2008). „Dibutyltin narušuje funkci glukokortikoidových receptorů a zhoršuje potlačení produkce cytokinů vyvolané glukokortikoidy“. PLOS ONE. 3 (10): e3545. Bibcode:2008PLoSO ... 3.3545G. doi:10,1371 / journal.pone.0003545. PMC 2568824. PMID 18958157.






![Stilleho reakční schéma { displaystyle { ce {{R-X} + R'-SnR''3 -> [{ ce {Pd katalyzátor}}] {R-R '} + XSnR''3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/16d2a781e9a7142312c1fd6052ce33fc93f0814a)