Kostní morfogenetický protein - Bone morphogenetic protein
Kostní morfogenetické proteiny (BMP) jsou skupina růstové faktory také známý jako cytokiny a jako metabologeny.[1] Původně objeveny jejich schopností vyvolat vznik kost a chrupavka BMP jsou nyní považovány za skupinu stěžejních morfogenetických signálů, které organizují tkáňovou architekturu v celém těle.[2] Důležité fungování signálů BMP ve fyziologii je zdůrazněno množstvím rolí pro dysregulovanou signalizaci BMP v patologických procesech. Rakovinové onemocnění často zahrnuje nesprávnou regulaci signalizačního systému BMP. Absence signalizace BMP je například důležitým faktorem v progresi rakoviny tlustého střeva,[3] a naopak, nadměrná aktivace signalizace BMP po indukci refluxem ezofagitida provokuje Barrettův jícen a je tedy nástrojem při vývoji adenokarcinom v proximální části gastrointestinální trakt.[4]
Rekombinantní lidské BMP (rhBMP) se používají v ortopedické aplikace jako spinální fúze, odbory a orální chirurgie. rhBMP-2 a rhBMP-7 jsou Úřad pro kontrolu potravin a léčiv (FDA) - schváleno pro některá použití. rhBMP-2 způsobuje více přerostlé kosti než jakékoli jiné BMP a je široce používán mimo označení.
Lékařské použití
BMP pro klinické použití se vyrábějí za použití rekombinantní DNA technologie (rekombinantní lidské BMP; rhBMP). Rekombinantní BMP-2 a BMP-7 jsou v současné době schváleny pro humánní použití.[5]
rhBMP se používají při orálních operacích.[6][7][8] BMP-7 také nedávno našel použití při léčbě chronické onemocnění ledvin (ČKD). U myší zvířecích modelů bylo prokázáno, že BMP-7 zvrátí ztrátu glomeruli kvůli skleróza.
Použití mimo označení
Ačkoli se rhBMP-2 a rhBMP-7 používají při léčbě různých stavů souvisejících s kostmi, včetně spinální fúze a odbory, rizika tohoto off-label léčby nejsou pochopena.[9] Zatímco rhBMP jsou schváleny pro specifické aplikace (spinální lumbální fúze s předním přístupem a tibiální neuniony), až 85% veškerého použití BMP je mimo označení.[9] rhBMP-2 se hojně používá v jiných technikách bederní páteřní fúze (např. pomocí zadního přístupu, předního nebo zadního krční fúze[9]).
Alternativa k autotransplantátu u dlouhých kostí
V roce 2001 Úřad pro kontrolu potravin a léčiv (FDA) schválil rhBMP-7 (aka OP-1; Stryker Biotech ) pro humanitární výjimka pro zařízení jako alternativa k autograft u dlouhých kostí[9] V roce 2004 byla výjimka z humanitárního zařízení rozšířena jako alternativa k autotransplantátu pro posterolaterální fúzi.[9] V roce 2002 byl rhBMP-2 (vyluhován; Medtronic ) byl schválen pro přední bederní fúze mezi těly (ALIF) pomocí zařízení pro bederní fúzi.[9] V roce 2008 byla schválena oprava posterolaterálních beder pseudartróza, otevřeno holenní kost zlomeniny dříku s intramedulární hřebík fixace.[9] V těchto produktech jsou BMP dodávány do místa zlomeniny začleněním do kostního implantátu a uvolňovány postupně, aby umožnily tvorbu kostí, protože stimulace růstu pomocí BMP musí být lokalizována a udržována po několik týdnů. BMP jsou eluovány čištěným kolagen matrice, která je implantována do místa zlomeniny.[5] rhBMP-2 pomáhá růst kostí lépe než kterýkoli jiný rhBMP, takže je klinicky mnohem více využíván.[5] O účinnosti rhBMP-2 při růstu kostí k dosažení spinální fúze se vedou „malé debaty nebo polemiky“,[5] a Medtronic generuje z jejich produktu roční tržby 700 milionů $.[10]
Kontraindikace
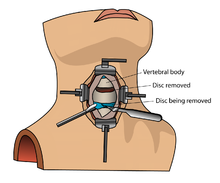
Kostní morfogenetický protein (rhBMP) by se neměl běžně používat u žádného typu fúze přední krční páteře, například při přední cervikální discektomie a fúze.[11] Existují zprávy o této terapii způsobující otok měkké tkáně což může způsobit život ohrožující komplikace potíže s polykáním a tlak na dýchací trakt.[11]
Funkce
BMP interagují se specifickými receptory na povrchu buněk, označovanými jako receptory kostního morfogenetického proteinu (BMPR).
Transdukce signálu prostřednictvím BMPR vede k mobilizaci členů SMAD rodina proteinů. Signální dráhy zahrnující BMP, BMPR a SMAD jsou důležité pro vývoj srdce, centrální nervové soustavy a chrupavky, stejně jako pro postnatální vývoj kostí.
Mají důležitou roli během embryonálního vývoje na embryonálním vzorování a rané tvorbě skeletu. Proto může narušení signalizace BMP ovlivnit plán těla vyvíjejícího se embrya. Například, BMP4 a jeho inhibitory člun ze dřeva a chordin pomáhají regulovat polaritu embrya (tj. vzorování zepředu dozadu). Konkrétně BMP-4 a jeho inhibitory hrají hlavní roli v neurulaci a rozvoji neurální deska. Signály BMP-4 ektoderm buňky se vyvinuly do kožních buněk, ale sekrece inhibitorů podkladovým mezodermem blokuje působení BMP-4, aby umožnila ektodermu pokračovat v normálním vývoji nervových buněk. Sekrece BMP střešní deskou ve vyvíjející se míše navíc pomáhá specifikovat dorzální senzorické interneurony.[12]
Jako člen nadrodiny transformujícího růstového faktoru-beta reguluje BMP signalizace řadu embryonálních vzorců během fetálního a embryonálního vývoje. Například signalizace BMP řídí časnou tvorbu Mullerianova kanálu (MD), což je tubulární struktura v časném stadiu embryonálního vývoje a nakonec se stane ženským reprodukčním traktem. Chemická inhibice signálů BMP u kuřecího embrya způsobila narušení invaginace MD a blokovala zesílení epitelu oblasti vytvářející MD, což naznačuje, že signály BMP hrají roli v časném vývoji MD.[13] Signalizace BMP se navíc podílí na tvorbě předního a zadního střeva,[14] vzorování střevních klků a diferenciace endokardu. Klky přispívají ke zvýšení účinné absorpce živin rozšířením povrchu v tenkém střevě. Zisk nebo ztráta funkce signalizace BMP změnila vzorování klastrů a výskyt klků v myším střevním modelu.[15] Signál BMP odvozený z myokardu se také podílí na diferenciaci endokardu během vývoje srdce. Inhibovaný signál BMP v embryonálním modelu zebrafish způsobil silné snížení endokardiální diferenciace, ale měl jen malý účinek na vývoj myokardu.[16] Kromě toho je přeslech Notch-Wnt-Bmp vyžadován pro radiální vzorování během vývoje kochley myší pomocí antagonizujícího způsobu.[17]
Mutace v BMP a jejich inhibitorech jsou spojeny s řadou lidských poruch, které ovlivňují kostru.
Několik BMP se také nazývá „morfogenetické proteiny odvozené z chrupavky“ (CDMP), zatímco jiné se označují jako „růstové diferenciační faktory `` (GDF).
BMP se také podílejí na adipogenezi a funkční regulaci tukové tkáně.[18] BMP4 upřednostňuje bílou adipogenezi, zatímco BMP7 aktivuje funkci hnědého tuku; Inhibitory BMP jsou rovněž zapojeny do tohoto nařízení [18]
Typy
Původně bylo objeveno sedm takových proteinů. Z nich šest (BMP2 až BMP7) patří k Nadrodina beta transformujícího růstového faktoru bílkovin. BMP1 je a metaloproteáza. Od té doby bylo objeveno dalších třináct BMP, které všechny patří do rodiny TGF-beta, a celkový počet je tedy dvacet.[5] Současná nomenklatura uznává pouze 13, protože mnoho dalších je místo toho pojmenováno podle faktoru diferenciace růstu.
| BMP | Známé funkce | Gene Locus |
|---|---|---|
| BMP1 | *BMP1 nepatří do rodiny proteinů TGF-β. Je to metaloproteáza na které působí prokolagen I, II a III. Podílí se na vývoji chrupavky. | Chromozom: 8; Umístění: 8p21 |
| BMP2 | Působí jako disulfid - propojené homodimer a indukuje tvorbu kostí a chrupavek. Je to kandidát jako retinoid prostředník. Hraje klíčovou roli v osteoblast diferenciace. | Chromozom: 20; Umístění: 20p12 |
| BMP3 | Indukuje tvorbu kostí. | Chromozom: 14; Umístění: 14p22 |
| BMP4 | Reguluje tvorbu zubů, končetin a kostí z mezoderm. Hraje také roli při opravách zlomenin, tvorbě epidermis, tvorbě osy dorsálně-ventrální osy a vývoji vaječníků. | Chromozom: 14; Umístění: 14q22-q23 |
| BMP5 | Provádí funkce při vývoji chrupavky. | Chromozom: 6; Umístění: 6p12.1 |
| BMP6 | Hraje roli v integritě kloubů u dospělých. Řídí homeostázu železa regulací hepcidin. | Chromozom: 6; Umístění: 6p12.1 |
| BMP7 | Hraje klíčovou roli v osteoblast diferenciace. Rovněž vyvolává produkci SMAD1. Klíčem je také vývoj a oprava ledvin. | Chromozom: 20; Umístění: 20q13 |
| BMP8a | Podílí se na vývoji kostí a chrupavek. | Chromozom: 1; Umístění: 1p35 – p32 |
| BMP8b | Vyjádřeno v hipokampus. | Chromozom: 1; Umístění: 1p35 – p32 |
| BMP10 | Může hrát roli v trabekulaci embryonálního srdce. | Chromozom: 2; Umístění: 2p14 |
| BMP11 | Řídí předozadní vzorování. | Chromozom: 12; Umístění: 12p |
| BMP15 | Může hrát roli v oocyt a folikulární rozvoj. | Chromozom: X; Umístění: Xp11.2 |

Dějiny
Od doby Hippokrates je známo, že kost má značný potenciál pro regeneraci a opravu. Nicholas Senn, chirurg na Rush Medical College v Chicagu, popsal užitečnost antiseptických odvápněných kostních implantátů při léčbě osteomyelitida a určité kostní deformity.[20] Pierre Lacroix navrhl, že by mohla existovat hypotetická látka, osteogenin, která by mohla zahájit růst kostí.[21]
Biologický základ morfogeneze kostí ukázal: Marshall R. Urist. Urist učinil klíčový objev, který demineralizoval, lyofilizován segmenty kosti vyvolaly novou tvorbu kostí, když byly implantovány do svalových vaků u králíků. Tento objev byl publikován v roce 1965 Uristem v Věda.[22] Urist navrhl ve vědecké literatuře v USA název „Bone Morphogenetic Protein“ Journal of Dental Research v roce 1971.[23]
Kostní indukce je sekvenční vícestupňová kaskáda. Klíčové kroky v této kaskádě jsou chemotaxe, mitóza, a diferenciace. Raná studia Hari Reddi odhalil sled událostí účastnících se morfogeneze kostí vyvolané kostní matricí.[24] Na základě výše uvedené práce se zdálo pravděpodobné, že morfogeny jsou přítomny v kostní matrici. Používání baterie biologické testy pro tvorbu kostí byla provedena systematická studie k izolaci a čištění domnělých kostních morfogenetických proteinů.
Hlavním kamenem úrazu při čištění byla nerozpustnost demineralizované kostní matrice. K překonání této překážky Hari Reddi a Kuber Sampath použili disociační extrakční činidla, například 4M guanidin HCL, 8M močovina nebo 1% BL.[25] Samotný rozpustný extrakt nebo nerozpustné zbytky nebyly schopné nové kostní indukce. Tato práce naznačuje, že optimální osteogenní aktivita vyžaduje synergii mezi rozpustným extraktem a nerozpustným kolagenním substrátem. Nejednalo se pouze o významný pokrok směrem ke konečnému čištění kostních morfogenetických proteinů laboratoří Reddi,[26][27] ale nakonec také umožnil klonování BMP John Wozney a kolegy z Genetics Institute.[28]
Společnost
Příklady a perspektiva v tomto článku jednají primárně se Spojenými státy a nepředstavují a celosvětový pohled subjektu. (Březen 2019) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
Náklady
Mezi AMERICKÉ DOLARY$ 6000 a 10 000 $ za typickou léčbu mohou být BMP nákladné ve srovnání s jinými technikami, jako je roubování kostí.[Citace je zapotřebí ] Tyto náklady jsou však často mnohem nižší než náklady požadované s ortopedické revize u více operací.
I když se málo diskutuje o tom, že rhBMP jsou klinicky úspěšné,[5] o jejich použití se vedou spory. Je běžné, že ortopedičtí chirurgové dostávají platby za jejich příspěvek k vývoji nového produktu,[29][30] ale někteří chirurgové odpovědní za původní studie účinnosti rhBMP-2 podporované společností Medtronic byli obviněni ze zaujatosti a střetu zájmů.[31] Například jeden chirurg, hlavní autor čtyř z těchto výzkumných prací, nezveřejnil žádné finanční vazby, zatímco se společností na třech z těchto článků;[32] společnost Medtronic mu zaplatila více než 4 miliony dolarů.[32] V jiné studii hlavní autor nezveřejnil žádné finanční vazby na Medtronic; společnost mu zaplatila nejméně 11 milionů dolarů.[32] V sérii 12 publikací medián finanční vazby autorů na Medtronic byly 12–16 milionů $.[33] V těchto studiích, které zahrnovaly více než 20 a 100 pacientů, měl jeden nebo více autorů finanční vazby ve výši 1 milion USD a 10 milionů USD.[33] Rané klinické studie využívající rhBMP-2 nebyly hlášeny nežádoucí účinky spojené s léčbou. Ve 13 původních průmyslově sponzorovaných publikacích týkajících se bezpečnosti nebyly zaznamenány žádné nežádoucí účinky u 780 pacientů.[33] Od té doby se ukázalo, že potenciální komplikace mohou nastat při použití, včetně posunutí implantátu, poklesu, infekce urogenitální příhody a retrográdní ejakulace.[32][33]
Na základě studie provedené na Katedře rodinného lékařství na Oregonské univerzitě pro zdraví a vědu se užívání BMP rychle zvýšilo, z 5,5% případů fúze v roce 2003 na 28,1% případů fúze v roce 2008. Použití BMP bylo vyšší u pacientů s předchozí chirurgický zákrok a mezi těmi, kteří mají složité fúzní postupy (kombinovaný přední a zadní přístup nebo více než 2 úrovně disku). Velké zdravotní komplikace, komplikace rány a 30denní míra rehospitalizace byly téměř totožné s BMP nebo bez BMP. Míra reoperace byla také velmi podobná, a to i po stratifikaci podle předchozí operace nebo chirurgické složitosti a po úpravě o demografické a klinické rysy. V průměru byly upravené nemocniční poplatky za operace zahrnující BMP přibližně o 15 000 USD vyšší než nemocniční poplatky za fúze bez BMP, ačkoli úhrada v rámci systému Medicare's Diagnosis-Related Group činila v průměru jen o 850 $ více. Významně méně pacientů léčených BMP bylo propuštěno do kvalifikovaného ošetřovatelského zařízení.[34]
Reference
- ^ Reddi AH, Reddi A (2009). "Kostní morfogenetické proteiny (BMP): od morfogenů po metabologeny". Hodnocení cytokinů a růstových faktorů. 20 (5–6): 341–2. doi:10.1016 / j.cytogfr.2009.10.015. PMID 19900831.
- ^ Bleuming SA, He XC, Kodach LL, Hardwick JC, Koopman FA, Ten Kate FJ, van Deventer SJ, Hommes DW, Peppelenbosch MP, Offerhaus GJ, Li L, van den Brink GR (září 2007). „Signalizace kostního morfogenetického proteinu potlačuje tumorigenezi v přechodových zónách žaludečního epitelu u myší“. Výzkum rakoviny. 67 (17): 8149–55. doi:10.1158 / 0008-5472.CAN-06-4659. PMID 17804727.
- ^ Kodach LL, Wiercinska E, de Miranda NF, Bleuming SA, Musler AR, Peppelenbosch MP, Dekker E, van den Brink GR, van Noesel CJ, Morreau H, Hommes DW, Ten Dijke P, Offerhaus GJ, Hardwick JC (květen 2008) . „Kostní morfogenetická proteinová dráha je inaktivována u většiny sporadických kolorektálních nádorů“. Gastroenterologie. 134 (5): 1332–41. doi:10.1053 / j.gastro.2008.02.059. PMID 18471510.
- ^ Milano F, van Baal JW, Buttar NS, Rygiel AM, de Kort F, DeMars CJ, Rosmolen WD, Bergman JJ, VAn Marle J, Wang KK, poslanec Peppelenbosch, Krishnadath KK (červen 2007). „Kostní morfogenetický protein 4 exprimovaný v ezofagitidě indukuje sloupovitý fenotyp v dlaždicových buňkách jícnu“. Gastroenterologie. 132 (7): 2412–21. doi:10.1053 / j.gastro.2007.03.026. PMID 17570215.
- ^ A b C d E F Dokonce J, Eskander M, Kang J (září 2012). "Kostní morfogenetický protein v chirurgii páteře: současné a budoucí použití". The Journal of the American Academy of Orthopedic Surgeons. 20 (9): 547–52. doi:10,5435 / JAAOS-20-09-547. PMID 22941797.
- ^ „Společnost Medtronic obdržela souhlas s uváděním kostních štěpů na trh pro určité orální maxilofaciální a zubní regenerační aplikace“. Citováno 19. ledna 2011.
- ^ Wikesjö UM, Qahash M, Huang YH, Xiropaidis A, Polimeni G, Susin C (srpen 2009). "Kostní morfogenetické proteiny pro periodontální a alveolární indikace; biologická pozorování - klinické důsledky". Ortodoncie a kraniofaciální výzkum. 12 (3): 263–270. doi:10.1111 / j.1601-6343.2009.01461.x. PMID 19627529. Archivovány od originál dne 05.01.2013.
- ^ Moghadam HG, Urist MR, Sandor GK, Clokie CM (březen 2001). "Úspěšná rekonstrukce dolní čelisti pomocí bioimplantátu BMP". The Journal of Craniofacial Surgery. 12 (2): 119–127. doi:10.1097/00001665-200103000-00005. PMID 11314620.
- ^ A b C d E F G Ong KL, Villarraga ML, Lau E, Carreon LY, Kurtz SM, Glassman SD (září 2010). „Off-label use of bone morphogenetic protein in the United States using administrative data“. Páteř. 35 (19): 1794–800. doi:10.1097 / brs.0b013e3181ecf6e4. PMID 20700081. S2CID 11664755.
- ^ John Fauber (2011-10-22). „Lékaři v časopise nezveřejnili riziko rakoviny páteře“. Milwaukee Journal Sentinel. Citováno 2013-05-12.
- ^ A b North American Spine Society (Únor 2013), „Pět věcí, které by lékaři a pacienti měli zpochybňovat“, Moudře vybírat: iniciativa Nadace ABIM, North American Spine Society, vyvoláno 25. března 2013, který cituje
- Schultz, Daniel G. (1. července 2008). „Oznámení o veřejném zdraví (zdravotnická zařízení) - Oznámení FDA o veřejném zdraví: Život ohrožující komplikace spojené s rekombinantním morfogenetickým proteinem lidské kosti v fúzi krční páteře“. fda.gov. Citováno 25. března 2014.
- Woo EJ (říjen 2012). „Rekombinantní morfogenetický protein lidské kosti 2: nežádoucí účinky hlášené do databáze zkušeností výrobce a uživatele zařízení“. The Spine Journal. 12 (10): 894–9. doi:10.1016 / j.spinee.2012.09.052. PMID 23098616.
- ^ Andrews, Madeline (19. září 2017). „BMP řídí přímou senzorickou interneuronovou identitu ve vyvíjející se míše pomocí signálních specifických nemorfogenních aktivit“. eLife. 6. doi:10,7554 / eLife.30647. PMC 5605194. PMID 28925352.
- ^ Yuji, Yoshiko (2016). „Včasná tvorba Mullerianova kanálu je regulována postupnými akcemi signalizace BMP / Pax2 a FGF / Lim1“. Rozvoj. 143 (19): 3549–3559. doi:10.1242 / dev.137067. PMID 27578782.
- ^ Mariana a kol. (2017). „Genomická integrace signálních souřadnic signálních koordinátů Wnt / β-katenin a BMP / Smad1 předních a zadních transkripčních programů“. Rozvoj. 144 (7): 1283–1295. doi:10.1242 / dev.145789. PMC 5399627. PMID 28219948.
- ^ Katherine a kol. (2016). "Villification in the mouse: Bmp sigals control intestine villus patterning". Rozvoj. 143 (3): 427–436. doi:10.1242 / dev.130112. PMC 4760312. PMID 26721501.
- ^ Sharina a kol. (2015). „Pro diferenciaci endokardu je vyžadována signalizace myokardu a BMP“. Rozvoj. 142 (13): 2304–2315. doi:10.1242 / dev.118687. PMID 26092845.
- ^ Vidhya a kol. (2016). „Přeslech Notch-Wnt-Bmp reguluje radiální vzorování v kochlei myši časoprostorovým způsobem“. Rozvoj. 143 (21): 4003–4015. doi:10.1242 / dev.139469. PMID 27633988.
- ^ A b Blázquez-Medela, Ana M .; Jumabay, Medet; Boström, Kristina I. (01.01.2019). „Beyond the bone: Bone morphogenetic protein signaling in adipose tkáň“. Recenze obezity. 20 (5): 648–658. doi:10.1111 / obr.12822. ISSN 1467-789X. PMC 6447448. PMID 30609449.
- ^ Ducy P, Karsenty G (2000). "Rodina kostních morfogenetických proteinů". Kidney Int. 57 (6): 2207–14. doi:10.1046 / j.1523-1755.2000.00081.x. PMID 10844590.
- ^ Senn N (1889). "O hojení aseptických kostních dutin implantací antiseptické odvápněné kosti". American Journal of the Medical Sciences. 98 (3): 219–243. doi:10.1097/00000441-188909000-00001.
- ^ Lacroix P (1945). "Nedávné vyšetřování růstu kostí". Příroda. 156 (3967): 576. Bibcode:1945Natur.156..576L. doi:10.1038 / 156576a0. S2CID 46630297.
- ^ Urist MR (Listopad 1965). "Kosti: tvorba autoindukcí". Věda. 150 (3698): 893–899. Bibcode:1965Sci ... 150..893U. doi:10.1126 / science.150.3698.893. PMID 5319761. S2CID 83951938.
- ^ Urist MR, Strates, Basil S. (1971). "Kostní morfogenetický protein". Journal of Dental Research. 50 (6): 1392–1406. doi:10.1177/00220345710500060601. PMID 4943222. S2CID 44381411.
- ^ Reddi AH, Huggins C (1972). „Biochemické sekvence při transformaci normálních fibroblastů u dospívajících potkanů“. Proc. Natl. Acad. Sci. USA. 69 (6): 1601–5. Bibcode:1972PNAS ... 69.1601R. doi:10.1073 / pnas.69.6.1601. PMC 426757. PMID 4504376.
- ^ Sampath TK, Reddi AH (prosinec 1981). „Disociační extrakce a rekonstituce složek extracelulární matrice podílejících se na lokální diferenciaci kostí“. Sborník Národní akademie věd Spojených států amerických. 78 (12): 7599–7603. Bibcode:1981PNAS ... 78,7599S. doi:10.1073 / pnas.78.12.7599. PMC 349316. PMID 6950401.
- ^ Sampath TK, Muthukumaran N, Reddi AH (říjen 1987). „Izolace osteogeninu, proteinu indukujícího kostní tkáň asociovaného s extracelulární matricí, pomocí afinitní chromatografie na heparinu“. Sborník Národní akademie věd Spojených států amerických. 84 (20): 7109–7113. Bibcode:1987PNAS ... 84.7109S. doi:10.1073 / pnas.84.20.7109. PMC 299239. PMID 3478684.
- ^ Luyten FP, Cunningham NS, Ma S, Muthukumaran N, Hammonds RG, Nevins WB, Woods WI, Reddi AH (srpen 1989). „Čištění a částečná aminokyselinová sekvence osteogeninu, proteinu, který iniciuje kostní diferenciaci“. The Journal of Biological Chemistry. 264 (23): 13377–13380. PMID 2547759.
- ^ Wozney JM, Rosen V, Celeste AJ, Mitsock LM, Whitters MJ, Kriz RW, Hewick RM, Wang EA (prosinec 1988). "Nové regulátory tvorby kostí: molekulární klony a aktivity". Věda. 242 (4885): 1528–1534. Bibcode:1988Sci ... 242,1528W. doi:10.1126 / science.3201241. PMID 3201241.
- ^ Toi Williams (2012-12-20). „Společnost Medtronic obviněna z úpravy studií produktů“. DC Progresivní. Citováno 2013-05-12.
- ^ Rebecca Farbo (16. ledna 2013). „Světově uznávaný ortopedický chirurg žaluje společnost zabývající se zdravotnickými prostředky za porušení smlouvy“. PR Newswire. Citováno 2013-05-12.
- ^ Susan Perry (2012-10-26). „Zpráva odhaluje znepokojivé podrobnosti o roli společnosti Medtronic při tvorbě článků InFuse“. MinnPost. Citováno 2013-05-13.
- ^ A b C d John Carreyrou & Tom McGinty (2011-06-29). „Lékaři Medtronic se zdrželi, říká studie“. The Wall Street Journal. Citováno 2013-05-12.
- ^ A b C d Carragee EJ, Hurwitz EL, Weiner BK (červen 2011). „Kritický přehled zkoušek morfogenetického proteinu 2 s rekombinantní lidskou kostí v operaci páteře: objevující se bezpečnostní obavy a získané zkušenosti“. The Spine Journal. 11 (6): 471–91. doi:10.1016 / j.spinee.2011.04.023. PMID 21729796.
- ^ Spinální fúze a kostní morfogenetický protein
Další čtení
- Reddi AH (1997). „Kostní morfogenetické proteiny: nekonvenční přístup k izolaci prvních savčích morfogenů“. Cytokinový růstový faktor Rev. 8 (1): 11–20. doi:10.1016 / S1359-6101 (96) 00049-4. PMID 9174660.
- Bessa PC, Casal M, Reis RL (leden 2008). „Kostní morfogenetické proteiny ve tkáňovém inženýrství: cesta z laboratoře ke klinice, část I (základní pojmy)“. Journal of Tissue Engineering and Regenerative Medicine. 2 (1): 1–13. doi:10,1002 / termín.63. hdl:1822/13420. PMID 18293427. Archivovány od originál dne 18. 10. 2012.
externí odkazy
- BMP: Co a kdo
- BMPedia - kostní morfogenetický protein Wiki
- Kosti + morfogenetické + bílkoviny v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Chen D, Zhao M, Mundy GR (prosinec 2004). "Kostní morfogenetické proteiny". Růstové faktory (Chur, Švýcarsko). 22 (4): 233–241. doi:10.1080/08977190412331279890. PMID 15621726. S2CID 22932278.
- Cheng H, Jiang W, Phillips FM, Haydon RC, Peng Y, Zhou L, Luu HH, An N, Breyer B, Vanichakarn P, Szatkowski JP, Park JY, He TC (srpen 2003). „Osteogenní aktivita čtrnácti typů morfogenetických proteinů lidské kosti (BMP)“. The Journal of Bone and Joint Surgery. Americký svazek. 85-A (8): 1544–52. doi:10.2106/00004623-200308000-00017. PMID 12925636. odkaz
