Retrovirová ribonukleáza H - Retroviral ribonuclease H
| Retrovirová ribonukleáza H | |||||||||
|---|---|---|---|---|---|---|---|---|---|
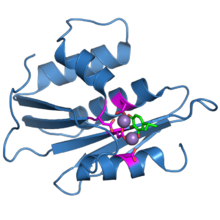 Ribonukleázová H doména z proteinu reverzní transkriptázy HIV-1. Čtyři karboxylátové zbytky aktivního místa jsou uvedeny v purpurové barvě. Dva vázané ionty manganu jsou zobrazeny jako fialové koule. Vázaná molekula inhibitoru, beta-thujaplicinol, je zobrazena zeleně.[1] | |||||||||
| Identifikátory | |||||||||
| EC číslo | 3.1.26.13 | ||||||||
| Číslo CAS | 9050-76-4 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
The retrovir ribonukleáza H (retrovirová RNáza H) je a katalytická doména retroviru reverzní transkriptáza (RT) enzym. RT enzym se používá ke generování komplementární DNA (cDNA ) z retrovir RNA genom. Tento proces se nazývá reverzní transkripce. K dokončení tohoto složitého procesu musí retrovirové RT enzymy přijmout multifunkční povahu. Mají tedy 3 z následujících biochemické aktivity: RNA-dependentní DNA polymeráza, ribonukleáza H, a DNA-dependentní DNA polymeráza činnosti [2] ). Stejně jako všechny enzymy RNázy H retrovirová doména RNázy H štěpí duplexy DNA / RNA a nezničí DNA ani nehybridizovanou RNA.
Struktura


Ačkoli struktury RT z člověk, myší a ptačí retroviry vykazují různé podjednotky, relativní velikosti, orientace a připojení domén DNA polymerázy a RNázy H jsou nápadně podobné. Doména RNázy H zabírá ~ 25% RT proteinu C-terminál. Doména DNA polymerázy zabírá ~ 55% N-konce RT proteinu.[5]RNázové H domény MMLV a HIV-1 RT enzymy jsou strukturně velmi podobné Escherichia coli a Bacillus halodurans RNázy H i lidské RNaseH1.[6][7][8][9][10] Složené struktury retrovirových domén RNasy H mají obecně formu 5vláknového smíšeného beta listy lemovaný čtyřmi alfa helixy v asymetrickém rozdělení. Pozoruhodný rozdíl mezi různými proteiny RNázy H je přítomnost nebo nepřítomnost C-šroubovice (přítomná v E. coli, MLV a lidských RNázách H, chybí v HIV-1, B. haloduranech a ASLV RNázách H), pozitivně nabitá alfa šroubovice označovaná také jako základní smyčka nebo výčnělek.[10] Předpokládá se, že má roli ve vazbě na substrát.[10]

Funkce
V době reverzní transkripce virové genomové RNA do cDNA je vytvořen hybrid RNA / DNA. Řetězec RNA je poté hydrolyzován doménou RNázy H, aby se umožnila syntéza druhého řetězce DNA funkcí DNA polymerázy enzymu RT.[5] Navíc retrovir viriony zabalit jeden tRNA molekula, kterou používají jako primer během reverzní transkripce virové genomové RNA.[11] Retrovirová RNáza H je potřebná k trávení molekuly tRNA, když již není potřeba. Tyto procesy probíhají způsobem závislým na Mg2 +.[12][13]
Retrovirové RNasy H štěpí své substráty ve 3 různých režimech:
- sekvenčně specifické vnitřní štěpení RNA [1-4]. Virus lidské imunodeficience typ 1 a Moloney virus myší leukémie enzymy raději štěpí řetězec RNA nukleotid daleko od spojení RNA-DNA.
- Řízené štěpení RNA na 5'-konci 13-19 nukleotidů z konce RNA.
- Řízené štěpení DNA na 3'-konci 15-20 nukleotidů od konce primeru.
Dva režimy zaměřené na konec jsou jedinečné pro retrovirové RNasy H kvůli řadě účinků asociovaných polymeráza doména retrovirové RT.[6] V univerzálnějším režimu vnitřního štěpení se RNasy H chovají jako typické endonukleázy a štěpí RNA po délce hybridního substrátu DNA / RNA, aniž by docházelo k „koncovým“ účinkům.[14][15][16][17]
Reference
- ^ A b Himmel DM, Maegley KA, Pauly TA, Bauman JD, Das K, Dharia C, Clark AD, Ryan K, Hickey MJ, Love RA, Hughes SH, Bergqvist S, Arnold E (prosinec 2009). „Struktura reverzní transkriptázy HIV-1 s vázaným inhibitorem beta-thujaplicinolem v aktivním místě RNázy H“. Struktura. 17 (12): 1625–1635. doi:10.1016 / j.str.2009.09.016. PMC 3365588. PMID 20004166.
- ^ Worthington, Von (1993). Worthington Enzyme Manual. Worthington. str. 280.
- ^ Katayanagi K, Miyagawa M, Matsushima M, Ishikawa M, Kanaya S, Nakamura H, Ikehara M, Matsuzaki T, Morikawa K (únor 1992). "Strukturní detaily ribonukleázy H z Escherichia coli, rafinované na atomové rozlišení". Journal of Molecular Biology. 223 (4): 1029–52. doi:10.1016 / 0022-2836 (92) 90260-q. PMID 1311386.
- ^ Sarafianos SG, Das K, Tantillo C, Clark AD, Ding J, Whitcomb JM, Boyer PL, Hughes SH, Arnold E (březen 2001). "Krystalová struktura HIV-1 reverzní transkriptázy v komplexu s polypurinovým traktem RNA: DNA". Časopis EMBO. 20 (6): 1449–61. doi:10.1093 / emboj / 20.6.1449. PMC 145536. PMID 11250910.
- ^ A b Beilhartz GL, Götte M (duben 2010). „HIV-1 ribonukleáza H: struktura, katalytický mechanismus a inhibitory“. Viry. 2 (4): 900–26. doi:10,3390 / v2040900. PMC 3185654. PMID 21994660.
- ^ A b Lim D, Gregorio GG, Bingman C, Martinez-Hackert E, Hendrickson WA, Goff SP (září 2006). "Krystalová struktura moloney myší myší leukemické domény RNázy H". Journal of Virology. 80 (17): 8379–89. doi:10.1128 / jvi.00750-06. PMC 1563865. PMID 16912289.
- ^ Katayanagi K, Miyagawa M, Matsushima M, Ishikawa M, Kanaya S, Ikehara M, Matsuzaki T, Morikawa K (září 1990). "Trojrozměrná struktura ribonukleázy H z E. coli". Příroda. 347 (6290): 306–9. doi:10.1038 / 347306a0. PMID 1698262.
- ^ Yang W, Hendrickson WA, Crouch RJ, Satow Y (září 1990). "Struktura ribonukleázy H fázovaná při rozlišení 2 A MAD analýzou selenomethionylového proteinu". Věda. 249 (4975): 1398–405. doi:10.1126 / science.2169648. PMID 2169648.
- ^ Nowotny M, Gaidamakov SA, Crouch RJ, Yang W (červenec 2005). „Krystalové struktury RNasy H vázané na hybrid RNA / DNA: specificita substrátu a katalýza závislá na kovu“. Buňka. 121 (7): 1005–16. doi:10.1016 / j.cell.2005.04.024. PMID 15989951.
- ^ A b C Leo B, Schweimer K, Rösch P, Hartl MJ, Wöhrl BM (září 2012). „Struktura řešení prototypové domény pěny viru RNasy H naznačuje důležitou roli základní smyčky ve vazbě na substrát“. Retrovirologie. 9 (73): 73. doi:10.1186/1742-4690-9-73. PMC 3443672. PMID 22962864.
- ^ Fu, Tie-Bo; John Taylor (27. března 1992). „Když retrovirové reverzní transkriptázy dosáhnou konce svých templátů RNA“. Journal of Virology. 66 (7): 4271–4278. doi:10.1128 / JVI.66.7.4271-4278.1992.
- ^ Taylor JM (březen 1977). "Analýza role druhů tRNA jako primerů pro transkripci genomů RNA nádorového viru do DNA". Biochimica et Biophysica Acta (BBA) - Recenze na rakovinu. 473 (1): 57–71. doi:10.1016 / 0304-419x (77) 90007-5. PMID 66067.
- ^ Talele TT, Upadhyay A, Pandey VN (říjen 2009). "Vliv RNázy H domény retrovirových reverzních transkriptáz na kovovou specificitu a výběr substrátu jejich polymerázových domén". Virology Journal. 6 (159): 159. doi:10.1186 / 1743-422x-6-159. PMC 2765437. PMID 19814799.
- ^ Schultz SJ, Zhang M, Champoux JJ (listopad 2004). "Rozpoznání vnitřních míst štěpení retrovirovými RNázami H". Journal of Molecular Biology. 344 (3): 635–52. doi:10.1016 / j.jmb.2004.09.081. PMID 15533434.
- ^ Krug MS, Berger SL (květen 1989). „Aktivity ribonukleázy H spojené s virovými reverzními transkriptázami jsou endonukleázy“. Sborník Národní akademie věd Spojených států amerických. 86 (10): 3539–43. Bibcode:1989PNAS ... 86,3539 tis. doi:10.1073 / pnas.86.10.3539. PMC 287173. PMID 2471188.
- ^ Champoux JJ, Schultz SJ (březen 2009). "Ribonukleáza H: vlastnosti, substrátová specificita a role v retrovirové reverzní transkripci". FEBS Journal. 276 (6): 1506–16. doi:10.1111 / j.1742-4658.2009.06909.x. PMC 2742777. PMID 19228195.
- ^ Schultz SJ, Champoux JJ (červen 2008). „Aktivita RNázy H: struktura, specificita a funkce v reverzní transkripci“. Virový výzkum. 134 (1–2): 86–103. doi:10.1016 / j.virusres.2007.12.007. PMC 2464458. PMID 18261820.
externí odkazy
- Retrovirus + ribonukleáza + H v americké národní lékařské knihovně Lékařské předměty (Pletivo)
