Kyselina anthranilová - Anthranilic acid
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Kyselina 2-aminobenzoová[1] | |||
| Systematický název IUPAC Kyselina 2-aminobenzenkarboxylová | |||
Ostatní jména
| |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 3DMet | |||
| 471803 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Informační karta ECHA | 100.003.898 | ||
| Číslo ES |
| ||
| 3397 | |||
| KEGG | |||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C7H7NÓ2 | |||
| Molární hmotnost | 137.138 g · mol−1 | ||
| Vzhled | bílá nebo žlutá pevná látka | ||
| Zápach | bez zápachu | ||
| Hustota | 1,412 g / cm3 | ||
| Bod tání | 146 až 148 ° C (295 až 298 ° F; 419 až 421 K)[3] | ||
| Bod varu | 200 ° C (392 ° F; 473 K) (sublimuje) | ||
| 0,572 g / 100 ml (25 ° C) | |||
| Rozpustnost | velmi rozpustný v chloroform, pyridin rozpustný v ethanol, éter, ethylether málo rozpustný v kyselina trifluoroctová, benzen | ||
| log P | 1.21 | ||
| Tlak páry | 0,1 Pa (52,6 ° C) | ||
| Kyselost (strK.A) |
| ||
| -77.18·10−6 cm3/ mol | |||
Index lomu (nD) | 1,578 (144 ° C) | ||
| Termochemie | |||
Std entalpie of formace (ΔFH⦵298) | -380,4 KJ / mol | ||
| Nebezpečí | |||
| Bezpečnostní list | Externí bezpečnostní list | ||
| Piktogramy GHS |   | ||
| Signální slovo GHS | Nebezpečí | ||
| H318, H319 | |||
| P264, P280, P305 + 351 + 338, P310, P337 + 313 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | > 150 ° C (302 ° F; 423 K) | ||
| > 530 ° C (986 ° F; 803 K) | |||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) | 1400 mg / kg (orálně, potkan) | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Kyselina anthranilová je aromatická kyselina s vzorec C6H4(NH2) (CO.)2H) a má nasládlou chuť.[4][5][6] Molekula se skládá z benzenového kruhu, ortho- substituovaný s karboxylová kyselina a amin. V důsledku toho, že obsahuje kyselé i zásadité funkční skupiny, sloučenina je amfoterní. Kyselina anthranilová je čistá bílá pevná látka, i když komerční vzorky mohou vypadat žlutě. Anion [C.6H4(NH2) (CO.)2)]−, získaný deprotonací kyseliny anthranilové, se nazývá antranilát. Kyselina anthranilová se kdysi považovala za vitamin a označovala se jako vitamin L.1 v této souvislosti, ale nyní je známo, že ve výživě člověka není podstatné.[7]
Struktura
Ačkoli se obvykle neoznačuje jako takový, jedná se o aminokyselina. Pevná kyselina anthranilová sestává jak z aminokarboxylové kyseliny, tak z zwitterionický formy karboxylátu amonného.[8]
Výroba
Bylo popsáno mnoho cest k kyselině anthranilové. Průmyslově se vyrábí z anhydrid kyseliny ftalové, počínaje aminací:
- C6H4(CO)2O + NH3 + NaOH → C.6H4(C (O) NH2) CO2Na + H2Ó
Výsledná sodná sůl kyseliny ftalové je dekarbonylována pomocí a Hofmannův přesmyk amidové skupiny, vyvolané chlornan:[9]
- C6H4(C (O) NH2) CO2Na + HOCl → C6H4NH2CO2H + NaCl + CO2
Související metoda zahrnuje léčbu ftalimid sodíkem hypobromit ve vodném hydroxidu sodném, následuje neutralizace.[10] V době, kdy indigo barvivo byl získán z rostlin, byl degradován na kyselinu antranilovou.
Kyselina anthranilová byla nejprve získána bazicky indukovanou degradací indiga.[11]
Biosyntéza
Kyselina anthranilová je biosyntetizována z kyselina chorismová. V organismech schopných syntézy tryptofanu je antranilát předchůdcem aminokyselina tryptofan prostřednictvím přílohy fosforibosylpyrofosfát do aminová skupina.
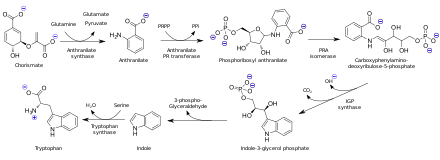
Použití
Průmyslově je kyselina anthranilová meziproduktem při výrobě azobarviva a sacharin. To a jeho estery se používají při přípravě parfémy napodobovat jasmín a oranžový, farmaceutika (kličková diuretika, jako furosemid ) a absorbér UV záření stejně jako inhibitory koroze pro kovy a inhibitory plísní v sójová omáčka.
Repelenty proti hmyzu na bázi antranilátu byly navrženy jako náhrady za DEET.
Kyselina fenamová je derivát kyseliny antranilové,[12]:235 což je zase dusík isostere z kyselina salicylová, který je aktivní metabolit z aspirin.[12]:235 Několik nesteroidní protizánětlivé léky, počítaje v to kyselina mefenamová, kyselina tolfenamová, kyselina flufenamová, a kyselina meklofenamová jsou odvozeny od kyseliny fenamové nebo kyseliny antranilové a nazývají se „deriváty kyseliny anthranilové“ nebo „fenamáty“.[13]:17
Reakce
Kyselinu anthranilovou lze diazotovat, čímž se získá diazoniový kation [C6H4(CO.)2H) (č2)]+. Tento kation lze použít ke generování benzyně,[14] dimerized dát kyselina difenová,[15] nebo podstoupit diazoniová vazba reakce jako při syntéze methylová červeň.[16]
Reaguje s fosgen dát anhydrid kyseliny isatoové, univerzální činidlo.[17]
Chlorace kyseliny anthranilové dává 2,4-dichlorderivát, který může podstoupit redukční vazba za vzniku a biaryl sloučenina.[18]
Bezpečnost a regulace
Je to také a Seznam DEA I Chemický kvůli jeho použití při výrobě dnes široce zakázané euforické sedativní drogy metachalon (Quaalude, Mandrax).[19]
Viz také
Reference
- ^ „Přední záležitost“. Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. s. 748. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97. vydání). CRC Press. str. 5–89. ISBN 978-1498754286.
- ^ IPCS
- ^ Acton, Q. Ashton (2013). Kyseliny aminobenzoové - pokrok ve výzkumu a aplikaci (Vyd. 2013). Atlanta: ScholarlyEditions. p. 23. ISBN 9781481684842 - prostřednictvím Knih Google.
- ^ Hardy, Mark R. (1997). "Označení glykanu s 2-aminobenzamidem Flurophores a kyselinou antranilovou". V Townsend, R. Reid; Hotchkiss, Jr., Arland T. (eds.). Techniky v glykobiologii. Marcel Dekker, Inc. str. 360. ISBN 9780824798222 - prostřednictvím Knih Google.
- ^ The Merck Index, 10. vydání. (1983), str. 62, Rahway: Merck & Co.
- ^ Davidson, Michael W. (2004). "Kyselina anthranilová (vitamin L)]". Florida State University. Citováno 20. listopadu 2019.
- ^ Brown, C. J. (1968). "Krystalová struktura kyseliny anthranilové". Sborník královské společnosti v Londýně. Řada A. Matematické a fyzikální vědy. 302 (1469): 185–199. Bibcode:1968RSPSA.302..185B. doi:10.1098 / rspa.1968.0003.
- ^ Maki, Takao; Takeda, Kazuo (2000). "Kyselina benzoová a deriváty". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a03_555. ISBN 3527306730..
- ^ Vogelova učebnice praktické organické chemie, 4. vyd.(B. S. Furniss et al., Eds.) (1978), str. 666, London: Longman.
- ^ Sheibley, Fred E. (1943). „Carl Julius Fritzsche a objev kyseliny antranilové, 1841“. Journal of Chemical Education. 20 (3): 115. Bibcode:1943JChEd..20..115S. doi:10.1021 / ed020p115.
- ^ A b Sriram D, Yogeeswari P. Medicinal Chemistry, 2. vydání. Pearson Education India, 2010. ISBN 9788131731444
- ^ Materiály ke studiu na Auburn University. Jack DeRuiter, Principles of Drug Action 2, podzim 2002 1: Nesteroidní protizánětlivé léky (NSAID)
- ^ Logullo, F. M .; Seitz, A. H .; Friedman, L. (1968). „Benzendiazonium-2-karboxy- a bifenylen“. Organické syntézy. 48: 12.
- ^ Atkinson, E. R .; Lawler, H. J. (1927). "Kyselina difenická". Organické syntézy. 7: 30. doi:10.15227 / orgsyn.007.0030.
- ^ Clarke, H. T .; Kirner, W. R. (1922). "Methyl Red". Organické syntézy. 2: 47.
- ^ Wagner, E. C .; Fegley, Marion F. (1947). "Anhydrid kyseliny isatové". Org. Synth. 27: 45. doi:10.15227 / orgsyn.027.0045.
- ^ Atkinson, Edward R .; Murphy, Donald M .; Lufkin, James E. (1951). "dlKyselina -4,4 ', 6,6'-tetrachlorodifenová ". Organické syntézy. 31: 96.
- ^ Angelos SA, Meyers JA (1985). „Izolace a identifikace prekurzorů a reakčních produktů při tajné výrobě metachalonu a mekloqualonu“. Journal of Forensic Sciences. 30 (4): 1022–1047. PMID 3840834.