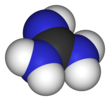
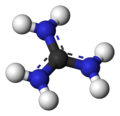
Guanidin - Guanidine
| |||
| |||
| Jména | |||
|---|---|---|---|
| Názvy IUPAC Guanidin[1] Iminomethan-diamin | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 506044 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Informační karta ECHA | 100.003.656 | ||
| Číslo ES |
| ||
| 100679 | |||
| Pletivo | Guanidin | ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| CH5N3 | |||
| Molární hmotnost | 59.072 g · mol−1 | ||
| Bod tání | 50 ° C (122 ° F; 323 K) | ||
| log P | −1.251 | ||
| Kyselost (strK.A) | 13.6 | ||
| Konjugovaná kyselina | Guanidinium | ||
| Termochemie | |||
Std entalpie of formace (ΔFH⦵298) | −57 - −55 kJ mol−1 | ||
Std entalpie of spalování (ΔCH⦵298) | −1,0511 - −1,0531 MJ mol−1 | ||
| Farmakologie | |||
| Farmakokinetika: | |||
| 7–8 hodin | |||
| Nebezpečí | |||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) | 475 mg / kg (orálně, potkan)[2] | ||
| Související sloučeniny | |||
Související sloučeniny | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Guanidin je sloučenina vzorce HNC (NH2)2. Je to bezbarvá pevná látka, která se rozpouští v polárních rozpouštědlech. Je to silná základna který se používá při výrobě plasty a výbušniny. Nachází se v moč jako normální produkt bílkovin metabolismus. Guanidin skupina také se objevuje ve větších organických molekulách, včetně na postranním řetězci arginin.
Struktura
Guanidin lze považovat za dusíkatý analog kyselina uhličitá. To znamená, že skupina C = O v kyselině uhličité je nahrazena skupinou C = NH a každý OH je nahrazen a NH
2 skupina.[3] Izobutylen lze považovat za analog uhlíku v podstatě stejným způsobem. Podrobná krystalografická analýza guanidinu byla objasněna 148 let po jeho první syntéze, a to navzdory jednoduchosti molekuly.[4] V roce 2013 byly polohy atomů vodíku a jejich parametry posunutí přesně stanoveny pomocí monokrystalické neutronové difrakce.[5]
Výroba
Guanidin lze získat z přírodních zdrojů, přičemž se nejprve izoluje Adolph Strecker prostřednictvím degradace guanin.[6] Poprvé byl syntetizován v roce 1861 oxidační degradací aromatického přírodního produktu, guanin, izolovaný od peruánský guano.[7]
Laboratorní metodou výroby guanidinu je jemný (180-190 ° C) tepelný rozklad suchého produktu thiokyanát amonný v bezvodých podmínkách:
Komerční cesta zahrnuje dvoustupňový proces počínaje reakcí dikyandiamid s amonný soli. Prostřednictvím prostředníka biguanidin, tento amonolýza krok poskytuje soli guanidiniového kationtu (viz níže). Ve druhém kroku se sůl zpracuje s bází, jako je například methoxid sodný.[6]
Chemie
Guanidiniový kation
S pK.b 0,4, guanidin je silná báze. Většina derivátů guanidinu jsou ve skutečnosti soli obsahující konjugovanou kyselinu.
The konjugovaná kyselina se nazývá guanidinium kation, (C (NH
2)+
3). Tento rovinný, symetrický iont se skládá ze tří amino skupiny každé vázané k centrálnímu atomu uhlíku kovalentní vazbou objednat 4/3. Je vysoce stabilní +1 kation ve vodném roztoku díky účinnému rezonanční stabilizace poplatku a efektivní solvatace molekulami vody. Výsledkem je jeho pK.A je 13.6[8] což znamená, že guanidin je velmi silná báze ve vodě; v neutrální vodě existuje téměř výlučně jako guanidinium.
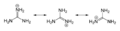
kanonické formy
Testování na guanidin
Guanidin lze selektivně detekovat za použití kyseliny 1,2-naftochinon-4-sulfonové (Folinovo činidlo ) a okyselené močoviny.[9]
Použití
Průmysl
Hlavní sůl komerčního zájmu je dusičnan [C(NH
2)3]NE
3. Používá se jako pohonná hmota, například v airbagy.
Biochemie
Guanidin existuje protonovaný jako guanidinium v roztoku při fyziologickém pH.
Guanidiniumchlorid (také známý jako hydrochlorid guanidinu) má chaotropní vlastnosti a používá se k denaturaci proteinů. Je známo, že guanidiniumchlorid denaturuje proteiny s lineárním vztahem mezi koncentrací a energie zdarma odvíjení. Ve vodných roztocích obsahujících 6M guanidiniumchlorid, téměř všechny bílkoviny ztratit celý sekundární struktura a stát se náhodně stočený peptidové řetězce. Guanidinium thiokyanát se také používá pro svůj denaturační účinek na různé biologické vzorky.
Guanidiniumchlorid[10] se používá jako adjuvans při léčbě botulismus, představený v roce 1968,[11] nyní je však jeho role považována za kontroverzní[12] - protože u některých pacientů nedošlo po podání tohoto léku k žádnému zlepšení.
jiný
Guanidinium hydroxid je aktivní složkou některých ne-louhů vlasové relaxátory.
Deriváty guanidinu
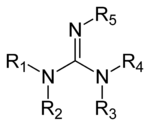
Guanidiny jsou skupina organické sloučeniny sdílení společného funkční skupina s obecnou strukturou (R.
1R
2N) (R.
3R
4N) C = N − R
5. Centrální vazba v této skupině je vazba z já těžím a skupina je strukturně příbuzná amidinům a močovinám. Příklady guanidinů jsou arginin, triazabicyklodecen, saxitoxin, a kreatin.
Galegine je isoamylenguanidin.[13]
Viz také
- Kategorie: Guanidiny
- Sakagučiho test
- Y-aromatičnost
- Amidin
Reference
- ^ "Guanidin - shrnutí sloučeniny". PubChem Compound. USA: Národní centrum pro biotechnologické informace. 16. září 2004. Identifikace. Citováno 29. února 2012.
- ^ "Guanidin hydrochlorid". ChemIDplus. Národní lékařská knihovna.
- ^ Goebel, M .; Klapoetke, T. M. (2007). "První strukturní charakterizace guanidinu". Chem. Commun. 43 (30): 3180–2. doi:10.1039 / B705100J. PMID 17653381.
- ^ Yamada, T .; Liu, X .; Englert, U .; Yamane, H .; Dronskowski, R. (2009). "Struktura pevné látky volného základu guanidinu byla dosažena konečně". Chem. Eur. J. 15 (23): 5651–5. doi:10.1002 / chem.200900508. PMID 19388036.
- ^ Sawinski, P. K .; Meven, M .; Englert, U .; Dronskowski, R. (2013). „Monokrystalická neutronová difrakční studie na guanidinu, CN3H5". Cryst. Growth Des. 13 (4): 1730–5. doi:10.1021 / cg400054k.
- ^ A b Güthner, Thomas; Mertschenk, Bernd; Schulz, Bernd. "Guanidin a deriváty". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a12_545.pub2.
- ^ Strecker, A. (1861). „Untersuchungen über die chemischen Beziehungen zwischen Guanin, Xanthin, Theobromin, Caffeïn und Kreatinin“ [Studie chemických vztahů mezi guaninem, xanthinem, teobrominem, kofeinem a kreatininem]. Liebigs Ann. Chem. 118 (2): 151–177. doi:10.1002 / jlac.18611180203.
- ^ Perrin, D. D. (1972). Disociační konstanty organických bází ve vodném roztoku (Dodatek ed.). London: Butterworths..
- ^ Sullivan, M. X. (10.10.1935). "Kolorimetrický test na guanidin". Sborník Společnosti pro experimentální biologii a medicínu. 33 (1): 106–108. doi:10.3181 / 00379727-33-8270C. ISSN 0037-9727. S2CID 88290359.
- ^ Kaplan, J. E .; Davis, L. E.; Narayan, V .; Koster, J .; Katzenstein, D. (1979). "Botulismus, typ A a léčba guanidinem". Annals of Neurology. 6 (1): 69–71. doi:10,1002 / analog. 410060117. PMID 389150. S2CID 42901888.
- ^ Puggiari, Marcello; Cherington, Michael (1978). „Botulismus a guanidin: o deset let později“. J. Am. Med. Doc. 240 (21): 2276–7. doi:10.1001 / jama.1978.03290210058027. PMID 702753.
- ^ Brook, Itzhak (2001). Pediatrické anaerobní infekce: diagnostika a léčba (3. vyd.). Taylor & Francis. str. 529. ISBN 0824741862.
- ^ Witters, L. A. (2001). „Kvetení francouzského šeříku“. Journal of Clinical Investigation. 108 (8): 1105–7. doi:10,1172 / JCI14178. PMC 209536. PMID 11602616.