Sodný wolframový bronz - Sodium tungsten bronze

Sodný wolframový bronz je forma vkládací sloučenina se vzorcem NaXWO3, kde X je roven nebo menší než 1. Tak pojmenovaný kvůli jeho kovovému lesku, jeho elektrické vlastnosti se pohybují od polovodičové na kov v závislosti na koncentraci přítomných iontů sodíku; může také vystavovat supravodivost.
Dějiny
Připraven v roce 1823 chemikem Friedrich Wöhler, sodíkový wolframový bronz byl první bronz alkalického kovu, který byl objeven.[1]Wolframové bronzy vděčí za některé ze svých vlastností relativní stabilitě wolfram (V) kation, který se tvoří.[2] Podobná rodina molybdenové bronzy mohl být objeven v roce 1885 uživatelem Alfred Stavenhagen a E. Engels,[3] ale jsou formovány ve velmi úzkém rozmezí teplot a byly hlášeny znovu až v 60. letech.[4]
Vlastnosti
Sodný wolframový bronz, stejně jako jiné wolframové bronzy, je odolný vůči chemickým reakcím za kyselých i bazických podmínek. Barva závisí na podílu sodíku ve sloučenině, od zlatého at X ≈ 0,9, přes červenou, oranžovou a tmavě fialovou, až po modročernou, když X ≈ 0.3.
Elektrický měrný odpor bronzu závisí na podílu sodíku ve sloučenině, přičemž u některých vzorků se měří měrný odpor 1,66 mΩ.[5] Bylo navrženo, že elektrony, uvolněné při ionizaci atomů sodíku, jsou snadno vedeny wolframem t2g a kyslík π orbitaly.[2] To lze pozorovat v XPS[6] a UPS[7] spektra: vrchol představující wolfram 5d kapela se stává intenzivnější X vychází.
Pro hodnoty X pod 0,3 je bronz spíše polovodivý než kovový.[2] Při dostatečném ochlazení se z bronzového wolframu sodného stane supravodič, s kritickou teplotou (TC) pro Na0.23WO3 je přibližně 2.2kelvin.[8] První záznam supravodivosti ve wolframovém bronzu byl v roce 1964, s a TC 0,57 K.[9]
Struktura
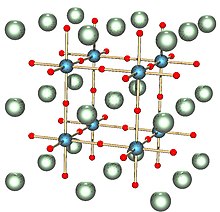
Když X = 1, sodíkový wolframový bronz přijímá kubickou fázi: perovskit Krystalická struktura.[10] V této formě se struktura skládá ze sdílení rohu6 octahedra s ionty sodíku v intersticiálních mezerách. Pro X hodnoty mezi 0,9 a 0,3, struktura zůstává podobná, ale s rostoucím nedostatkem sodíkových iontů a menším parametrem mřížky.[10]
Lze použít i řadu dalších typů struktur s různými elektrickými vlastnostmi: kubická, čtyřboká I a šestihranná fáze jsou kovové, zatímco ortorombické a čtyřboké struktury II jsou polovodivé.[11]
Syntéza
Wöhlerova syntéza 1823 zahrnovala redukci wolframan sodný a oxid wolframový s vodíkový plyn při červeném žáru. Modernější přístup snižuje a tát reaktantů spíše elektřinou než vodíkem.[12] Je také možná mikrovlnná syntéza,[13] s použitím wolframového prášku jako redukčního činidla. Jsou také možné hydrotermální (dávkové i průtokové) syntézy.[14]
Související sloučeniny
Sodík v této sloučenině může být nahrazen jiným alkalické kovy k vytvoření jejich wolframových bronzů a dalších kovů, jako je cín a olovo.[15] Molybdenové bronzy také existují, ale jsou méně stabilní než jejich wolframové protějšky.[2]
Reference
- ^ Hagenmuller, P (1973). „Kapitola 50: Wolframové bronzy, vanadové bronzy a příbuzné sloučeniny“. Komplexní anorganická chemie. 4. Pergamon. str.541–605. ISBN 978-0-08-016989-7.
- ^ A b C d Greenwood, N. N. & Earnshaw, A. (1993) [Dotisk opravené verze z roku 1986, původní verze vytištěna v roce 1984]. Chemie prvků (1. vyd.). Pergamon Press. str. 1185–6. ISBN 0-08-022057-6.
- ^ A. Stavenhagen, E. Engels (1895) „Ueber Molybdänbronzen“ Berichte der deutschen chemischen Gesellschaft, svazek 28, strany 2280-2281. doi:10,1002 / cber.189502802213
- ^ Wold, A .; Kunnmann, W .; Arnott, R. J .; Ferreti, A. (1964). "Příprava a vlastnosti krystalů bronzového molybdenu sodného a draselného". Anorganická chemie. 3 (4): 545–547. doi:10.1021 / ic50014a022.
- ^ Straumanis, M. E.; Dravnieks, A. (1949). „Sodné wolframové bronzy. II. Elektrická vodivost bronzů“. Journal of the American Chemical Society. 71 (2): 683. doi:10.1021 / ja01170a086.
- ^ West, Anthony (1984). Chemie pevných látek a její aplikace. Wiley. p. 96. ISBN 0-471-90874-6.
- ^ Cheetham, AK; Day, P. (1987). Chemie pevných látek: techniky. Clarendon. p. 110. ISBN 0-19-855286-6.
- ^ Ostenson, J .; Shanks, H .; Finnemore, D. (1978). "Supravodivost ve wolframových bronzech". Journal of the Less Common Metals. 62: 149. doi:10.1016/0022-5088(78)90024-3.
- ^ Raub, C .; Sweedler, A .; Jensen, M .; Broadston, S .; Matthias, B. (1964). "Supravodivost sodíkových wolframových bronzů". Dopisy o fyzické kontrole. 13 (25): 746. Bibcode:1964PhRvL..13..746R. doi:10.1103 / PhysRevLett.13.746.
- ^ A b Hägg, G. (1935). „The Spinels and the Cubic Sodium-Wolfram Bronses as New examples of Structures with Vacant Lattice Points“. Příroda. 135 (3421): 874. Bibcode:1935Natur.135..874H. doi:10.1038 / 135874b0.
- ^ Ngai, K. L .; Reinecke, T. L. (1978). "Strukturální nestability a supravodivost v alkalických wolframových bronzech". Journal of Physics F: Metal Physics. 8: 151. Bibcode:1978JPhF .... 8..151N. doi:10.1088/0305-4608/8/1/018.
- ^ Conroy, L. E. (1977). „Příprava a charakterizace wolframového bronzu sodného. Anorganický experiment“. Journal of Chemical Education. 54: 45. Bibcode:1977JChEd..54 ... 45C. doi:10.1021 / ed054p45.
- ^ Guo, J .; Dong, C .; Yang, L .; Fu, G. (2005). "Zelená cesta pro mikrovlnnou syntézu sodíkových wolframových bronzů NaWO (0 << 1)". Journal of Solid State Chemistry. 178: 58. Bibcode:2005JSSCh.178 ... 58G. doi:10.1016 / j.jssc.2004.10.017.
- ^ Luo, Jia Yu; Liu, Jing Xiao; Shi, Fei; Xu, Qiang; Jiang, Yan Yan; Liu, Gui Shan; Hu, Zhi Qiang (červen 2013). „Syntéza sodíku a wolframu bronzové pomocí hydrotermální metody podporované kyselinou citronovou“. Pokročilý výzkum materiálů. 712–715: 280–283. doi:10.4028 / www.scientific.net / AMR.712-715.280.
- ^ Inteligentní, Lesley E .; Moore, Elaine A. (2005). Chemie pevných látek: Úvod (3. vyd.). CRC Press. p.227. ISBN 0-7487-7516-1.
