Wolfram hexakarbonyl - Tungsten hexacarbonyl
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Hexacarbonyltungsten | |
| Ostatní jména Wolfram karbonyl Hexacarbonylwolfram | |
| Identifikátory | |
3D model (JSmol ) | |
| Informační karta ECHA | 100.034.423 |
| Číslo ES |
|
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C6Ó6Ž | |
| Molární hmotnost | 351,901 g / mol |
| Vzhled | Bezbarvá pevná látka |
| Hustota | 2,65 g / cm3 |
| Bod tání | 170 ° C (338 ° F; 443 K) (rozkládá se) |
| nerozpustný | |
| Rozpustnost | střídmě dovnitř THF |
| Nebezpečí | |
| Hlavní nebezpečí | Hořlavý, zdroj CO |
| Související sloučeniny | |
jiný kationty | Chrom hexakarbonyl Hexakarbonyl molybdenu |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Wolfram hexakarbonyl (také zvaný wolframkarbonyl) je chemická sloučenina vzorce W (CO)6. Tento komplex dal vzniknout prvnímu příkladu dihydrogenového komplexu.[1]
Tato bezbarvá sloučenina, jako je její chrom a molybden analogů, je pozoruhodný jako těkavý, na vzduchu stabilní derivát wolfram v nulovém oxidačním stavu.
Příprava, vlastnosti a struktura
W (CO)6 je připraven snížení z WCl6 pod tlakem kysličník uhelnatý. Sloučenina je relativně stabilní na vzduchu. Je těžko rozpustný v nepolárních organických rozpouštědlech. Wolframkarbonyl je široce používán v depozice indukovaná elektronovým paprskem technika - snadno se odpařuje a rozkládá elektronovým paprskem, což poskytuje vhodný zdroj atomů wolframu.[2]
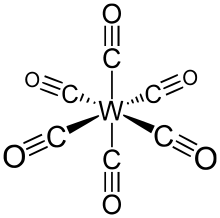
W (CO)6 přijímá oktaedrická geometrie skládající se ze šesti tyčovitých CO ligandy vyzařující z centrálního atomu W s dipólový moment 0 D.
Reaktivita
Všechny reakce W (CO)6 začít s vytěsněním některých CO ligandů ve W (CO)6. W (CO)6 chová se podobně jako Mo (CO)6 ale má tendenci tvořit sloučeniny, které jsou kineticky robustnější.
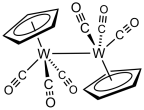
Léčba wolfram hexakarbonyl s cyklopentadienid sodný následuje oxidace výsledného NaW (CO)3(C5H5) dává cyklopentadienyltungsten trikarbonyl dimer.[3]
Jeden derivát je dihydrogenový komplex W (CO)3[P (C.6H11)3]2(H2).[1]
Tři z těchto ligandů CO lze vytěsnit acetonitrilem.[4]W (CO)6 se používá k odsíření organických sloučenin síry a jako předzvěst katalyzátorů pro alkenová metateze.
Bezpečnost a manipulace
Jako všechny kovové karbonyly, i W (CO)6 je nebezpečným zdrojem těkavých kovů i CO.
Reference
- ^ A b Kubas, G. J., Metal Dihydrogen and σ-Bond Complexes, Kluwer Academic / Plenum Publishers: New York, 2001.
- ^ Randolph, S .; Fowlkes, J .; Rack, P. (2006). "Cílené nanoscale nanášení a leptání vyvolané elektronovým paprskem". Kritické přehledy pevných látek a věd o materiálech. 31 (3): 55. doi:10.1080/10408430600930438.
- ^ Manning, A. R .; Hacket, Paul; Birdwhistell, Ralph (1990). „Hexakarbonylbis (η5‐Cyklopentadienyl) Dichrom, molybden a wolfram a jejich analogy, M2(η5-C5H4R)2(CO)6 (M = Cr, Mo a W; R = H, Me nebo PhCH2)". Anorganické syntézy. 28: 148–149. doi:10.1002 / 9780470132593.ch39.
- ^ Kubas, G. J .; van der Sluys, L. S. (1990). "TricarbonylTris (nitril) komplexy Cr, Mo a W". Anorganické syntézy. 28: 29–33. doi:10.1002 / 9780470132593.ch6.
