Amonný paratungstát - Ammonium paratungstate
 | |
| Identifikátory | |
|---|---|
| ChemSpider | |
| Informační karta ECHA | 100.031.228 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
| (NH4)10(H2Ž12Ó42) · 4H2Ó | |
| Molární hmotnost | 3132,2 g / mol |
| Vzhled | Bílá pevná látka |
| Hustota | 4,60 g / cm3[1] |
| Bod varu | Rozkládá se při 600 ° C |
| Nebezpečí | |
| Piktogramy GHS |  |
| Signální slovo GHS | Varování |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P332 + 313, P337 + 313, P362, P403 + 233, P405, P501 | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Amonný paratungstát (nebo APT) je bílý krystal sůl s chemickým vzorcem (NH4)10(H2Ž12Ó42) · 4H2O. Je popsán jako „nejdůležitější surovina pro slitinové wolframové výrobky“.[2]
Výroba
Z wolframových rud
Wolfram rudy, které jsou obvykle oxidy, jsou tráveny v základu za vzniku roztoků wolframanu spolu s mnoha kontaminujícími druhy. Tento surový extrakt se okyselí a zpracuje s sulfid oddělit trisulfid molybdenu. Při dalším okyselení APT nakonec krystalizuje.[2]
Laboratorní metody
Pokud kalcinovaný WO3 se používá, refluxuje amoniak řešení je vhodné urychlit jeho rozpuštění.
Přeměna na wolframový kov
Získá se zahřátí paratungstátu amonného na teplotu rozkladu 600 ° C oxid wolframu, jak je popsáno v této idealizované rovnici:
- (NH4)10(H2Ž12Ó42) · 4H2O → 12 WO3 + 10 NH3 + 6 hodin2Ó
Odtud se oxid uhličitý zahřívá v atmosféře vodík, čímž se získá elementární wolfram:[3]
- WO3 + 3 H2 → W + 3 H2Ó
Struktura
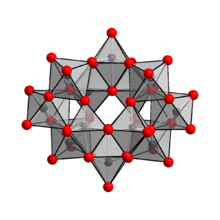
The anion v (NH4)10(Ž12Ó41) · 5H2O bylo prokázáno, že je [H2Ž12Ó42]10−, obsahující dva vodík atomy, přičemž v kleci jsou dva atomy vodíku.[1] Správný zápis vzorce pro paratungstát amonný je tedy (NH4)10[H2Ž12Ó42] · 4H2O. [H2Ž12Ó42]10− iont je znám jako iont paratungstátu B, na rozdíl od iontu paratungstátu A, který má vzorec [W7Ó24]6−, podobně jako paramolybdenanový ion. Existenci iontu paratungstátu A však nemohla potvrdit NMR spektroskopie.[4]
Před asi 1930, tam byl nějaký spor o přesné složení soli, a oba (NH4)10Ž12Ó41 a (NH4)6Ž7Ó24 byly navrženy. O.W. Gibbs k tomu poznamenal:
- „Alkalické wolframaty jsou četné a neobvykle složité. Soli v zásadě odlišných vzorců se přibližují v procentuálním složení tak blízko, že rozdíly se velmi blíží nevyhnutelným chybám analýz. Analýzy jsou stěží dostatečně blízké, aby rozhodly o otázce z čistě analytických důvodů.“[5]
Ostatní hydráty
Při koncentrování amoniakálního roztoku kyselina wolframová (tj. vodnatá WO3), získaným produktem je paratungstát amonný. Pod 50 ° C se hexahydrát Když je teplota roztoku vyšší než 50 ° C, vytvoří se pentahydrát nebo heptahydrát. První krystalizuje jako triclinické desky nebo hranoly, zatímco druhá jako pseudorhombické jehly. Tetrahydrát je nejvýznamnější v obchodním smyslu. Také známý:
- dekahydrát[6]
- nonahydrát
Reference
- ^ A b d'Amour, Hedvika; Allmann, Rudolf (1972). „Die Kristallstruktur des Ammoniumparawolframat-tetrahydrats (NH4) 10 [H2W12O42] · 4H2O“. Zeitschrift für Kristallographie. 136 (1–2): 23–47. Bibcode:1972ZK .... 136 ... 23D. doi:10.1524 / zkri.1972.136.1-2.23.
- ^ A b Lassner, Erick; Schubert, Wolf-Dieter; Lüderitz, Eberhard; Vlk, Hans Uwe. "Wolfram, slitiny wolframu a sloučeniny wolframu". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a27_229.
- ^ D. J. Jones, "Praktické aspekty slinování wolframu a molybdenu" (jak je uvedeno v Komplexní anorganická chemieJ. C. Bailar Jr. a kol. 744, sv. 3, 1. vydání 1973)
- ^ Greenwood & Earnshaw, Chemie prvků, 2. vyd. 1997, str. 1012–1014
- ^ J. W. Mellor: Anorganická a teoretická chemie, sv. XI, s. 812–813, Longmans Green & Co. 1931
- ^ Allmann, R. (1971). „Die Struktur des Ammoniumparawolframates (NH4) 10 [H2W12O42] .10H2O“. Acta Crystallographica oddíl B. 27 (7): 1393–1404. doi:10.1107 / S0567740871004047.
