Friedel – Craftsova reakce - Friedel–Crafts reaction
| Friedel-Craftsova reakce | |
|---|---|
| Pojmenoval podle | Charles Friedel James Crafts |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| RSC ontologické ID | RXNO: 0000369 |
The Friedel – Craftsovy reakce jsou souborem reakce vyvinutý uživatelem Charles Friedel a James Crafts v roce 1877 připojit substituenty k aromatický kruh.[1] Friedel – Craftsovy reakce jsou dvou hlavních typů: alkylace reakce a acylace reakce. Oba pokračují elektrofilní aromatická substituce.[2][3][4][5]
Friedel – Craftsova alkylace
| Friedel-Craftsova alkylace | |
|---|---|
| Pojmenoval podle | Charles Friedel James Crafts |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | friedel-řemesla-alkylace |
| RSC ontologické ID | RXNO: 0000046 |
Friedel – Craftsova alkylace zahrnuje alkylaci an aromatický kruh s alkylhalogenid pomocí silné Lewisova kyselina, jako chlorid hlinitý, chlorid železitý nebo jiný MXn činidlo, as katalyzátor.[6] Obecný mechanismus pro terciární alkylhalogenidy jsou uvedeny níže.[7]
U primárních (a případně sekundárních) alkylhalogenidů se jedná o komplex podobný karbokationtu s Lewisovou kyselinou [R(+)--- (X --- MXn)(–)] je pravděpodobnější, že bude zapojen, spíše než volná karbokace.
Tato reakce trpí nevýhodou, že produktu je více nukleofilní než reaktant, protože alkylové skupiny jsou aktivátory reakce Friedel – Crafts. V důsledku toho může dojít k nadměrné alkylaci. Sterická překážka lze využít k omezení počtu alkylací, jako v t-butylace 1,4-dimethoxybenzenu.[8]
Kromě toho je reakce užitečná pouze pro primární alkylhalogenidy v intramolekulárním smyslu, když se vytvoří 5- nebo 6-členný kruh. V intermolekulárním případě je reakce omezena na terciární alkylační činidla, některá sekundární alkylační činidla (ta, u kterých je karbokační přesmyk degenerovaný), nebo alkylační činidla, která poskytují stabilizované karbokationty (např. benzylová nebo allylová). V případě primárních alkylhalogenidů je komplex podobný karbokationtu (R.(+)--- X --- Al(-)Cl3) podstoupí a karbokace přesmyková reakce poskytnout téměř výlučně přeskupený produkt odvozený ze sekundární nebo terciární karbokace.[7]
Alkylace se neomezují pouze na alkylhalogenidy: Friedel – Craftsovy reakce jsou možné u všech karbokationtový meziprodukt, jako jsou deriváty alkeny a a kyselina protická, Lewisova kyselina, enones, a epoxidy. Příkladem je syntéza neophylchlorid z benzenu a methallylchloridu:[9]
- H2C = C (CH3) CH2Cl + C6H6 → C.6H5C (CH3)2CH2Cl
V jedné studii je elektrofil a bromoniový ion odvozené od alkenu a NBS:[10]
V této reakci triflát samarium (III) Předpokládá se, že aktivuje donor halogenu NBS při tvorbě iontů halonia.
Friedel – Crafts dealkylace
O hypotéze Friedel – Craftsové se předpokládá, že bude reverzibilní. V retro-Friedel-Craftsova reakce nebo Friedel – Crafts dealkylace, alkylové skupiny jsou odstraněny v přítomnosti protonů nebo jiných Lewisova kyselina.
Například při vícenásobném přidání ethylbromid na benzen, ortho a odst substituce se očekává po prvním kroku monosubstituce, protože alkylová skupina je aktivační skupina. Skutečný reakční produkt však je 1,3,5-triethylbenzen se všemi alkylovými skupinami jako a meta substituent.[11] Řízení termodynamické reakce zajišťuje, že je termodynamicky zvýhodněno meta substituce s sterická překážka minimalizováno převažuje nad méně příznivými ortho a odst nahrazení chemická rovnováha. Konečný reakční produkt je tedy výsledkem řady alkylací a dealkylací.[12]
Friedel – Craftsova acylace
| Friedel-Craftsova acylace | |
|---|---|
| Pojmenoval podle | Charles Friedel James Crafts |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | friedel-řemesla-acylace |
| RSC ontologické ID | RXNO: 0000045 |
Friedel – Craftsova acylace zahrnuje acylace aromatických kruhů. Typickými acylačními činidly jsou acylchloridy. Typický Lewisova kyselina katalyzátory jsou kyseliny a chlorid hlinitý. Protože však produkt keton tvoří poměrně stabilní komplex s Lewisovými kyselinami, jako je AlCl3, obecně se musí použít stechiometrické množství „katalyzátoru“, na rozdíl od případu Friedel-Craftsovy alkylace, při které se katalyzátor neustále regeneruje. Friedel – Craftsova acylace je také možná s anhydridy kyselin.[13] Reakční podmínky jsou podobné jako Friedel-Craftsova alkylace. Tato reakce má oproti alkylační reakci několik výhod. Kvůli elektronovému odběru karbonyl skupina, keton produkt je vždy méně reaktivní než původní molekula, takže nedochází k vícenásobným acylacím. Také neexistují žádné karbokace přeskupení, protože acylium ion je stabilizován rezonanční strukturou, ve které je kladný náboj na kyslíku.
Životaschopnost Friedel-Craftsovy acylace závisí na stabilitě acylchloridového činidla. Například formylchlorid je příliš nestabilní, než aby byl izolován. Syntéza tedy benzaldehyd cestou Friedel – Crafts vyžaduje syntézu formylchloridu in situ. Toho je dosaženo Gattermann-Kochova reakce, dosažené zpracováním benzenu s kysličník uhelnatý a chlorovodík za vysokého tlaku, katalyzovaného směsí chlorid hlinitý a chlorid měďný.
Reakční mechanismus
Reakce probíhá generováním centra acylia. Reakce je ukončena deprotonací areniový ion AlCl4−, regenerace AlCl3 katalyzátor. Avšak na rozdíl od skutečně katalytické alkylační reakce je vytvořený keton mírnou Lewisovou bází, která tvoří komplex se silným chloridem hlinitým Lewisovy kyseliny. Tvorba tohoto komplexu je obvykle za reakčních podmínek nevratná. Stochiometrické množství AlCl3 je potřeba. Komplex se po zpracování ve vodě zničí, čímž se získá požadovaný keton. Například klasická syntéza deoxybenzoinu vyžaduje 1,1 ekvivalentu AlCl3 s ohledem na omezující činidlo, fenylacetylchlorid.[14] V určitých případech, obecně když je aktivován benzenový kruh, lze také provést Friedel-Craftsovu acylaci katalytické množství mírnější Lewisovy kyseliny (např. soli Zn (II)) nebo katalyzátoru Bronstedovy kyseliny za použití anhydridu nebo dokonce samotné karboxylové kyseliny jako acylačního činidla.
Pokud je to žádoucí, může být výsledný keton následně redukován na odpovídající alkanový substituent kterýmkoli z nich Wolff – Kishnerova redukce nebo Clemmensenova redukce. Čistý výsledek je stejný jako Friedel-Craftsova alkylace, kromě toho, že přesmyk není možný.[15]
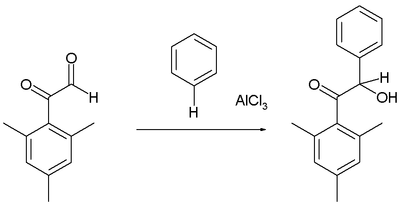
Friedel – Craftsova hydroxyalkylace
Areny reagují jistě aldehydy a ketony za vzniku hydroxyalkylovaných produktů, například při reakci mezityl derivát glyoxal s benzenem:[16]
Jako obvykle je aldehydová skupina reaktivnější elektrofil než skupina fenon.
Rozsah a variace
Tato reakce souvisí s několika klasickými pojmenovanými reakcemi:
- Acylovaný reakční produkt lze převést na alkylovaný produkt pomocí a Clemmensenova redukce.[17][18][19]
- The Gattermann – Kochova reakce lze použít k syntéze benzaldehydu z benzenu.[20]
- The Gattermanova reakce popisuje arenové reakce s kyselinou kyanovodíkovou.[21]
- The Houben – Hoeschova reakce popisuje arenové reakce s nitrily.[22][23]
- Reakční modifikace s aromatickým fenylesterem jako reaktantem se nazývá Hranolky přesmyk.
- V Schollova reakce dvě arény se spojují přímo (někdy se nazývají Friedel – Craftsova arylace).[24][25]
- V Reakce Zincke – Suhl str-krezol je alkylován na cyklohexadienon tetrachlormethanem.[26]
- V Blanc chlormethylace chloromethylová skupina se přidá k arenu s formaldehydem, kyselinou chlorovodíkovou a chloridem zinečnatým.[27][28]
- The Bogert – Cookova syntéza (1933) zahrnuje dehydratace a izomerizace z 1-p-fenylethylcyklohexanol na oktahydro derivát fenanthren[29]

- The Darzens – Nenitzescuova syntéza ketonů (1910, 1936) zahrnuje acylaci cyklohexen s acetylchlorid na methylcyklohexenylketon.
- V souvisejícím Nenitzescuova reduktivní acylace (1936) a nasycený uhlovodík přidává se, což z něj činí redukční acylaci na methylcyklohexylketon
- The Nencki reakce (1881) je kruhová acetylace fenolů kyselinami v přítomnosti chloridu zinečnatého.[30]
- V zelená chemie variace chlorid hlinitý je nahrazen grafit při alkylaci str-xylen s 2-brombutan. Tato variace nebude fungovat s primárními halogenidy, z nichž je odvozeno menší zapojení karbokace.[31]
Barviva
Friedel – Craftsovy reakce byly použity při syntéze několika triarylmethan a xanthen barviva.[32] Příkladem je syntéza thymolftalein (indikátor pH) ze dvou ekvivalentů thymol a anhydrid kyseliny ftalové:
Reakce anhydridu kyseliny ftalové s resorcinol v přítomnosti chlorid zinečnatý dává fluorofor fluorescein. Nahrazení resorcinolu N, N-diethylaminofenolem v této reakci dává rhodamin B:
Haworthovy reakce
The Haworthova reakce je klasická metoda pro syntézu 1-tetralon.[33] V této reakci benzen reaguje s anhydrid kyseliny jantarové, meziprodukt se redukuje a provede se druhá FC acylace s přídavkem kyseliny.[34]
V související reakci fenanthren je syntetizován z naftalen a anhydrid kyseliny jantarové v řadě kroků, které začínají FC acylací.
Friedel – Craftsův test na aromatické uhlovodíky
Reakce chloroform s aromatickými sloučeninami za použití an chlorid hlinitý katalyzátor poskytuje triarylmethany, které jsou často jasně zbarvené, jako je tomu v případě triarylmethanových barviv. Toto je zkušební test na aromatické sloučeniny.[35]
Viz také
- Ethylenoxid
- Friedelova rodina, bohatá linie francouzských vědců
- Hydrodealkylace
- Transalkylace
Reference
- ^ Friedel, C .; Crafts, J. M. (1877) „Sur une nouvelle méthode générale de synthèse d'hydrocarbures, d'acétones atd.“ Compt. Vykreslit., 84: 1392 & 1450.
- ^ Price, C. C. (1946). „Alkylace aromatických sloučenin Friedel-Craftsovou metodou“. Org. Reagovat. 3: 1. doi:10.1002 / 0471264180.nebo003.01. ISBN 0471264180.
- ^ Groves, J. K. (1972). „Friedel-Craftsova acylace alkenů“. Chem. Soc. Rev. 1: 73. doi:10.1039 / cs9720100073.
- ^ Eyley, S. C. (1991). „Alifatická Friedel-Craftsova reakce“. Kompr. Org. Synth. 2: 707–731. doi:10.1016 / B978-0-08-052349-1.00045-7. ISBN 978-0-08-052349-1.
- ^ Heaney, H. (1991). „Bimolekulární aromatická Friedel-Craftsova reakce“. Kompr. Org. Synth. 2: 733–752. doi:10.1016 / B978-0-08-052349-1.00046-9. ISBN 978-0-08-052349-1.
- ^ Rueping, M .; Nachtsheim, B. J. (2010). „Přehled nového vývoje Friedel-Craftsovy alkylace - od zelené chemie po asymetrickou katalýzu“. Beilstein J. Org. Chem. 6 (6): 6. doi:10,3762 / bjoc.6.6. PMC 2870981. PMID 20485588.
- ^ A b Smith, Michael B .; March, Jerry (2007), Pokročilá organická chemie: reakce, mechanismy a struktura (6. vydání), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ L., Williamson, Kenneth (4. ledna 2016). Organické experimenty na makroúrovni a na mikroúrovni. Masters, Katherine M. (sedmé vydání). Boston, MA, USA. ISBN 9781305577190. OCLC 915490547.
- ^ Smith, W. T. Jr.; Sellas, J. T. (1963). "Neophylchlorid". Organické syntézy.
- ^ Hajra, S .; Maji, B .; Bar, S. (2007). „Samarium triflát-katalyzovaná halogenem podporovaná Friedel-Craftsova alkylace s alkeny“. Org. Lett. 9 (15): 2783–2786. doi:10.1021 / ol070813t. PMID 17585769.
- ^ Anslyn, E .; Wallace, K. J .; Hanes, R .; Morey, J .; Kilway, K. V .; Siegel, J. (2005). "Příprava 1,3,5-tris (aminomethyl) -2,4,6-triethylbenzenu ze dvou univerzálních 1,3,5-tri (halogenem substituovaných) 2,4,6-triethylbenzenových derivátů". Syntéza. 2005 (12): 2080–2083. doi:10,1055 / s-2005-869963.
- ^ Norman, Richard Oswald Chandler; Coxon, James Morriss (1993). Principy organické syntézy (3. vyd.). London: Blackie Academic & Professional. ISBN 0751401269. OCLC 27813843.
- ^ Somerville, L. F .; Allen, C. F. H. (1933). „kyselina β-benzoylpropionová“. Organické syntézy. 13: 12. doi:10.15227 / orgsyn.013.0012.
- ^ „Desoxybenzoin“. www.orgsyn.org. Citováno 26. ledna 2019.
- ^ Friedel-Craftsova acylace. Organic-chemistry.org. Citováno 2014-01-11.
- ^ Fuson, R. C .; Weinstock, H. H .; Ullyot, G. E. (1935). "Nová syntéza benzoinů. 2 ', 4', 6'-trimethylbenzoin". J. Am. Chem. Soc. 57 (10): 1803–1804. doi:10.1021 / ja01313a015.
- ^ Clemmensen, E. (1913). „Reduktion von Ketonen und Aldehyden zu den entsprechenden Kohlenwasserstoffen unter Anwendung von amalgamiertem Zink und Salzsäure“. Chemische Berichte. 46 (2): 1837–1843. doi:10.1002 / cber.19130460292.
- ^ Clemmensen, E. (1914). „Über eine allgemeine Methode zur Reduktion der Carbonylgruppe in Aldehyden und Ketonen zur Methylengruppe“. Chemische Berichte. 47: 51–63. doi:10.1002 / cber.19140470108.
- ^ Clemmensen, E. (1914). „Über eine allgemeine Methode zur Reduktion der Carbonylgruppe in Aldehyden und Ketonen zur Methylengruppe. (III. Mitteilung.)“. Chemische Berichte. 47: 681–687. doi:10.1002 / cber.191404701107.
- ^ Gattermann, L .; Koch, J. A. (1897). „Eine Synthese aromatischer Aldehyde“. Ber. 30 (2): 1622–1624. doi:10,1002 / cber.18970300288.
- ^ L. Gattermann; W. Berchelmann (1898). "Synthese aromatischer Oxyaldehyde". Berichte der Deutschen Chemischen Gesellschaft. 31 (2): 1765–1769. doi:10,1002 / cber.18980310281.
- ^ Hoesch, Kurt (1915). "Eine neue Synthese aromatischer Ketone. I. Darstellung einiger Phenol-ketone". Berichte der Deutschen Chemischen Gesellschaft. 48 (1): 1122–1133. doi:10.1002 / cber.191504801156.
- ^ Houben, J. (1926). „Über die Kern-Kondensation von Phenolen und Phenol-äthern mit Nitrilen zu Phenol- und Phenol-äther-Ketimiden und -Ketonen (I.)“. Berichte der Deutschen Chemischen Gesellschaft (řada A a B). 59 (11): 2878–2891. doi:10.1002 / cber.19260591135.
- ^ M B Smith, J March. March's Advanced Organic Chemistry (Wiley, 2001) (ISBN 0-471-58589-0)
- ^ Grzybowski, M .; Skonieczny, K .; Butenschön, H .; Gryko, D. T. (2013). "Srovnání oxidační aromatické vazby a Schollovy reakce". Angew. Chem. Int. Vyd. 52 (38): 9900–9930. doi:10.1002 / anie.201210238. PMID 23852649.
- ^ Zincke, Th.; Suhl. R. (1906). „Ueber die Einwirkung von Tetrachlorkohlenstoff und Aluminiumchlorid auf str-Kresol und str-Kresolderivate ". Chemische Berichte. 39 (4): 4148–4153. doi:10,1002 / cber.190603904115.
- ^ Blanc, Gustave Louis (1923). Bulletin de la Société Chimique de France [4]. 33: 313–319. Chybějící nebo prázdný
| název =(Pomoc) - ^ G. Grassi a C. Maselli (1898) „Su alcuni derivati clorurati de trossimetilene“ (U některých chlorovaných derivátů 1,3,5-trioxanu), Gazzetta Chimica Italiana, 28 (část 2): 477-500; viz zejména str. 495.
- ^ Tato reakce soxid fosforečný: Kamp, J. V. D .; Mosettig, E. (1936). „Trans- a Cis-As-Octahydrophenanthrene“. Journal of the American Chemical Society. 58 (6): 1062–1063. doi:10.1021 / ja01297a514.
- ^ Nencki, M .; Sieber, N. (1881). „Ueber die Verbindungen der ein- und zweibasischen Fettsäuren mit Phenolen“. J. Prakt. Chem. (v němčině). 23: 147–156. doi:10.1002 / prac.18810230111.
- ^ Sereda, Grigoriy A .; Rajpara, Vikul B. (2007). „Zelená alternativa k alkylaci chloridu hlinitého xylenem“. J. Chem. Educ. 2007 (84): 692. Bibcode:2007JChEd..84..692S. doi:10.1021 / ed084p692.
- ^ McCullagh, James V .; Daggett, Kelly A. (2007). "Syntéza triarylmethanu a xanthenových barviv pomocí elektrofilních aromatických substitučních reakcí". J. Chem. Educ. 84 (11): 1799. Bibcode:2007JChEd..84,1799 mil. doi:10.1021 / ed084p1799 (neaktivní 22. listopadu 2020).CS1 maint: DOI neaktivní od listopadu 2020 (odkaz)
- ^ Haworth, Robert Downs (1932). "Syntézy alkylfenanthrenů. Část I. 1-, 2-, 3- a 4-methylfenanthren". J. Chem. Soc.: 1125. doi:10.1039 / JR9320001125.
- ^ Li, Jie Jack (2003) Název Reakce: Sbírka podrobných reakčních mechanismů Springer, ISBN 3-540-40203-9, str. 175.
- ^ John C. Gilbert., Stephen F. Martin. Brooks / Cole CENGAGE Learning, 2011. str. 872. 25.10 Aromatické uhlovodíky a arylhalogenidy - klasifikační zkouška. ISBN 978-1-4390-4914-3
Friedel – Craftsovy reakce zveřejněné dne Organické syntézy
Tato sekce používá citace že odkaz na nefunkční nebo zastaralé zdroje. (Ledna 2019) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
- Alkylace:
- Difenylaceton, Organic Syntheses, Coll. Sv. 3, s. 343 (1955); Sv. 29, s. 38 (1949) Odkaz na článek.
- Reakce str-xylen s chlormethan na durene Organic Syntheses, Coll. Sv. 2, s. 248 (1943); Sv. 10, s. 32 (1930). Odkaz na článek
- Syntéza benzofenon z benzen a tetrachlormethan Organic Syntheses, Coll. Sv. 1, s. 95 (1941); Sv. 8, s. 26 (1928).Odkaz na článek
- Acylace:
- Dibenzoylethylen Organic Syntheses, Coll. Sv. 3, s. 248 (1955); Sv. 20, s. 29 (1940) Odkaz na článek.
- reakce acenaften Plus kyselina jantarová Organic Syntheses, Coll. Sv. 3, s. 6 (1955); Sv. 20, s. 1 (1940).Odkaz na článek
- Desoxybenzoin Organic Syntheses, Coll. Sv. 2, s. 156 (1943); Sv. 12, s. 16 (1932). Odkaz na článek
- Acylace a fenanthren compound Organic Syntheses, sv. 80, s. 227 Odkaz
- Reakce brombenzen s anhydrid kyseliny octové Organic Syntheses, Coll. Sv. 1, s. 109 (1941); Sv. 5, s. 17 (1925). Odkaz na článek
- beta-methylanthrachinon, Organic Syntheses, Coll. Sv. 1, s. 353 (1941); Sv. 4, s. 43 (1925). Odkaz na článek
- Benzoylace ferrocen Organic Syntheses, Coll. Sv. 6, s. 625 (1988); Sv. 56, s. 28 (1977). Odkaz na článek