Schollova reakce - Scholl reaction
| Schollova reakce | |
|---|---|
| Pojmenoval podle | Roland Scholl |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| RSC ontologické ID | RXNO: 0000377 |
The Schollova reakce je vazebná reakce mezi dvěma arenové sloučeniny pomocí a Lewisova kyselina a a kyselina protická.[1][2] Je pojmenována po svém objeviteli, Roland Scholl, švýcarský chemik.

V roce 1910 Scholl uvedl syntézu chinonu [3] a ze dne perylen z naftalen [4] oba s chlorid hlinitý. Perylen byl také syntetizován z 1,1’-binaftalenu v roce 1913.[5] Syntéza Benzanthron bylo hlášeno v roce 1912.[6]
Protická kyselina v Schollově reakci je často nečistotou v Lewisově kyselině a také se tvoří v průběhu Schollovy reakce. Činidla jsou chlorid železitý v dichlormethan, chlorid měďnatý, PIFA a fluorid boritý etherát v dichlormethanu, Chlorid molybdeničitý a tetraacetát olovnatý s BF3 v acetonitril.[7]
Vzhledem k vysoké reakční teplotě a požadavku na silně kyselé katalyzátory the chemický výtěžek často je nízká a metoda není populární. Intramolekulární reakce lépe než mezimolekulární, například v EU organická syntéza z 9-fenylfluoren:

Nebo vznik pyren dibenzo- (a.1) -pyren z anthracen 1-fenylbenz (a) antracen (66% výtěžek).[8]

Jedna studie ukázala, že reakce je vhodná kaskádové reakce vytvořit složitější polycyklické aromatické uhlovodíky [9]
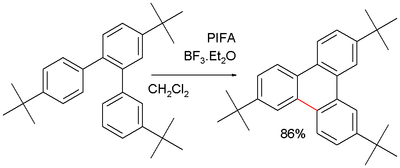
V některých aplikacích, jako je trifenylen syntéza je tato reakce obhajována jako alternativa k Suzukiho reakce. Opakující se problém je oligomerizace produktu, kterému lze zabránit blokováním terc-butyl substituenty:[7]
Reakční mechanismus
Přesný mechanismus reakce není známo, ale mohl by velmi dobře postupovat prostřednictvím areniový ion. Stejně jako v elektrofilní aromatická substituce, Aktivace skupin jako methoxy zlepšit výtěžek a selektivitu:[7]

Mohou soutěžit dva mechanismy. V prvním kroku a mechanismus radikálních kationtů A radikální kation je tvořen z jednoho reakčního partnera oxidací, ve druhém kroku radikál iont napadne druhého neutrálního partnera v substituční reakci a nový radikál iont je vytvořen s jedním prstencem nesoucím kladný náboj a druhým radikálovou pozicí. V kroku tři se dihydrogen štěpí s rearomatizace k biarylové sloučenině. V areniový iontový mechanismus jeden reakční partner je protonován k areniový ion který pak zaútočí na druhého reakčního partnera. Areniový iont může být také vytvořen útokem Lewisovy kyseliny. Mechanismy je obtížné odlišit, protože mnoho Lewisových kyselin se může chovat jako oxidanty. Reakce probíhající při teplotě místnosti se známými oxidačními činidly s jedním elektronem pravděpodobně probíhají prostřednictvím mechanismu radikálových kationtů a reakce vyžadující zvýšené teploty pravděpodobně probíhají prostřednictvím mechanismu areniových iontů.[2]
Reference
- ^ M B Smith, J March. March's Advanced Organic Chemistry (Wiley, 2001) (ISBN 0-471-58589-0)
- ^ A b Grzybowski, M., Skonieczny, K., Butenschön, H. a Gryko, D. T. (2013), Srovnání oxidační aromatické vazby a Schollova reakce. Angew. Chem. Int. Vyd., 52: 9900–9930. doi:10.1002 / anie.201210238
- ^ Scholl, R. a Mansfeld, J. (1910), meso-Benzdianthron (Helianthron), meso-Naphthodianthron, und ein neuer Weg zum Flavanthren. Ber. Dtsch. Chem. Ges., 43: 1734–1746. doi:10,1002 / cber.19100430288
- ^ Scholl, R., Seer, Chr. a Weitzenböck, R. (1910), Perylen, ein hoch kondensierter aromatischer Kohlenwasserstoff C20H12. Ber. Dtsch. Chem. Ges., 43: 2202–2209. doi:10,1002 / cber.191004302175
- ^ Weitzenböck, R. a Seer, C. (1913), Zur Kenntnis des Perylens und seiner Derivate. (2. Mitteilung). Ber. Dtsch. Chem. Ges., 46: 1994–2000. doi:10.1002 / cber.191304602115
- ^ Scholl, R. a Seer, C. (1912), Abspaltung aromatisch gebundenen Wasserstoffs und Verknüpfung aromatischer Kerne durch Aluminiumchlorid. Justus Liebigs Ann. Chem., 394: 111–177. doi:10,1002 / jlac.19123940202
- ^ A b C Ovládání Scholl reakce Benjamin T. King, Jií Kroulík, Charles R. Robertson, Pawel Rempala, Cameron L. Hilton, Justin D. Korinek a Lisa M. Gortari J. Org. Chem.; 2007; 72 (7), str. 2279 - 2288; (Článek) doi:10.1021 / jo061515x
- ^ Vingiello, F. A .; Yanez, J .; Campbell, J. A. J. Org. Chem. 1971, 36, 2053-2056. (doi:10.1021 / jo00814a005 )
- ^ Nanosized Molecular Propells by Cyclodehydrogenation of Polyphenylene Dendrimers Christopher D. Simpson, Gunter Mattersteig, Kai Martin, Lileta Gherghel, Roland E. Bauer, Hans Joachim Räder a Klaus Müllen J. Am. Chem. Soc.; 2004; 126 (10), str. 3139 - 3147; (Článek) doi:10.1021 / ja036732j
