Dihydrolipoyl transacetyláza - Dihydrolipoyl transacetylase
Dihydrolipoyl transacetyláza (nebo dihydrolipoamid acetyltransferáza) je enzym složka multienzymu komplex pyruvátdehydrogenázy. Komplex pyruvátdehydrogenázy je zodpovědný za dekarboxylace pyruvátu krok, který spojuje glykolýza do cyklus kyseliny citronové. To zahrnuje transformaci pyruvát z glykolýzy do acetyl-CoA který se poté použije v cyklu kyseliny citronové k provedení buněčné dýchání.
V komplexu pyruvátdehydrogenázy jsou tři různé enzymové složky. Pyruvátdehydrogenáza (EC 1.2.4.1) je odpovědný za oxidaci pyruvátu, dihydrolipoyl transacetyláza (tento enzym; EC 2.3.1.12) přenáší acetylovou skupinu na koenzym A (CoA) a dihydrolipoyl dehydrogenáza (EC 1.8.1.4) regeneruje lipoamid. Protože dihydrolipoyl transacetyláza je druhou ze tří enzymových složek účastnících se reakčního mechanismu pro přeměnu pyruvátu na acetyl CoA, je někdy označována jako E2.
U lidí spočívá v enzymatické aktivitě dihydrolipoyl transacetylázy složka pyruvátdehydrogenázy E2 (PDCE2), který je kódován DLAT (dihydrolipoamid S-Acetyltransferáza) gen.[5]
Nomenklatura
The systematické jméno z této třídy enzymů je acetyl-CoA: enzym N6- (dihydrolipoyl) lysin S-acetyltransferáza.
Mezi další běžně používaná jména patří:
- acetyl-CoA: dihydrolipoamid S-acetyltransferáza,
- acetyl-CoA: enzym 6-N- (dihydrolipoyl) lysin S-acetyltransferáza.
- dihydrolipoamid S-acetyltransferáza,
- dihydrolipoát acetyltransferáza,
- dihydrolipoic transacetyláza,
- dihydrolipoyl acetyltransferáza,
- enzym-dihydrolipoyllysin: acetyl-CoA S-acetyltransferáza,
- lipoát acetyltransferáza,
- lipoát-transacetyláza,
- lipoová acetyltransferáza,
- kyselina acetyltransferáza lipoové,
- lipoová transacetyláza,
- lipoylacetyltransferáza,
- thioltransacetyláza A a
- transacetyláza X.
Struktura
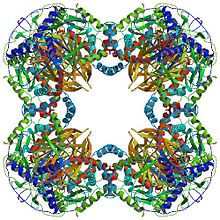
Všechny dihydrolipoyl transacetylázy mají jedinečnou vícedoménovou strukturu skládající se z (od N do C): 3 lipoylové domény, interakční doména a katalytická doména (viz architektura domény na Pfam ). Všechny domény jsou spojeny neuspořádanými spojovacími oblastmi s nízkou složitostí.
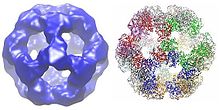
V závislosti na druhu může být více podjednotek enzymů dihydrolipoyl transacetylázy uspořádáno společně do kubického nebo dodekahedrálního tvaru. Tyto struktury pak tvoří katalytické jádro komplexu pyruvátdehydrogenázy, které nejen katalyzuje reakci, která přenáší acetylovou skupinu na CoA, ale také hraje zásadní strukturální roli při vytváření architektury celkového komplexu.[7]
Krychle
Struktura kubického jádra, nalezená u druhů, jako je Azotobacter vinelandii, se skládá z celkem 24 podjednotek.[8][9] Katalytické domény jsou sestaveny do trimerů s aktivním místem umístěným na rozhraní podjednotky. Topologie tohoto aktivního místa trimeru je stejná jako topologie chloramfenikol acetyltransferáza. Osm z těchto trimerů je poté uspořádáno do duté komolé kostky. Dva hlavní substráty, CoA a lipoamid (Lip (SH) 2), se nacházejí na dvou protilehlých vstupech 30 A dlouhého kanálu, který vede mezi podjednotkami a tvoří katalytické centrum. CoA vstupuje z vnitřní strany krychle a lipoamid vstupuje z vnějšku.[10]
Dodecahedron
U mnoha druhů, včetně bakterií, jako jsou Geobacillus stearothermophilus a Enterococcus faecalis [7] stejně jako savci, jako jsou lidé[11] a krávy,[12] dodekaedrická struktura jádra je tvořena celkem 60 podjednotkami. Podjednotky jsou uspořádány do sad po třech, podobně jako trimery ve tvaru kubického jádra, přičemž každá sada tvoří jeden z 20 dodekaedrických vrcholů.
Funkce
| dihydrolipoyllysin-reziduum acetyltransferáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 2.3.1.12 | ||||||||
| Číslo CAS | 9032-29-5 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Dihydrolipoyl-transacetyláza se účastní dekarboxylační reakce pyruvátu, která spojuje glykolýzu s cyklem kyseliny citronové. Tyto metabolické procesy jsou důležité pro buněčné dýchání - přeměna biochemické energie z živin na adenosintrifosfát (ATP), které pak mohou být použity k provádění mnoha biologických reakcí v buňce. Různé části buněčného dýchání probíhají v různých částech buňky. U eukaryot dochází ke glykolýze v cytoplazmě, dekarboxylaci pyruvátu v mitochondriích, cyklu kyseliny citronové v mitochondriální matrici a oxidační fosforylace přes elektronový transportní řetězec na mitochondriích cristae. Komplexy pyruvát-dehydrogenázy (obsahující enzymy dihydrolipoyl-transacetylázy) se tedy nacházejí v mitochondriích eukaryot (a jednoduše v cytosolu prokaryot).
Mechanismus
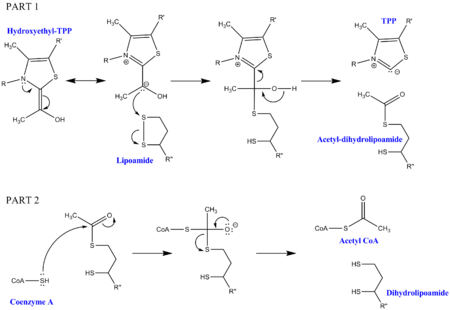
Dekarboxylace pyruvátu vyžaduje kromě enzymů, které tvoří komplex, i několik kofaktorů. První je thiamin pyrofosfát (TPP), který se používá pyruvátdehydrogenázou k oxidaci pyruvátu a k vytvoření hydroxyethyl-TPP meziproduktu. Tento meziprodukt se vyjme dihydrolipoyl-transacetylázou a nechá se reagovat s druhým lipoamidovým kofaktorem za vzniku acetyl-dihydrolipoylového meziproduktu, čímž se uvolní TPP. Tento druhý meziprodukt pak může být napaden nukleofilní sírou navázanou na koenzym A a dihydrolipoamid se uvolní. To má za následek produkci acetyl CoA, což je konečný cíl dekarboxylace pyruvátu. Dihydrolipoamid je absorbován dihydrolipoyl dehydrogenázou a pomocí dalších kofaktorů FAD a NAD + regeneruje původní lipoamid (s NADH jako užitečným vedlejším produktem).
Interaktivní mapa cest
Kliknutím na geny, bílkoviny a metabolity níže zobrazíte odkazy na příslušné články.[§ 1]
- ^ Interaktivní mapu cest lze upravit na WikiPathways: „GlycolysisGluconeogenesis_WP534“.
Klinický význam
Primární biliární cirhóza
Primární biliární cirhóza (PBC) je autoimunitní onemocnění charakterizovaný autoprotilátky proti mitochondriálním a jaderným antigenům. Tito se nazývají anti-mitochondriální protilátky (AMA) a anti-nukleární protilátky (ANA). Tyto protilátky jsou detekovatelné v séru pacientů s PBC a velmi se liší s ohledem na epitop specifičnost od pacienta k pacientovi. Z mitochondriálních antigenů, které mohou generovat reaktivitu autoprotilátek u pacientů s PBC, je nejběžnějším epitopem podjednotka E2 komplexu pyruvátdehydrogenázy, dihydrolipoyl-transacetyláza (další antigeny zahrnují enzymy komplexů 2-oxokyseliny a dehydrogenázy a další enzymy pyruvátdehydrogenázové komplexy).[13] Nedávné důkazy naznačují, že peptidy v katalytickém místě mohou u pacientů s PBC představovat imunodominantní epitopy rozpoznávané protilátkami anti-PDC-E2.[14] Existují také důkazy o anti-PDC-E2 protilátkách v autoimunitní hepatitida (AIH) pacientů.[15]
Nedostatek pyruvátdehydrogenázy
Nedostatek pyruvátdehydrogenázy (PDH) je genetické onemocnění vedoucí k laktátová acidóza stejně jako neurologická dysfunkce v kojeneckém a raném dětství. Typicky je PDH výsledkem mutace v X-vázaném genu pro podjednotku E1 komplexu pyruvátdehydrogenázy. Existuje však několik vzácných případů, kdy má pacient s PDH ve skutečnosti místo toho mutaci v autosomálním genu pro podjednotku E2. Bylo hlášeno, že tito pacienti mají mnohem méně závažné příznaky, přičemž nejvýznamnějším projevem onemocnění je epizodická dystonie, ačkoli oba hypotonie a ataxie byli také přítomni.[16]
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000150768 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000000168 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Leung PS, Watanabe Y, Munoz S, Teuber SS, Patel MS, Korenberg JR, Hara P, Coppel R, Gershwin ME (1993). „Chromozomová lokalizace a RFLP analýza PDC-E2: hlavní autoantigen primární biliární cirhózy“. Autoimunita. 14 (4): 335–40. doi:10.3109/08916939309079237. PMID 8102256.
- ^ Mattevi A, Obmolova G, Kalk KH, Teplyakov A, Hol WG (duben 1993). "Krystalografická analýza vazby na substrát a katalýzy v dihydrolipoyl transacetyláze (E2p)". Biochemie. 32 (15): 3887–901. doi:10.1021 / bi00066a007. PMID 8471601.
- ^ A b C PDB: 1B5S; Izard T, Aevarsson A, Allen MD, Westphal AH, Perham RN, de Kok A, Hol WG (únor 1999). „Zásady kvaziekvivalence a euklidovské geometrie řídí sestavu kubických a dodekaedrických jader komplexů pyruvát-dehydrogenázy“. Proc. Natl. Acad. Sci. USA. 96 (4): 1240–5. Bibcode:1999PNAS ... 96.1240I. doi:10.1073 / pnas.96.4.1240. PMC 15447. PMID 9990008.
- ^ de Kok A, Hengeveld AF, Martin A, Westphal AH (červen 1998). "Multiumenzymový komplex pyruvátdehydrogenázy z gramnegativních bakterií". Biochimica et Biophysica Acta (BBA) - proteinová struktura a molekulární enzymologie. 1385 (2): 353–66. doi:10.1016 / S0167-4838 (98) 00079-X. PMID 9655933.
- ^ Hanemaaijer R, Westphal AH, Van Der Heiden T, De Kok A, Veeger C (únor 1989). „Kvartérní struktura dihydrolipoyl-transacetylázové složky komplexu pyruvátdehydrogenázy z Azotobacter vinelandii. Opětovné posouzení“. European Journal of Biochemistry / FEBS. 179 (2): 287–92. doi:10.1111 / j.1432-1033.1989.tb14553.x. PMID 2917567.
- ^ Mattevi A, Obmolova G, Schulze E, Kalk KH, Westphal AH, de Kok A, Hol WG (březen 1992). „Atomová struktura kubického jádra multienzymového komplexu pyruvátdehydrogenázy“. Věda. 255 (5051): 1544–50. Bibcode:1992Sci ... 255.1544M. doi:10.1126 / science.1549782. PMID 1549782.
- ^ Brautigam CA, Wynn RM, Chuang JL, Chuang DT (květen 2009). "Podjednotka a katalytická složka stechiometrie in vitro rekonstituovaného komplexu lidské pyruvátdehydrogenázy". The Journal of Biological Chemistry. 284 (19): 13086–98. doi:10,1074 / jbc.M806563200. PMC 2676041. PMID 19240034.
- ^ Zhou ZH, McCarthy DB, O'Connor CM, Reed LJ, Stoops JK (prosinec 2001). „Pozoruhodná strukturní a funkční organizace komplexů eukaryotických pyruvátdehydrogenáz“. Sborník Národní akademie věd Spojených států amerických. 98 (26): 14802–7. Bibcode:2001PNAS ... 9814802Z. doi:10.1073 / pnas.011597698. PMC 64939. PMID 11752427.
- ^ Mackay IR, Whittingham S, Fida S, Myers M, Ikuno N, Gershwin ME, Rowley MJ (duben 2000). „Zvláštní autoimunita primární biliární cirhózy“. Imunologické recenze. 174: 226–37. doi:10.1034 / j.1600-0528.2002.017410.x. PMID 10807519. S2CID 596338. Archivovány od originál dne 05.01.2013.
- ^ Braun S, Berg C, Buck S, Gregor M, Klein R (únor 2010). „Katalytická doména PDC-E2 obsahuje epitopy rozpoznané antimitochondriálními protilátkami v primární biliární cirhóze“. World Journal of Gastroenterology. 16 (8): 973–81. doi:10,3748 / wjg.v16.i8.973. PMC 2828602. PMID 20180236. Archivovány od originál dne 01.03.2012.
- ^ O'Brien C, Joshi S, Feld JJ, Guindi M, Dienes HP, Heathcote EJ (srpen 2008). „Dlouhodobé sledování autoimunitní hepatitidy pozitivní na antimitochondriální protilátky.“ Hepatologie. 48 (2): 550–6. doi:10.1002 / hep.22380. PMID 18666262. S2CID 5400712.
- ^ Head RA, Brown RM, Zolkipli Z, Shahdadpuri R, King MD, Clayton PT, Brown GK (srpen 2005). „Klinické a genetické spektrum deficitu pyruvátdehydrogenázy: deficit dihydrolipoamid acetyltransferázy (E2)“. Annals of Neurology. 58 (2): 234–41. doi:10,1002 / ana.20550. PMID 16049940. S2CID 38264402.
Další čtení
- Mattevi A, Obmolova G, Kalk KH, Teplyakov A, Hol WG (duben 1993). "Krystalografická analýza vazby na substrát a katalýzy v dihydrolipoyl transacetyláze (E2p)". Biochemie. 32 (15): 3887–901. doi:10.1021 / bi00066a007. PMID 8471601.
- Brady RO, Stadtman ER (prosinec 1954). "Enzymatická thioltransacetylace". The Journal of Biological Chemistry. 211 (2): 621–9. PMID 13221570.
- Gunsalus IC, Barton LS, Gruber W (1956). "Biosyntéza a struktura derivátů kyseliny lipoové". J. Am. Chem. Soc. 78 (8): 1763–1766. doi:10.1021 / ja01589a079.
- Perham RN (2000). "Kyvné ramena a kyvné domény v multifunkčních enzymech: katalytické stroje pro vícestupňové reakce". Roční přehled biochemie. 69: 961–1004. doi:10,1146 / annurev.biochem.69.1.961. PMID 10966480.
- Howard MJ, Fuller C, Broadhurst RW, Perham RN, Tang JG, Quinn J, Diamond AG, Yeaman SJ (červenec 1998). „Trojrozměrná struktura hlavního autoantigenu u primární biliární cirhózy“. Gastroenterologie. 115 (1): 139–46. doi:10.1016 / S0016-5085 (98) 70375-0. PMID 9649469.
- Matsumura S, Kita H, He XS, Ansari AA, Lian ZX, Van De Water J, Yamamoto K, Tsuji T, Coppel RL, Kaplan M, Gershwin ME (listopad 2002). "Komplexní mapování HLA-A0201-omezených CD8 T-buněčných epitopů na PDC-E2 v primární biliární cirhóze". Hepatologie. 36 (5): 1125–34. doi:10.1053 / jhep.2002.36161. PMID 12395322. S2CID 20687454.
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, Suyama A, Sugano S (říjen 1997). "Konstrukce a charakterizace knihovny cDNA obohacené o celou délku a 5'-end". Gen. 200 (1–2): 149–56. doi:10.1016 / S0378-1119 (97) 00411-3. PMID 9373149.
- Korotchkina LG, Patel MS (únor 2008). "Vazba pyruvátdehydrogenázy na jádro komplexu lidské pyruvátdehydrogenázy". FEBS Dopisy. 582 (3): 468–72. doi:10.1016 / j.febslet.2007.12.041. PMC 2262399. PMID 18206651.
- Head RA, Brown RM, Zolkipli Z, Shahdadpuri R, King MD, Clayton PT, Brown GK (srpen 2005). „Klinické a genetické spektrum deficitu pyruvátdehydrogenázy: deficit dihydrolipoamid acetyltransferázy (E2)“. Annals of Neurology. 58 (2): 234–41. doi:10,1002 / ana.20550. PMID 16049940. S2CID 38264402.
- Bogdanos DP, Pares A, Baum H, Caballeria L, Rigopoulou EI, Ma Y, Burroughs AK, Rodes J, Vergani D (červen 2004). „Specifická zkřížená reaktivita mezi napodobujícími peptidy proteinu tepelného šoku Mycobacterium gordonae a dominantním epitopem podjednotky E2 pyruvátdehydrogenázy je běžná u španělských, ale ne britských pacientů s primární biliární cirhózou.“ Časopis autoimunity. 22 (4): 353–62. doi:10.1016 / j.jaut.2004.03.002. PMID 15120760.
- Lleo A, Selmi C, Invernizzi P, Podda M, Coppel RL, Mackay IR, Gores GJ, Ansari AA, Van de Water J, Gershwin ME (březen 2009). „Apotopy a biliární specificita primární biliární cirhózy“ (PDF). Hepatologie. 49 (3): 871–9. doi:10,1002 / hep.22736. hdl:2434/55031. PMC 2665925. PMID 19185000.
- Bellucci R, Oertelt S, Gallagher M, Li S, Zorn E, Weller E, Porcheray F, Alyea EP, Soiffer RJ, Munshi NC, Gershwin ME, Ritz J (březen 2007). „Diferenciální epitopové mapování protilátek proti PDC-E2 u pacientů s hematologickými malignitami po alogenní transplantaci hematopoetických kmenových buněk a primární biliární cirhóze“. Krev. 109 (5): 2001–7. doi:10.1182 / krev-2006-06-030304. PMC 1801041. PMID 17068145.
- Hiromasa Y, Roche TE (září 2003). „Usnadněná interakce mezi izoformou 2 pyruvátdehydrogenázové kinázy 2 a dihydrolipoylacetyltransferázou“. The Journal of Biological Chemistry. 278 (36): 33681–93. doi:10,1074 / jbc.M212733200. PMID 12816949.
- Trynka G, Zhernakova A, Romanos J, Franke L, Hunt KA, Turner G, Bruinenberg M, Heap GA, Platteel M, Ryan AW, de Kovel C, Holmes GK, Howdle PD, Walters JR, Sanders DS, Mulder CJ, Mearin ML, Verbeek WH, Trimble V, Stevens FM, Kelleher D, Barisani D, Bardella MT, McManus R, van Heel DA, Wijmenga C (srpen 2009). „Varianty rizika spojené s celiakií v TNFAIP3 a REL implikují změněnou signalizaci NF-kappaB“. Střevo. 58 (8): 1078–83. doi:10.1136 / gut.2008.169052. PMID 19240061. S2CID 17111427.
- Hiromasa Y, Fujisawa T, Aso Y, Roche TE (únor 2004). „Organizace jader savčího komplexu pyruvátdehydrogenázy tvořeného E2 a E2 plus protein vázající E3 a jejich schopnosti vázat složky E1 a E3“. The Journal of Biological Chemistry. 279 (8): 6921–33. doi:10,1074 / jbc.M308172200. PMID 14638692.
- Cori CF (1981). "Cyklus glukóza-kyselina mléčná a glukoneogeneze". Aktuální témata buněčné regulace. 18: 377–87. doi:10.1016 / B978-0-12-152818-8.50028-1. ISBN 9780121528188. PMID 7273846.
- Maruyama K, Sugano S (leden 1994). „Oligo-capping: jednoduchá metoda k nahrazení struktury cap eukaryotických mRNA oligoribonukleotidy“. Gen. 138 (1–2): 171–4. doi:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Tuganova A, Boulatnikov I, Popov KM (srpen 2002). „Interakce mezi jednotlivými izoenzymy pyruvátdehydrogenázové kinázy a vnitřní doménou nesoucí lipoyl transacetylázové složky komplexu pyruvátdehydrogenáza“. The Biochemical Journal. 366 (Pt 1): 129–36. doi:10.1042 / BJ20020301. PMC 1222743. PMID 11978179.
externí odkazy
- PDB: 1EAA, PDB: 1 dBp
- Dihydrolipoyl + transacetyláza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P10515 (Dihydrolipoyl transacetyláza) na PDBe-KB.
ATP ADP ATP ADP + + 2 ×  2 ×  2 × 3-fosfoglycerát 2 ×  2 × 2-fosfoglycerát 2 ×  2 × Fosfoenolpyruvát 2 ×  ADP ATP 2 × Pyruvát 2 × |


















