Zingibain - Zingibain
| Zingibain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
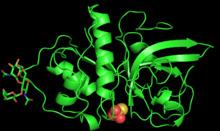 PYMOL generoval 3D strukturu monomeru zingibainu | |||||||||
| Identifikátory | |||||||||
| EC číslo | 3.4.22.67 | ||||||||
| Číslo CAS | 246044-91-7 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Zingibain, zingipainnebo zázvorová proteáza (ES 3.4.22.67 ) je cysteinová proteáza enzym nalezen v Zrzavý (Zingiber officinale ) oddenky.[1][2][3] To katalýzy preferenční výstřih z peptidy s prolin zbytek v poloze P2. Má dva odlišné formuláře, zázvorová proteáza I (GP-I) a zázvorová proteáza II (GP-II).[4]
Jako člen rodiny papainů cysteinových proteáz sdílí zingibain několik strukturních a funkčních podobností s dobře studovanými enzymy, jako je papain, bromelain, a aktinidin. Tyto peptidázy obsahují ve svých centrech aktivní cysteinový zbytek, který katalyzuje hydrolytické štěpení peptidových vazeb. Zingibain je známý pro svou činnost jako proteináza a a kolagenáza.[1]
Poprvé byl izolován, čištěn a uveden v roce 1973 Ichikawou a kol. na Japonská ženská univerzita.[5] Nedávno bylo zjištěno, že zingibain existuje jako dva isozymy GP-I a GP-II, které byly izolovány chromatografií, s molekulovou hmotností přibližně 22 500 Da.[5]
Mechanismus
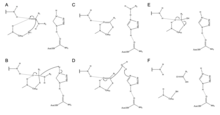
Zingibain využívá ve svém aktivním místě katalytickou triádu zbytků Cys, His a Asn za účelem hydrolytického štěpení peptidových vazeb. Přítomnost Asn175 stabilizuje imidazol jeho kruhu, což zajišťuje jeho optimální umístění pro katalyzování hydrolýzy.
Mechanismus začíná přenosem protonů z Cys25 do His159.[6] Sulfidový anion pak napadá aminokyseliny alfa uhlík, přemístění aminová skupina, který se váže k His159.[6] Alfa uhlík na stabilizované aminokyselině je poté napaden molekulou vody, která vytěsňuje sulfid Cys25, aby přeměnila aminokyselinu na karboxylová kyselina, který se uvolňuje z aktivního místa enzymu.[6]
Experimentální představení dithiothreitol, známý thiolová skupina Protektor, zlepšuje proteolytickou aktivitu a poskytuje další ověření důležitosti zbytku centrálního cysteinu pro enzymatickou aktivitu.[7]
Zingibain vykazuje maximální rychlost obratu při 60 ° C a rychle se denaturuje při 70 ° C.[8] Během vaření se zázvorem není proteolýza do značné míry narušena. Optimální teplotní rozsahy papainu a ficinu jsou zvýšené vzhledem k zingibainu, zatímco bromelain pracuje v mírně nižším rozmezí.[7]
Maximální proteolytická aktivita zingibainu se vyskytuje při pH 6,0, i když je enzym stále aktivní v rozmezí pH od 4,5 do 6,0 (optimální pH pro masové marinády ).[7]
GP-II, kyselější ze dvou izozymů, vykazuje a pI 4,82 a GP-I vykazuje hodnoty pI na 5,05 nebo 5,16.[1] Tyto mnohonásobné hodnoty pI podporují teorii, že GP-I může být směsí dvou proteinů.
Struktura
Zingibain byl poprvé purifikován a charakterizován rentgenovou krystalografií v roce 2000 vědci z Bostonská univerzita.[1]
Enzym je dlouhý 221 aminokyselin a glykosylován 2 N-vázaný oligosacharid řetězce na Asn96 a Asn154.[3] Polypeptidový řetězec zingibainu se skládá do dvou polárních domén zhruba stejné velikosti, rozdělených centrální neutrální štěrbinou.[3] První doména obsahuje alfa helixy a druhý má antiparalelní beta listy.[3] Toto oddělení polárních a nepolárních oblastí usnadňuje interakce protein-protein mezi enzymem a širokou škálou substrátů.[3]
Aktivní místo zingibainu, umístěné v centrální štěrbině, je hluboké 5,5 Å a dlouhé 9,5 Å.[3] Aktivní místo obsahuje katalytickou triádu Cys25, His159 a Asn175, které obě společně umožňují kyselou / bazickou katalýzu.
Zingibain vykazuje vazebnou specificitu k peptidovým substrátům s prolinem v poloze P2.[1] Podřízený web S2 zingibainu obsahuje aminokyselinový řetězec Trp67-Met68-Asn69-Thr133-Ala157, díky kterému je místo příliš kompaktní na to, aby pojalo větší hydrofobní zbytky aromatického substrátu, které jsou zvýhodňovány jinými enzymy v rodině papainů.[1] Prolin je však stabilizován několika nekovalentními interakcemi s touto oblastí.
Struktura enzymu je stabilizována Vodíkové vazby, stejně jako síťování sulfidové vazby mezi třemi páry cysteinových zbytků (Cys22-Cys63, Cys56-Cys95 a Cys153-Cys200), analogické s mnoha jinými papainy.[1]
Zatímco enzym existuje jako monomer v roztoku, tvoří se krystalizovaný zingibain tetramery, nebo dimery dimerů, spojené glykosylačními řetězci na každé podjednotce. Zingibain vykazuje N-vázané oligosacharidové řetězce komplexního typu na dvou zbytcích.[1] Řetězy jsou dlouhé mezi 5-13 glykosylovými jednotkami a jsou složeny z N-acetylglukosamin, fukóza, manóza, a xylóza. Sekvence cukru zingibainu jsou téměř identické s oligosacharidy pozorovanými v lektinech z Japonská pagoda strom semena, lak a z klen buňky a S-glykoproteiny z Brassica campestris.[1]
Biologický význam
V zázvorových oddencích se zázvorová proteáza účastní několika funkčních rolí pro údržbu a údržbu rostlinné buňky.
Zingibain, stejně jako většina cysteinových proteáz, je syntetizován jako 40-50 kDa proprotein v cytoplazmě polysomy vázán buněčné membrány.[9] V rámci endoplazmatické retikulum, tyto podlouhlé řetězce jsou označeny a KDEL Retenční signál ER a umístěn do velkého KDEL vezikuly které přecházejí z ER na skladování proteinů vakuoly v buněčné stěny.[9]
Zingibain se pravděpodobně podílí na skladování bílkovin (v rámci EU) semena nebo rostlinná tkáň ), ale převážně degraduje a mobilizuje zásobní proteiny. Může také reagovat na abiotický a biotický zdůrazňuje, jako je tepelný šok, nízké teploty a dehydratace, k vyloučení jakýchkoli výsledných chybně přeložených nebo denaturovaný bílkoviny.[9]
Použití
Zjemňovač masa
Jako papain z papáje a bromelain z ananas, používá se jako změkčovadlo masa.[10][11]
Když se zingibain přidává do masa na vaření, obvykle do syrového nebo sušeného zázvoru, zvyšuje jeho citlivost.[8][12] Tendence masa probíhá zejména díky rychlé proteolýze hlavních svalových proteinů zingibainu aktomyosin a Kolagen typu I., který se nachází v svalové klouby.[8]
Zatímco jiné papainové enzymy, včetně papainu, ficinu a bromelainu, se běžněji používají ke zjemnění masa, zingibain vykazuje podobnou nebo zvýšenou proteolytickou aktivitu.[11] Ve skutečnosti je zingibain jedinou katalogizovanou rostlinnou proteázou s kolagenolytickou aktivitou. Zingibain může být výhodnější změkčovadlo masa než papain kvůli výsledné struktuře vyráběného masa. Zatímco papain může hydrolyzovat aktomyosin, rozkládá také další hlavní tkáňové proteiny, které vedou k kašovité struktuře masa.[11] Specifičnost vazby zingibainu zajišťuje převládající hydrolyzaci aktomyosinu a kolagenu typu I.
Zingibain se také používá k aromatizaci klobásy a pečené výrobky.[8]
Náhrada syřidla
Za posledních 100 let se zázvorová proteáza tradičně používá ke srážení mléko vytvořit tvaroh ze zázvorového mléka, gelovitý Kantonské jídlo z horkého mléka a zázvorový džus. Schopnost srážení mléka a specificita zázvorové proteázy k proteolýze κ-kasein učinit z enzymu potenciální zeleninu syřidlo náhradní pro výroba sýrů.
Koagulace mléka se tradičně provádí koagulací enzymů extrahovaných ze zdrojů, jako je syřidlo. V syřidle tři chymosin isozymy hydrolyzují κ-kasein, hlavní proteinovou frakci v mléce, mezi Phe105 a Met106. Hydrofilní subregiony κ-kaseinu jsou odštěpeny a zanechávají za sebou převážně hydrofobní agregát. Enzymy tak destabilizují κ-kasein micely a podporovat shlukování hydrofobních proteinových zbytků, což způsobuje srážení mléka.
Mezi hlavní průmyslové nevýhody syřidla patří jeho omezená nabídka a vysoké náklady, jeho nepřístupnost vegetariáni a procvičování členů určitých náboženské skupiny a nedávné evropské národní zákazy používání rekombinantní telecí syřidlo.[13] Plísňové proteázy jsou z velké části nevhodné jako náhrady syřidla a ukázalo se, že enzymy z mnoha rostlinných extraktů produkují nízké výtěžky, špatnou strukturu a hořkou chuť sýra.[13]
Obchodní nevýhody
Surová zázvorová proteáza extrahovaná ze zázvorového extraktu je však nestabilní, s a poločas rozpadu asi 2 dny při 5 ° C, což je pro komerční aplikace problematické.[14] I když poločas enzymu nebrání jeho účinnosti během vaření, vyžaduje tato nízká stabilita při skladování komercializaci zlepšení.
Komerční pokusy stabilizovat enzym pro produkci ve velkém měřítku zkoumaly potenciální metody k inaktivaci volných látek sulfhydrylová skupina v aktivním místě enzymu. Mechanické možnosti zahrnují oxidaci sulfhydrylu a jeho výměnu za disulfidové můstky, formování chinon -thiolové adukty nebo vázání sulfhydrylu na a ion těžkých kovů.[14] 0.2% askorbát sodný Bylo zjištěno, že stabilizuje zingibain až 14 dnů při 5 ° C, zatímco srovnatelné koncentrace EDTA a CaCl2 měl minimální dopad na stabilitu.[14]
Bylo pozorováno, že se zingibain sám deaktivuje autolýza, které lze předem reagovat reakcí aktivní sulfhydrylové skupiny s cystin nebo PCMB.[14]
Aceton prášky jsou životaschopnou komerční metodou stabilizace zingibainu. Po hydrofobní rostlině polyfenoly Pokud se surový zázvor odstraní, přidá se při nízkých teplotách acetonový prášek za účelem dehydratace kořenové dřeně.[14] Enzym je stabilizován kvůli snížené aktivitě vody, nižším koncentracím rostlinných pigmentů a tužším 3D strukturám při nižších teplotách.[14]
Viz také
Reference
- ^ A b C d E F G h i Choi KH, Laursen RA (2000). „Aminokyselinová sekvence a glykanové struktury cysteinových proteáz se specificitou prolin z oddenku zázvoru Zingiber officinale“. Eur. J. Biochem. 267 (5): 1516–26. doi:10.1046 / j.1432-1327.2000.01152.x. PMID 10691991.
- ^ Ohtsuki K, Taguchi K, Sato K a kol. (1995). "Čištění zázvorových proteáz pomocí DEAE-Sepharose a izoelektrické fokusace". Biochim. Biophys. Acta. 1243 (2): 181–4. doi:10.1016 / 0304-4165 (94) 00145-n. PMID 7873561.
- ^ A b C d E F Choi KH, Laursen RA, Allen KN (1999). „2.1 Struktura cysteinové proteázy se specifičností na prolin z oddenku zázvoru, Zingiber officinale“. Biochemie. 38 (36): 11624–33. doi:10.1021 / bi990651b. PMID 10512617.
- ^ Huang XW, Chen LJ, Luo YB a kol. (2011). „Čištění, charakterizace a koagulační vlastnosti zázvorových proteáz“. J. Dairy Sci. 94 (5): 2259–69. doi:10.3168 / jds.2010-4024. PMID 21524515.
- ^ A b 喜 美 代, 道;初 世, 佐 々;芳 江, 市 川 (1973). „シ ョ ウ ガ た ん 白 分解 酵素 の 分離 精製“. 栄 養 と 食糧 (v japonštině). 26 (6): 377–383. doi:10,4327 / jsnfs1949.26.377. ISSN 1883-8863.
- ^ A b C Rzychon M, Chmiel D, Stec-Niemczyk J (2004). "Režimy inhibice cysteinových proteáz". Acta Biochimica Polonica. 51 (4): 861–73. PMID 15625558.
- ^ A b C Thompson EH, Wolf ID, Allen CE (1973). „Ginger Rhizome: New Source of Proteolytic Enzyme“. J. Food Sci. 38 (4): 652–655. doi:10.1111 / j.1365-2621.1973.tb02836.x.
- ^ A b C d Lee YB, Sehnert DJ, Ashmore CR (1986). „Výběrové řízení na maso s proteázou oddenku zázvoru“. J. Food Sci. 51 (6): 1558–1559. doi:10.1111 / j.1365-2621.1986.tb13860.x.
- ^ A b C Grudkowska M, Zagdańska B (2004). "Multifunkční role rostlinných cysteinových proteináz". Acta Biochimica Polonica. 51 (3): 609–24. doi:10.18388 / abp.2004_3547. PMID 15448724.
- ^ Ha M, Bekhit AE, Carne A a kol. (2012). "Charakterizace komerčních přípravků na bázi papainu, bromelainu, aktinidinu a zingibain proteázy a jejich aktivity vůči masným proteinům". Food Chem. 134 (1): 95–105. doi:10.1016 / j.foodchem.2012.02.071.
- ^ A b C Kim M, Hamilton SE, Guddat LW a kol. (2007). "Rostlinná kolagenáza: jedinečná kolagenolytická aktivita cysteinových proteáz ze zázvoru". Biochim. Biophys. Acta. 1770 (12): 1627–35. doi:10.1016 / j.bbagen.2007.08.003. PMID 17920199.
- ^ Moon SS (2018). „Vliv proteolytických enzymů a zázvorového extraktu na tendrování M. pectoralis profundus od Holstein Steer ". Korejský deník pro potravinovou vědu o živočišných zdrojích. 38 (1): 143–151. doi:10.5851 / kosfa.2018.38.1.143. PMC 5932962. PMID 29725232.
- ^ A b Hashim MM, Mingsheng D, Iqbal MF a kol. (2011). „Oddenek zázvoru jako potenciální zdroj mléka srážejícího cysteinovou proteázu“. Fytochemie. 72 (6): 458–64. doi:10.1016 / j.phytochem.2010.12.002. PMID 21353685.
- ^ A b C d E F Adulyatham P, Owusu-Apenten R (2005). „Stabilizace a částečné čištění proteázy z oddenku zázvoru (Zingiber offinale Roscoe) ". J. Food Sci. 70 (3): C231 – C234. doi:10.1111 / j.1365-2621.2005.tb07130.x.
externí odkazy
- Zingipain v americké národní lékařské knihovně Lékařské předměty (Pletivo)
