Dithiothreitol - Dithiothreitol
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC (2S,3S) -1,4-Bis (sulfanyl) butan-2,3-diol | |
| Ostatní jména (2S,3S) -1,4-dimerkaptobutan-2,3-diol D-threo-1,4-dimerkaptobutan-2,3-diol D-threo-1,4-dimerkapto-2,3-butandiol 1,4-dithio-D-treitol Clelandovo činidlo Reduktakryl | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.020.427 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C4H10Ó2S2 | |
| Molární hmotnost | 154,253 g / mol |
| Vzhled | Bílá pevná látka |
| Bod tání | 42 až 43 ° C (108 až 109 ° F; 315 až 316 K) |
| Bod varu | 125 až 130 ° C (257 až 266 ° F; 398 až 403 K) při 2 mmHg |
| Rozpustný | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
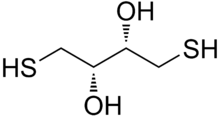
Dithiothreitol (DTT) je běžný název pro malou molekulu redox činidlo známé také jako Cleland činidlo.[2] Vzorec DTT je C.4H10Ó2S2 a chemická struktura jednoho z nich enantiomery ve zmenšené podobě je zobrazen vpravo; jeho oxidovaná forma je a disulfidově vázaný 6-členný kruh (zobrazeno níže). Činidlo se běžně používá v racemické formě, protože oba enantiomery jsou reaktivní. Jeho název je odvozen od čtyřkarbonu cukr, threose. DTT má epimerní („sesterská“) sloučenina, dithioerythritol (DTE).
Redukční prostředek
DTT je a redukční činidlo; po oxidaci vytvoří stabilní šestičlenný kruh s vnitřním disulfidová vazba. Má redoxní potenciál −0,33 V při pH 7.[1] Redukce typické disulfidové vazby probíhá dvěma po sobě následujícími thiol-disulfidová výměna reakce a je ilustrován níže. Redukce se obvykle nezastaví u směsných disulfidových druhů, protože druhý thiol DTT má vysokou tendenci uzavírat kruh, tvořit oxidovaný DTT a zanechávat po sobě redukovaný disulfidová vazba. Redukční síla DTT je omezena na hodnoty pH nad 7, protože pouze záporně nabité thiolát formuláře− je reaktivní (protonovaný thiol forma -SH není); the pKa thiolových skupin je 9,2 a 10,1.

Aplikace
DTT se používá jako redukční nebo "deprotekční" činidlo pro thiolovanou DNA. Koncové atomy síry thiolované DNA mají tendenci se tvořit dimery v roztoku, zejména v přítomnosti kyslíku. Dimerizace výrazně snižuje účinnost následných vazebných reakcí, jako je imobilizace DNA na zlato v biosenzorech. Typicky je DTT smíchán s roztokem DNA a ponechán reagovat, a poté je odstraněn filtrací (pro pevný katalyzátor) nebo chromatografie (pro kapalnou formu). Postup odstranění DTT se často nazývá „odsolování“. Obecně se DTT používá jako ochranný prostředek, který zabraňuje oxidaci thiolové skupiny.
DTT se často používá ke snížení disulfidové vazby z bílkoviny a obecněji k prevenci intramolekulární a mezimolekulární mezi vznikajícími disulfidovými vazbami cystein zbytky bílkovin. Avšak ani DTT nemůže redukovat pohřbené (nepřístupné rozpouštědlu) disulfidové vazby, takže redukce disulfidových vazeb se někdy provádí za denaturační podmínky (např. při vysoké teploty, nebo v přítomnosti silného denaturantu, jako je 6 M. guanidiniumchlorid, 8 mil močovina nebo 1% dodecylsulfát sodný ). DTT se často používá spolu s dodecylsulfátem sodným v SDS-PAGE dále denaturovat proteiny snížením jejich disulfidových vazeb, aby se umožnilo lepší oddělení proteinů během elektroforéza. Kvůli schopnosti redukovat disulfidové vazby lze DTT použít k denaturaci CD38 na červených krvinkách. Naopak expozice rozpouštědlu různých disulfidových vazeb může být testována jejich rychlostí redukce v přítomnosti DTT.
DTT lze také použít jako oxidační činidlo. Jeho hlavní výhodou je, že na rozdíl od jiných agens, jako je například, nejsou osídleny žádné smíšené disulfidové druhy glutathion. Ve velmi vzácných případech DTT adukt mohou vznikat, tj. mohou se tvořit dva atomy síry DTT disulfidové vazby na různé atomy síry; v takových případech DTT nemůže cyklizovat, protože nemá žádné takové zbývající volné thioly.
Vlastnosti
DTT je nestabilní za okolních atmosférických podmínek, protože je oxidován kyslíkem; DTT by měly být skladovány a manipulovány pod inertními plyny, aby se zabránilo oxidaci. Skladovatelnost dithiothreitolu lze prodloužit chlazením na 2–8 ° C.[3] Oxidace představuje další komplikace, protože oxidovaný DTT vykazuje silný vrchol absorbance při 280 nm. Vzhledem k tomu, že thioly jsou méně nukleofilní než jejich konjugované báze, thioláty Při poklesu pH se DTT stává méně účinným nukleofilem. (2S) -2-Amino-1,4-dimerkaptobutan (dithiobutylamin nebo DTBA) je nové činidlo redukující dithiol, které poněkud překonává toto omezení DTT.[4] Tris (2-karboxyethyl) fosfin (TCEP ) je alternativní redukční činidlo, které je stabilnější a účinnější při nízkém pH, ale je objemné a redukuje cystiny ve složených proteinech jen pomalu.[5]
Poločas DTT je 40 hodin při pH 6,5 a 1,4 hodiny při pH 8,5 a 20 ° C; jeho poločas se s rostoucí teplotou dále snižuje. Přítomnost někoho EDTA (kyselina ethylendiamintetraoctová) k chelataci dvojmocných kovových iontů (Fe2+, Cu2+ a další) výrazně zvyšuje poločas rozpadu DTT v roztoku.[6]
Reference
- ^ A b M. J. O'Neil, ed. do (2001). Merck Index: encyklopedie chemikálií, léků a biologických látek: 13. vydání (13. vyd.). USA: MERCK & CO INC. ISBN 0-911910-13-1.CS1 maint: další text: seznam autorů (odkaz)
- ^ Cleland, W. W. (1964). "Dithiothreitol, nové ochranné činidlo pro SH skupiny". Biochemie. 3 (4): 480–482. doi:10.1021 / bi00892a002. PMID 14192894.
- ^ "NLM PubChem CID Index", Příručka o vitaminu D.„John Wiley & Sons, Inc., s. 239–244, 2007, doi:10.1002 / 9780470238165.indsp1, ISBN 978-0-470-23816-5
- ^ Lukesh, III, J. C .; Palte, M. J .; Raines, R. T. (2012). „Silné, univerzální redukční činidlo z kyseliny asparagové“. Journal of the American Chemical Society. 134 (9): 4057–4059. doi:10.1021 / ja211931f. PMC 3353773. PMID 22353145.
- ^ Cline, D. J .; Redding, S.E .; Brohawn, S. G .; Psathas, J. N .; Schneider, J. P .; Thorpe, C. (2004). „Nové ve vodě rozpustné fosfiny jako redukční činidla peptidových a proteinových disulfidových vazeb: reaktivita a permeabilita membrány“. Biochemie. 43 (48): 15195–15203. doi:10.1021 / bi048329a. PMID 15568811.
- ^ Stevens, R; Stevens, L; Price, N. C (1983) The Stability of Various Thiol Compounds used in Protein Purifications. Biochemical Education, 11 (2), 70. doi:10.1016/0307-4412(83)90048-1
externí odkazy
 Média související s Dithiothreitol na Wikimedia Commons
Média související s Dithiothreitol na Wikimedia Commons
