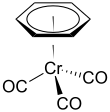
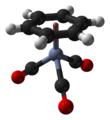
(Benzen) chromitý trikarbonyl - (Benzene)chromium tricarbonyl
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC (benzen) trikarbonylchrom | |||
| Ostatní jména benzen trikarbonylchrom, (benzen) chromium trikarbonyl, Benchrotren, pi-benzenetrikarbonylchrom | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.031.939 | ||
| Číslo ES |
| ||
PubChem CID | |||
| |||
| |||
| Vlastnosti | |||
| Cr (C.6H6) (CO)3 | |||
| Molární hmotnost | 214,14 g / mol | ||
| Vzhled | pevné žluté krystaly | ||
| Bod tání | 163 až 166 ° C (325 až 331 ° F; 436 až 439 K) | ||
| nerozpustný | |||
| Rozpustnost | THF, éter, benzen | ||
| Struktura | |||
| čtyřboká, „klavírní stolička“ | |||
| Nebezpečí | |||
| Hlavní nebezpečí | Zdraví škodlivý při vdechování, styku s kůží nebo požití | ||
| Piktogramy GHS |  | ||
| Signální slovo GHS | Varování | ||
| H302, H312, H332 | |||
| P261, P264, P270, P271, P280, P301 + 312, P302 + 352, P304 + 312, P304 + 340, P312, P322, P330, P363, P501 | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
(Benzen) chromitý trikarbonyl je organokovová sloučenina se vzorcem Cr (C.6H6) (CO)3. Tato žlutá krystalická pevná sloučenina je běžně rozpustná nepolární organická rozpouštědla. Molekula přijímá geometrii známou jako „klavírní stolička "Kvůli rovinnému uspořádání aryl skupina a přítomnost tří CO ligandy jako „nohy“ na ose chromové vazby.[1]
Příprava
(Benzen) trikarbonylchromium poprvé ohlásili v roce 1957 Fischer a Öfele, kteří připravili sloučeninu karbonylace z bis (benzen) chrom.[2] Získali hlavně chromkarbonyl (Cr (CO)6) a stopy Cr (C.6H6) (CO)3. Syntéza byla optimalizována reakcí Cr (CO)6 a Cr (C.6H6)2. Pro komerční účely je reakce Cr (CO)6 a benzen se používá:
- Cr (CO)6 + C.6H6 → Cr (C.6H6) (CO)3 + 3 CO
Aplikace
Aromatického kruhu (benzenu) trikarbonylchromia je podstatně více elektrofilní než samotný benzen, což mu umožňuje podstoupit nukleofilní adice reakce.[3]
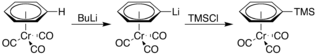
Je také kyselější a po ošetření prochází lithiací n-butyllithium. Výsledný organolithná sloučenina potom lze použít jako nukleofil při různých reakcích, například s trimethylsilylchlorid:
Užitečný je (benzen) trikarbonylchrom katalyzátor pro hydrogenace 1,3-dienes. Produkt alken výsledky z 1,4-přidání vodík. Komplex nehydrogenuje izolovaně dvojné vazby.
Reference
- ^ Gilbert T. M. Bauer C. B., Rogers R. D. (1996). "Struktury (η6-benzen dimethylacetal) - a (n6-benzen diethylacetal) chromitý trikarbonyl: strukturní důkazy o téměř elektroneutalitě dialkylacetálového substituentu “. Journal of Chemical Crystallography. 26 (5): 355. doi:10.1007 / BF01677100.
- ^ Fischer, Ernst Otto; Elefele, Karl. (1957). „Über Aromatenkomplexe von Metallen, XIII Benzol-Chrom-Tricarbonyl,“ Chemische Berichte, 90, 2532-5. doi:10.1002 / cber.19570901117.
- ^ Herndon, James W; Laurent, Stéphane E. (2008). “(Η6-Benzen) tricarbonylchromium, “v Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, Chichester, 2008. doi:10.1002 / 047084289X.rb025.pub2. Článek Datum zveřejnění online: 15. března 2009