Cyklopentadien - Cyclopentadiene
| |||
 | |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Cyklopenta-1,3-dien | |||
| Ostatní jména | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| Zkratky | CPD, HCp | ||
| 471171 | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.008.033 | ||
| Číslo ES |
| ||
| 1311 | |||
| Pletivo | 1,3-cyklopentadien | ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C5H6 | |||
| Molární hmotnost | 66.103 g · mol−1 | ||
| Vzhled | Bezbarvá kapalina | ||
| Zápach | dráždivý, terpen -jako[1] | ||
| Hustota | 0,786 g cm−3 | ||
| Bod tání | -90 ° C; -130 ° F; 183 tis | ||
| Bod varu | 39 až 43 ° C; 102 až 109 ° F; 312 až 316 K. | ||
| nerozpustný[1] | |||
| Tlak páry | 400 mmHg (53 kPa)[1] | ||
| Kyselost (strK.A) | 16 | ||
| Konjugovaná základna | Cyklopentadienylový anion | ||
| −44.5×10−6 cm3 mol−1 | |||
| Struktura | |||
| Rovinný[3] | |||
| Termochemie | |||
Tepelná kapacita (C) | 115,3 J K.−1 mol−1 | ||
Std molární entropie (S | 182,7 J K.−1 mol−1 | ||
| Nebezpečí | |||
| Bod vzplanutí | 25 ° C (77 ° F; 298 K) | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LC50 (střední koncentrace ) | 14 182 ppm (krysa, 2 hodiny) 5091 ppm (myš, 2 hodiny)[4] | ||
| NIOSH (Limity expozice USA pro zdraví): | |||
PEL (Dovolený) | PEL 75 ppm (200 mg / m3)[1] | ||
REL (Doporučeno) | PEL 75 ppm (200 mg / m3)[1] | ||
IDLH (Okamžité nebezpečí) | 750 ppm[1] | ||
| Související sloučeniny | |||
Příbuzný uhlovodíky | Benzen Cyklobutadien Cyklopenten | ||
Související sloučeniny | Dicyklopentadien | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Cyklopentadien je organická sloučenina s vzorec C5H6.[5] To je často zkráceno CpH protože cyklopentadienylový anion je zkráceně Cp−.
Tato bezbarvá kapalina má silnou a nepříjemný zápach. Při pokojové teplotě je to cyklické dien dimerizuje v průběhu hodin dát dicyklopentadien přes a Diels-Alderova reakce. Tento dimer může být obnovena zahřátím, čímž se získá monomer.
Sloučenina se používá hlavně k výrobě cyklopenten a jeho deriváty. To je populárně používán jako předchůdce cyklopentadienylový anion (Kop−), důležitý ligand v cyklopentadienylové komplexy v organokovová chemie.[6]
Produkce a reakce

Produkce cyklopentadienu se obvykle neliší od dicyklopentadien protože se vzájemně mění. Získávají se z černouhelného dehtu (asi 10–20 g / t) a parou praskání z nafta (asi 14 kg / t).[7] K získání monomeru cyklopentadienu se komerční dicyklopentadien štěpí zahříváním na přibližně 180 ° C. Monomer se sebere destilací a brzy poté se použije.[8]
Sigmatropické přeskupení
Atomy vodíku v cyklopentadienu procházejí rychle [1,5] -sigmatropické posuny jak je naznačeno 1H NMR spektra zaznamenávány při různých teplotách.[9] Ještě více fluxional jsou deriváty C5H5E (CH3)3 (E = Si, Ge, Sn ), přičemž těžší prvek migruje z uhlíku na uhlík s nízkou aktivační bariérou.
Diels – Alderovy reakce
Cyklopentadien je vysoce reaktivní dien v Diels-Alderova reakce protože k dosažení geometrie obálky přechodového stavu ve srovnání s jinými dieny je nutné minimální zkreslení dienu.[10] Cyklopentadien skvěle dimerizuje. Ke konverzi dochází za několik hodin při teplotě místnosti, ale monomer lze skladovat několik dní při teplotě -20 ° C.[7]
Deprotonace
Sloučenina je neobvykle kyselé (strK.A = 16) pro a uhlovodík, skutečnost vysvětlena vysokou stabilitou aromatický cyklopentadienyl anion, C
5H−
5. Deprotonace lze dosáhnout typicky různými bázemi hydrid sodný, kov sodný a butyl lithium. Soli tohoto aniontu jsou komerčně dostupné, včetně cyklopentadienid sodný a lithium cyklopentadienid. Jsou zvyklí na přípravu cyklopentadienylové komplexy.
Metalocenové deriváty
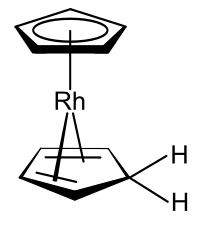
Metaloceny a příbuzné cyklopentadienylové deriváty byly důkladně vyšetřovány a představují základní kámen organokovová chemie vzhledem k jejich vysoké stabilitě. První metalocen charakterizovaný, ferrocen, byl připraven způsobem, jakým se připravuje mnoho dalších metalocenů: kombinací derivátů alkalických kovů ve formě MC5H5 s dihalogenidy z přechodné kovy:[12] Jako typický příklad, nikelocen formy po ošetření chlorid nikelnatý s cyklopentadienidem sodným v THF.[13]
- NiCl2 + 2 NaC5H5 → Ni (C.5H5)2 + 2 NaCl
Jsou známy organokovové komplexy, které zahrnují jak cyklopentadienylový anion, tak samotný cyklopentadien, jehož jedním příkladem je rhodocen derivát vyrobený z rhodocenového monomeru v protická rozpouštědla.[14]
Organická syntéza
Byl to výchozí materiál v Leo Paquette 1982 syntéza dodekahedran.[15] První krok zahrnoval redukční dimerizace molekuly dát dihydrofulvalen, není jednoduchý doplněk k získání dicyklopentadienu.

Použití
Kromě toho, že slouží jako prekurzor katalyzátorů na bázi cyklopentadienylu, je hlavní komerční aplikací cyklopentadienu jako prekurzoru komonomery. Semi-hydrogenace dává cyklopenten. Diels-Alderova reakce s butadien dává ethyliden norbornen, komonomer ve výrobě EPDM kaučuky.
Deriváty

Cyklopentadien může nahradit jeden nebo více vodíků a vytvářet deriváty s kovalentními vazbami:
- Objemní cyklopentadieni
- Kalicen
- Cyklopentadienon
- Di-tert-butylcyklopentadien
- Methylcyklopentadien
- Pentamethylcyklopentadien
- Pentacyanocyklopentadien
Většina z těchto substituovaných cyklopentadienů se také může tvořit anionty a připojte se cyklopentadienylové komplexy.
Viz také
Reference
- ^ A b C d E F G NIOSH Kapesní průvodce chemickými nebezpečími. "#0170". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ William M. Haynes (2016). CRC Handbook of Chemistry and Physics [Fyzikální konstanty organických sloučenin]. 97. CRC Press / Taylor and Francis. p. 276 (3-138). ISBN 978-1498754286.
- ^ Faustov, Valery I .; Egorov, Michail P .; Nefedov, Oleg M .; Molin, Yuri N. (2000). „Výpočty Ab initio G2 a DFT na elektronovou afinitu cyklopentadienu, sila, germolu a jejich 2,3,4,5-tetrafenylem substituovaných analogů: struktura, stabilita a parametry EPR radikálových aniontů“. Phys. Chem. Chem. Phys. 2 (19): 4293–4297. Bibcode:2000PCCP ... 2.4293F. doi:10,1039 / b005247g.
- ^ „Cyklopentadien“. Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ LeRoy H. Scharpen a Victor W. Laurie (1965): „Struktura cyklopentadienu“. The Journal of Chemical Physics, svazek 43, číslo 8, strany 2765-2766. doi:10.1063/1.1697207
- ^ Hartwig, J. F. (2010). Organotransition Metal Chemistry: From Bonding to Catalysis. New York, NY: University Science Books. ISBN 978-1-891389-53-5.
- ^ A b Hönicke, Dieter; Födisch, Ringo; Claus, Peter; Olson, Michael. "Cyklopentadien a cyklopenten". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.
- ^ Moffett, Robert Bruce (1962). „Cyklopentadien a 3-chlorcyklopenten“. Organické syntézy.; Kolektivní objem, 4, str. 238
- ^ Streitwieser, A .; Heathcock, C. H.; Kosower, E. M. (1998). Úvod do organické chemie (4. vydání). Upper Saddle River, NJ: Prentice Hall.[ISBN chybí ]
- ^ Levandowski, Brian; Houk, Ken (2015). „Teoretická analýza vzorců reaktivity v Diels-Alderových reakcích cyklopentadienu, cyklohexadienu a cykloheptadienu se symetrickými a nesymetrickými dienofily“. J. Org. Chem. 80 (7): 3530–3537. doi:10.1021 / acs.joc.5b00174. PMID 25741891.
- ^ Fischer, E. O.; Wawersik, H. (1966). „Über Aromatenkomplexe von Metallen: LXXXVIII. Über Monomeres und Dimeres Dicyclopentadienylrhodium und Dicyclopentadienyliridium und Über Ein Neues Verfahren Zur Darstellung Ungeladener Metall-Aromaten-Komplexe“ [Na aromatické komplexy kovů: LX Na monomerním a dimerním dicyklopentadienylrhodiu a dicyklopentadienyliridiu a nová metoda pro reprezentaci nenabitých kov-aromatických komplexů]. J. Organomet. Chem. (v němčině). 5 (6): 559–567. doi:10.1016 / S0022-328X (00) 85160-8.
- ^ Girolami, G. S .; Rauchfuss, T. B .; Angelici, R. J. (1999). Syntéza a technika v anorganické chemii. Mill Valley, CA: University Science Books. ISBN 0-935702-48-2.
- ^ Jolly, W. L. (1970). Syntéza a charakterizace anorganických sloučenin. Englewood Cliffs, NJ: Prentice-Hall. ISBN 0-13-879932-6.
- ^ Kolle, U .; Grub, J. (1985). „Permetylmetallocen: 5. Reakce decamethylrutheniových kationtů“. J. Organomet. Chem. 289 (1): 133–139. doi:10.1016 / 0022-328X (85) 88034-7.
- ^ Paquette, L. A.; Wyvratt, M. J. (1974). „Domino Diels – Alderovy reakce. I. Aplikace na rychlou konstrukci polyfúzovaných cyklopentanoidních systémů“. J. Am. Chem. Soc. 96 (14): 4671–4673. doi:10.1021 / ja00821a052.
- ^ Reiners, Matthis; Ehrlich, Nico; Walter, Marc D. (2018). Syntéza 1,3,5-Tri-tert-Butylcyklopenta-1,3-dien a jeho kovové komplexy Na {1,2,4- (Me3C)3C5H2} a Mg {η5-1,2,4- (Me3C)3C5H2)2. Anorganické syntézy. 37. p. 199. doi:10.1002 / 9781119477822.ch8.