Myelin - Myelin
| Myelin | |
|---|---|
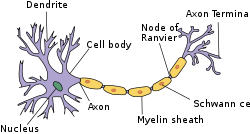 Struktura zjednodušeného neuronu v PNS | |
 Neuron s oligodendrocytem a myelinovým obalem v CNS | |
| Detaily | |
| Systém | Nervový systém |
| Identifikátory | |
| FMA | 62977 |
| Anatomická terminologie | |
Myelin je lipid - bohatá (mastná) látka, která obklopuje nerv buňka axony („dráty“ nervového systému) na izolovat a zvýšit rychlost, s jakou elektrické impulsy (tzv akční potenciály ) jsou vedeny podél axonu.[1] Myelinizovaný axon lze přirovnat k elektrickému drátu (axon) s izolačním materiálem (myelin) kolem něj. Na rozdíl od plastového krytu na elektrickém drátu však myelin netvoří po celé délce axonu jediný dlouhý plášť. Spíše každý myelinový plášť izoluje axon přes jeden dlouhý úsek a obecně každý axon obsahuje několik dlouhých myelinovaných úseků oddělených od sebe krátkými mezerami myelinového pláště nazývanými uzly Ranvier.
Myelin se tvoří v centrální nervový systém (CNS; mozek, mícha a optický nerv) od gliové buňky volala oligodendrocyty a v periferní nervový systém (PNS) tzv. Gliovými buňkami Schwannovy buňky. V CNS přenášejí axony elektrické signály z jednoho těla nervové buňky do druhého. V PNS přenášejí axony signály do svalů a žláz nebo ze smyslových orgánů, jako je kůže. Každý myelinový obal je tvořen koncentrický obalení procesu oligodendrocytů (CNS) nebo Schwannových buněk (PNS) (končetinové prodloužení z těla buňky) kolem axon.[2][3] Myelin snižuje kapacita axonální membrány. Na molekulární úrovni zvyšuje v internodech vzdálenost mezi extracelulárními a intracelulárními ionty a snižuje akumulaci nábojů. Výsledkem je diskontinuální struktura myelinového pláště sůlné vedení, přičemž akční potenciál „skočí“ z jednoho uzlu Ranvier, přes dlouhý myelinizovaný úsek axonu zvaného internode, před „dobitím“ dalšího uzlu Ranvier atd., dokud nedosáhne axonový terminál.[4][5][6] Uzly Ranvier jsou krátké (c. 1 mikron ) nemyelinizované oblasti axonu mezi sousedními dlouhými (asi 0,2 mm -> 1 mm) myelinizovanými internodami. Jakmile dosáhne axonového terminálu, tento elektrický signál vyvolá uvolnění chemické zprávy nebo neurotransmiter který se váže na receptory na sousední postsynaptické buňce (např. nervová buňka v CNS nebo svalová buňka v PNS) ve specializovaných oblastech zvaných synapse.
Tato „izolační“ role pro myelin je pro normální stav nezbytná funkce motoru (tj. pohyb, jako je chůze), senzorická funkce (např. sluch, vidění nebo cítění pocitu bolesti) a poznání (např. získávání a vybavování znalostí), což dokazují důsledky poruch, které je ovlivňují, například geneticky podmíněné leukodystrofie;[7] získaný zánětlivý demyelinizační porucha, roztroušená skleróza;[8] a zánětlivá demyelinizace periferní neuropatie.[9] Vzhledem k vysoké prevalenci je roztroušená skleróza, která konkrétně postihuje centrální nervový systém (mozek, míchu a optický nerv), nejznámější poruchou myelinu.
Rozvoj
Proces tvorby myelinu se nazývá myelinizace nebo myelinogeneze. V CNS buňky zvané prekurzorové buňky oligodendrocytů (OPC; prekurzory oligodendrocytů) odlišit na zralé oligodendrocyty, které tvoří myelin. U lidí začíná myelinizace brzy ve 3. trimestru,[10] ačkoli v době narození je v CNS nebo PNS přítomno pouze malé množství myelinu. V kojeneckém věku myelinizace postupuje rychle, s rostoucím počtem axonů, které získávají myelinové pochvy. To odpovídá rozvoji kognitivních a motorických dovedností, včetně porozumění jazyku, osvojování řeči, procházení a chůze. Myelinizace pokračuje dospíváním a ranou dospělostí, a přestože je v tuto chvíli z velké části dokončena, lze myelinové pochvy přidat šedá hmota regiony jako mozková kůra, Během života.[11][12][13]
Distribuce druhů
Myelin je považován za určující charakteristiku čelist obratlovců (gnathostomes ), ačkoli axony jsou obklopeny typem buňky, nazývané gliové buňky, u bezobratlých.[14][15] Tyto gliové zábaly se zcela liší od kompaktního myelinu obratlovců, vytvořeného, jak je uvedeno výše, soustředným obalením procesu myelinizujících buněk několikrát kolem axonu. Myelin byl poprvé popsán v roce 1854 autorem Rudolf Virchow,[16] ačkoli to bylo o více než sto let později, v návaznosti na vývoj elektronové mikroskopie, bylo zřejmé, že jeho původ v gliálních buňkách a jeho ultrastruktura.[17]
U obratlovců nejsou všechny axony myelinizovány. Například v PNS je velká část axonů nemyelinizovaná. Místo toho jsou obklopeny nemyelinizujícími Schwannovými buňkami známými jako Remak SC a uspořádány dovnitř Balíčky Remak.[18] V CNS se nemyelinizované axony (nebo přerušovaně myelinizované axony, což znamená axony s dlouhými nemyelinizovanými oblastmi mezi myelinizovanými segmenty) mísí s myelinovanými a jsou alespoň částečně propleteny procesy jiného typu gliová buňka volal astrocyty.[Citace je zapotřebí ][19]
Složení


- Axon
- Jádro Schwannovy buňky
- Schwannova buňka
- Myelinová vrstva
- Neurilema
Myelin CNS se mírně liší složením a konfigurací od myelinu PNS, ale oba plní stejnou „izolační“ funkci (viz výše). Protože je myelin bohatý na lipidy, jeví se jako bílý, odtud název „bílá hmota "CNS. Oba trakty bílé hmoty CNS (např zrakový nerv, kortikospinální trakt a corpus callosum ) a PNS nervy (např sedacího nervu a Sluchový nerv, které také vypadají jako bílé), z nichž každý obsahuje tisíce až miliony axonů, převážně paralelně zarovnaných. Krevní cévy poskytují cestu pro kyslík a energetické substráty, jako je glukóza, k dosažení těchto vláknových traktů, které také obsahují jiné typy buněk astrocyty a mikroglie v CNS a makrofágy v PNS.
Pokud jde o celkovou hmotnost, myelin obsahuje přibližně 40% vody; suchá hmota obsahuje mezi 60% a 75% lipid a mezi 15% a 25% protein. Obsah bílkovin zahrnuje základní protein myelinu (MBP),[20] který je hojný v CNS, kde hraje kritickou, neredundantní roli při tvorbě kompaktního myelinu; myelinový oligodendrocytový glykoprotein (MOG),[21] který je specifický pro CNS; a proteolipidový protein (PLP),[22] což je nejhojnější protein v myelinu CNS, ale jen malá složka myelinu PNS. V PNS myelinový protein nula (MPZ nebo P0) má podobnou roli jako PLP v CNS v tom, že se podílí na udržování pohromadě více koncentrických vrstev membrány gliových buněk, které tvoří myelinový obal. Primární lipid myelinu je a glykolipid volala galactocerebroside. Propletené uhlovodíkové řetězce z sfingomyelin posílit myelinové pouzdro. Cholesterol je základní lipidovou složkou myelinu, bez které se myelin nevytváří.[23]
Funkce

Hlavním účelem myelinu je zvýšit rychlost elektrického proudu impulsy množí se podél myelinizovaného vlákna. V nemyelinizovaných vláknech elektrické impulsy (akční potenciály ) cestují jako spojité vlny, ale v myelinizovaných vláknech „hopkají“ nebo se množí sůlné vedení. Ta druhá je výrazně rychlejší než ta první, alespoň pro axony nad určitým průměrem. Myelin klesá kapacita a zvyšuje se elektrický odpor přes axonální membránu ( axolemma ). Bylo navrženo, že myelin umožňuje větší velikost těla udržováním agilní komunikace mezi vzdálenými částmi těla.[14]
Myelinovaná vlákna chybí napěťově řízené sodíkové kanály podél myelinizovaných internodií a vystavil je pouze na uzly Ranvier. Zde jsou velmi bohaté a hustě zabalené.[24] Kladně nabitý sodík ionty může vstoupit do axonu přes tyto napěťově řízené kanály, což vede k depolarizace membránového potenciálu v uzlu Ranvier. The klidový membránový potenciál se poté rychle obnoví v důsledku kladně nabitých iontů draslíku opouštějících axon draslíkové kanály. Sodík ionty uvnitř axonu pak rychle difunduje axoplazmou (axonální cytoplazma ), do sousedního myelinizovaného internodu a nakonec do dalšího (distální ) uzel Ranvier, který spouští otevření napěťově řízených sodíkových kanálů a vstup sodíkových iontů na tomto místě. I když sodné ionty difundují axoplazmou rychle, difúze je od přírody dekrementální, proto musí být uzly Ranvier (relativně) blízko sebe, aby se zajistilo šíření akčního potenciálu.[25] Akční potenciál se „dobíjí“ v po sobě jdoucích uzlech Ranvier jako axolemmal membránový potenciál depolarizuje na přibližně +35 mV.[24] Podél myelinizované internody pumpují energeticky závislá sodíková / draselná čerpadla sodíkové ionty zpět z axonu a ionty draslíku zpět do axonu, aby obnovily rovnováhu iontů mezi intracelulárním (uvnitř buňky, v tomto případě tedy axonem) a extracelulárním (mimo buňku) tekutiny.
I když je role myelinu jako „axonálního izolátoru“ dobře zavedená, jiné funkce myelinizujících buněk jsou méně známé nebo jsou zavedeny teprve nedávno. Myelinizující buňka „vyřezává“ podkladový axon podporou fosforylace z neurofilamenty, čímž se zvětšuje průměr nebo tloušťka axonu v internodálních oblastech; pomáhá shlukovat molekuly na axolemmu (jako jsou napěťově řízené sodíkové kanály) v uzlu Ranvier;[26] a moduluje přepravu cytoskeletální struktury a organely jako mitochondrie podél axonu.[27] V roce 2012 vyšly najevo důkazy podporující roli myelinizační buňky při „krmení“ axonu.[28][29] Jinými slovy se zdá, že myelinizační buňka funguje jako místní „čerpací stanice“ pro axon, která využívá velké množství energie k obnovení normální rovnováhy ionty mezi ním a jeho prostředím,[30][31] po generaci akční potenciály.
Když je periferní vlákno přerušeno, myelinový obal poskytuje stopu, po které může dojít k opětovnému růstu. Myelinová vrstva však nezajišťuje dokonalou regeneraci nervového vlákna. Některá regenerovaná nervová vlákna nenajdou správná svalová vlákna a jiná poškozují motorické neurony periferní nervový systém zemřít bez opětovného růstu. Poškození myelinového obalu a nervových vláken je často spojeno se zvýšenou funkční nedostatečností.
Nemyelinizovaná vlákna a myelinizované axony centrálního nervového systému savců se neregenerují.[Citace je zapotřebí ]
Klinický význam
Demyelinizace
Demyelinizace je ztráta myelinového pláště izolujícího nervy a je charakteristickým znakem některých neurodegenerativní autoimunitní nemoci, včetně roztroušená skleróza, akutní diseminovaná encefalomyelitida, neuromyelitis optica, příčná myelitida, chronická zánětlivá demyelinizační polyneuropatie, Guillain – Barrého syndrom, centrální pontinní myelinóza, zděděné demyelinizační choroby, jako je leukodystrofie, a Charcot – Marie – zubní nemoc. Trpí perniciózní anémie může také utrpět poškození nervů, pokud stav není diagnostikován rychle. Subakutní kombinovaná degenerace míchy sekundární k perniciózní anémii může vést k mírnému poškození periferních nervů k vážnému poškození centrálního nervového systému, což má vliv na řeč, rovnováhu a poznávací povědomí. Když se myelin degraduje, vedení signálů podél nervu může být narušeno nebo ztraceno a nerv nakonec uschne.[je zapotřebí objasnění ] Je označen závažnější případ zhoršení myelinu Canavanova choroba.
The imunitní systém může hrát roli v demyelinizaci spojené s takovými chorobami, včetně zánětů způsobujících demyelinizaci nadprodukcí cytokiny prostřednictvím upregulace z faktor nekrózy nádorů[32] nebo interferon.
Příznaky
Demyelinizace vede k různým příznakům určeným funkcemi postižených neuronů. Naruší signály mezi mozkem a jinými částmi těla; příznaky se liší od pacienta k pacientovi a mají odlišné projevy při klinickém pozorování a v laboratorních studiích.
Typické příznaky zahrnují rozmazání v centrálním zorném poli, které postihuje pouze jedno oko, může být doprovázeno bolestí při pohybu očí, dvojitým viděním, ztrátou zraku / sluchu, podivným pocitem v nohou, pažích, hrudníku nebo obličeji, jako je brnění nebo necitlivost (neuropatie ), slabost paží nebo nohou, kognitivní poruchy, včetně poruchy řeči a ztráty paměti, citlivost na teplo (příznaky se zhoršují nebo se znovu objevují po vystavení teplu, například horká sprcha), ztráta obratnosti, potíže s koordinací pohybu nebo poruchy rovnováhy, potíže s ovládáním stolice nebo močení, únava a tinnitus.[33]
Oprava myelinu
Výzkum na opravu poškozených myelinových obalů pokračuje. Mezi techniky patří chirurgické implantování prekurzorové buňky oligodendrocytů v centrálním nervovém systému a indukující oprava myelinu s jistotou protilátky. Zatímco výsledky u myší byly povzbudivé (prostřednictvím kmenová buňka transplantace), zda je tato technika účinná při nahrazování ztráty myelinu u lidí, není dosud známa.[34] Cholinergní léčba, jako inhibitory acetylcholinesterázy (AChEI), mohou mít příznivé účinky na myelinaci, opravu myelinu a integritu myelinu. Zvyšující se cholinergní stimulace může také působit prostřednictvím jemných trofických účinků na vývojové procesy mozku, zejména na oligodendrocyty a proces celoživotní myelinace, který podporují. Vzrůstající oligodendrocyt cholinergní stimulace, ACHEI a další cholinergní léčby, jako je nikotin, možná by mohla podporovat myelinaci během vývoje a opravu myelinu ve vyšším věku.[35] Glykogen syntáza kináza 3β inhibitory, jako jsou chlorid lithný Bylo zjištěno, že podporují myelinaci u myší s poškozenými obličejovými nervy.[36] Cholesterol je nezbytnou živinou pro myelinové pouzdro vitamin B12.[37][38]
Dysmyelinizace
Dysmyelinizace je charakterizována vadnou strukturou a funkcí myelinových obalů; na rozdíl od demyelinizace neprodukuje léze. Taková vadná pouzdra často vznikají z genetických mutací ovlivňujících biosyntézu a tvorbu myelinu. The třesoucí se myš představuje jeden zvířecí model dysmyelinizace. Lidské nemoci, kde je zahrnuta dysmyelinizace, zahrnují leukodystrofie (Pelizaeus – Merzbacherova choroba, Canavanova choroba, fenylketonurie ) a schizofrenie.[39][40][41]
Myelin bezobratlých
Funkčně ekvivalentní pochvy podobné myelinu se nacházejí v několika taxonech bezobratlých včetně oligochaetes, penaeidy, palaemonids, a kalanoidy. Tyto pláště podobné myelinu mají několik strukturních znaků s plášti nalezenými u obratlovců, včetně množství membrán, kondenzace membrány a uzlin.[14] Uzly obratlovců jsou však prstencovité; tj. obklopují axon. Naproti tomu uzly nalezené v pouzdrech bezobratlých jsou buď prstencové, nebo fenestrované; tj. jsou omezeny na „spoty“. Je pozoruhodné, že nejrychlejší zaznamenaná rychlost vedení (přes obratlovce i bezobratlé) se nachází v zakrytých axonech Kuruma krevety, bezobratlý,[14] v rozmezí 90 až 200 m / s[15] (srov. 100–120 m / s pro nejrychlejší myelinizovaný obratel obratlovců).
Viz také
- Demonstrace lézí centrálního nervového systému
- Glykoprotein spojený s myelinem
- Myelin volný čas
- Projekt Myelin, projekt regenerace myelinu
- Myelin Repair Foundation, nezisková nadace pro lékařský výzkum pro roztroušená skleróza objev drog.
Reference
- ^ Bean, Bruce P. (červen 2007). "Akční potenciál v centrálních neuronech savců". Recenze přírody Neurovědy. 8 (6): 451–465. doi:10.1038 / nrn2148. ISSN 1471-0048. PMID 17514198. S2CID 205503852.
- ^ Stassart, Ruth M .; Möbius, Wiebke; Loď, Klaus-Armin; Edgar, Julia M. (2018). „Axon-myelinová jednotka ve vývoji a degenerativní nemoci“. Frontiers in Neuroscience. 12: 467. doi:10.3389 / fnins.2018.00467. ISSN 1662-4548. PMC 6050401. PMID 30050403.
- ^ Stadelmann, Christine; Timmler, Sebastian; Barrantes-Freer, Alonso; Simons, Mikael (01.07.2019). „Myelin v centrálním nervovém systému: struktura, funkce a patologie“. Fyziologické recenze. 99 (3): 1381–1431. doi:10.1152 / physrev.00031.2018. ISSN 1522-1210. PMID 31066630.
- ^ Carroll, SL (2017). „Molekulární a morfologické struktury, které umožňují vedení solení v periferním nervu“. Journal of Neuropathology and Experimental Neurology. 76 (4): 255–257. doi:10.1093 / jnen / nlx013. PMID 28340093.
- ^ Keizer J, Smith GD, Ponce-Dawson S, Pearson JE (srpen 1998). "Sůlné šíření vln Ca2 + jiskrami Ca2 +". Biofyzikální deník. 75 (2): 595–600. Bibcode:1998BpJ .... 75..595K. doi:10.1016 / S0006-3495 (98) 77550-2. PMC 1299735. PMID 9675162.
- ^ Dawson SP, Keizer J, Pearson JE (květen 1999). „Fire-diffuse-fire model of dynamika intracelulárních vápenatých vln“. Sborník Národní akademie věd Spojených států amerických. 96 (11): 6060–3. Bibcode:1999PNAS ... 96.6060D. doi:10.1073 / pnas.96.11.6060. PMC 26835. PMID 10339541.
- ^ van der Knaap MS, Bugiani M (září 2017). „Leukodystrofie: navrhovaný klasifikační systém založený na patologických změnách a patogenetických mechanismech“. Acta Neuropathologica. 134 (3): 351–382. doi:10.1007 / s00401-017-1739-1. PMC 5563342. PMID 28638987.
- ^ Compston A, Coles A (říjen 2008). "Roztroušená skleróza". Lanceta. 372 (9648): 1502–17. doi:10.1016 / S0140-6736 (08) 61620-7. PMID 18970977. S2CID 195686659.
- ^ Lewis RA (říjen 2017). "Chronická zánětlivá demyelinizační polyneuropatie". Aktuální názor na neurologii. 30 (5): 508–512. doi:10.1097 / WCO.0000000000000481. PMID 28763304. S2CID 4961339.
- ^ „Videa a popisy dětských neurologických vyšetření: vývojová anatomie“. knihovna.med.utah.edu. Citováno 2016-08-20.
- ^ Swire M, Ffrench-Constant C (květen 2018). „Vidět věřit: Dynamika myelinu v CNS pro dospělé“. Neuron. 98 (4): 684–686. doi:10.1016 / j.neuron.2018.05.005. PMID 29772200.
- ^ Hill RA, Li AM, Grutzendler J (květen 2018). „Celoživotní kortikální plastičnost myelinů a degenerace související s věkem v živém mozku savců“. Přírodní neurovědy. 21 (5): 683–695. doi:10.1038 / s41593-018-0120-6. PMC 5920745. PMID 29556031.
- ^ Hughes EG, Orthmann-Murphy JL, Langseth AJ, Bergles DE (květen 2018). „Remodelace myelinu prostřednictvím na zkušenostech závislé oligodendrogeneze v somatosenzorické kůře dospělých“. Přírodní neurovědy. 21 (5): 696–706. doi:10.1038 / s41593-018-0121-5. PMC 5920726. PMID 29556025.
- ^ A b C d Hartline DK (květen 2008). „Co je to myelin?“. Biologie Neuron Glia. 4 (2): 153–63. doi:10.1017 / S1740925X09990263. PMID 19737435. S2CID 33164806.
- ^ A b Salzer JL, Zalc B (říjen 2016). "Myelinizace" (PDF). Aktuální biologie. 26 (20): R971 – R975. doi:10.1016 / j.cub.2016.07.074. PMID 27780071.
- ^ Virchow R (1854). „Ueber das ausgebreitete Vorkommen einer dem Nervenmark analogen Substanz in den thierischen Geweben“. Archiv pro patologickou anatomii a fyziologii a klinickou medicínu (v němčině). 6 (4): 562–572. doi:10.1007 / BF02116709. S2CID 20120269.
- ^ Boullerne AI (září 2016). "Historie myelinu". Experimentální neurologie. 283 (Pt B): 431–445. doi:10.1016 / j.expneurol.2016.06.005. PMC 5010938. PMID 27288241.
- ^ Monk KR, Feltri ML, Taveggia C (srpen 2015). „Nové poznatky o vývoji Schwannových buněk“. Glia. 63 (8): 1376–1393. doi:10,1002 / glia.22852. PMC 4470834. PMID 25921593.
- ^ Wang, Doris D .; Bordey, Angélique (11. prosince 2008). „Odysea astrocytů“. Pokrok v neurobiologii. 86 (4): 342–367. doi:10.1016 / j.pneurobio.2008.09.015. PMC 2613184. PMID 18948166 - prostřednictvím Elsevier Science Direct.
- ^ Steinman L (květen 1996). „Roztroušená skleróza: koordinovaný imunologický útok proti myelinu v centrálním nervovém systému“. Buňka. 85 (3): 299–302. doi:10.1016 / S0092-8674 (00) 81107-1. PMID 8616884. S2CID 18442078.
- ^ Mallucci G, Peruzzotti-Jametti L, Bernstock JD, Pluchino S (duben 2015). „Role imunitních buněk, glií a neuronů v patologii bílé a šedé hmoty u roztroušené sklerózy“. Pokrok v neurobiologii. 127-128: 1–22. doi:10.1016 / j.pneurobio.2015.02.003. PMC 4578232. PMID 25802011.
- ^ Greer JM, Lees MB (březen 2002). „Proteolipidový protein myelinu - prvních 50 let“. International Journal of Biochemistry & Cell Biology. 34 (3): 211–215. doi:10.1016 / S1357-2725 (01) 00136-4. PMID 11849988.
- ^ Saher G, Brügger B, Lappe-Siefke C, Möbius W, Tozawa R, Wehr MC, Wieland F, Ishibashi S, Nave KA (duben 2005). „Vysoká hladina cholesterolu je nezbytná pro růst myelinové membrány“. Přírodní neurovědy. 8 (4): 468–475. doi:10.1038 / nn1426. PMID 15793579. S2CID 9762771.
- ^ A b Saladin KS (2012). Anatomie a fyziologie: jednota formy a funkce (6. vydání). New York, NY: McGraw-Hill.[stránka potřebná ]
- ^ Raine CS (1999). „Charakteristika neuroglie“. In Siegel GJ, Agranoff BW, Albers RW, Fisher SK, Uhler MD (eds.). Základní neurochemie: Molekulární, buněčné a lékařské aspekty (6. vydání). Philadelphia: Lippincott-Raven.
- ^ Brivio V, Faivre-Sarrailh C, Peles E, Sherman DL, Brophy PJ (duben 2017). „Shromáždění uzlů CNS Ranvier v myelinizovaných nervech podporuje Axon Cytoskeleton“. Aktuální biologie. 27 (7): 1068–1073. doi:10.1016 / j.cub.2017.01.025. PMC 5387178. PMID 28318976.
- ^ Stassart RM, Möbius W, Nave KA, Edgar JM (2018). „Axon-myelinová jednotka ve vývoji a degenerativní nemoci“. Frontiers in Neuroscience. 12: 467. doi:10.3389 / fnins.2018.00467. PMC 6050401. PMID 30050403.
- ^ Fünfschilling U, Supplie LM, Mahad D, Boretius S, Saab AS, Edgar J, Brinkmann BG, Kassmann CM, Tzvetanova ID, Möbius W, Diaz F, Meijer D, Suter U, Hamprecht B, Sereda MW, Moraes CT, Frahm J , Goebbels S, Nave KA (duben 2012). „Glykolytické oligodendrocyty udržují myelin a dlouhodobou axonální integritu“. Příroda. 485 (7399): 517–521. Bibcode:2012Natur.485..517F. doi:10.1038 / příroda11007. PMC 3613737. PMID 22622581.
- ^ Lee Y, Morrison BM, Li Y, Lengacher S, Farah MH, Hoffman PN, Liu Y, Tsingalia A, Jin L, Zhang PW, Pellerin L, Magistretti PJ, Rothstein JD (červenec 2012). „Oligodendroglia metabolicky podporuje axony a přispívá k neurodegeneraci“. Příroda. 487 (7408): 443–448. Bibcode:2012Natur.487..443L. doi:10.1038 / příroda11314. PMC 3408792. PMID 22801498.
- ^ Engl E, Attwell D (srpen 2015). „Nesignalizovaná spotřeba energie v mozku“. The Journal of Physiology. 593 (16): 3417–329. doi:10.1113 / jphysiol.2014.282517. PMC 4560575. PMID 25639777.
- ^ Attwell D, Laughlin SB (říjen 2001). „Energetický rozpočet pro signalizaci v šedé hmotě mozku“. Journal of Cerebral Blood Flow and Metabolism. 21 (10): 1133–145. doi:10.1097/00004647-200110000-00001. PMID 11598490.
- ^ Ledeen RW, Chakraborty G (březen 1998). "Cytokiny, signální transdukce a zánětlivá demyelinizace: přehled a hypotéza". Neurochemický výzkum. 23 (3): 277–289. doi:10.1023 / A: 1022493013904. PMID 9482240. S2CID 7499162.
- ^ Klinika Mayo 2007 a Klinické studie University of Leicester, 2014[úplná citace nutná ]
- ^ Windrem MS, Nunes MC, Rashbaum WK, Schwartz TH, Goodman RA, McKhann G, Roy NS, Goldman SA (leden 2004). "Fetální a dospělé lidské oligodendrocytové progenitorové buňky izolují myelinát vrozeně dysmyelinizovaného mozku". Přírodní medicína. 10 (1): 93–97. doi:10,1038 / nm974. PMID 14702638. S2CID 34822879. Shrnutí ležel – FuturePundit.
- ^ Bartzokis G (srpen 2007). "Inhibitory acetylcholinesterázy mohou zlepšit integritu myelinu". Biologická psychiatrie. 62 (4): 294–301. doi:10.1016 / j.biopsych.2006.08.020. PMID 17070782. S2CID 2130691.
- ^ Makoukji J, Belle M, Meffre D, Stassart R, Grenier J, Shackleford G, Fledrich R, Fonte C, Branchu J, Goulard M, de Waele C, Charbonnier F, Sereda MW, Baulieu EE, Schumacher M, Bernard S, Massaad C (březen 2012). „Lithium zvyšuje remyelinaci periferních nervů“. Sborník Národní akademie věd Spojených států amerických. 109 (10): 3973–3978. Bibcode:2012PNAS..109.3973M. doi:10.1073 / pnas.1121367109. PMC 3309729. PMID 22355115.
- ^ Petrov AM, Kasimov MR, Zefirov AL (2016). „Metabolismus cholesterolu v mozku a jeho defekty: vazba na neurodegenerativní nemoci a synaptická dysfunkce“. Acta Naturae. 8 (1): 58–73. doi:10.32607/20758251-2016-8-1-58-73. PMC 4837572. PMID 27099785.
- ^ Miller A, Korem M, Almog R, Galboiz Y (červen 2005). "Vitamin B12, demyelinizace, remyelinizace a oprava u roztroušené sklerózy". Časopis neurologických věd. 233 (1–2): 93–97. doi:10.1016 / j.jns.2005.03.009. PMID 15896807. S2CID 6269094.
- ^ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (listopad 2006). „Narušené interakce mutantního proteolipidového proteinu / DM20 s cholesterolem a lipidovými rafty v oligodendroglia: důsledky pro dysmyelinizaci ve spastické paraplegii“. The Journal of Neuroscience. 26 (45): 11743–1752. doi:10.1523 / JNEUROSCI.3581-06.2006. PMC 6674790. PMID 17093095.
- ^ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). "Canavanova choroba: studie na knokautované myši". N-acetylaspartát. Pokroky v experimentální medicíně a biologii. 576. str. 77–93, diskuse 361–363. doi:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706.
- ^ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (srpen 2007). „Další důkazy o změněné biosyntéze myelinu a glutamatergické dysfunkci u schizofrenie“. International Journal of Neuropsychopharmacology. 10 (4): 557–563. doi:10.1017 / S1461145706007334. PMID 17291371.
Další čtení
- Fields, R. Douglas, „Mozek se učí neočekávanými způsoby: Neurologové objevili soubor neznámých buněčných mechanismů pro vytváření nových vzpomínek“, Scientific American, sv. 322, č. 3 (březen 2020), s. 74–79. „Myelin, dlouho považován za inertní izolaci axony, je nyní vnímán jako příspěvek k učení řízením rychlosti, jakou signály procházejí nervovým vedením. “(str. 79.)
- Swire M, Ffrench-Constant C (květen 2018). „Vidět věřit: Dynamika myelinu v CNS pro dospělé“. Neuron. 98 (4): 684–686. doi:10.1016 / j.neuron.2018.05.005. PMID 29772200.
- Waxman SG (říjen 1977). "Vedení v myelinizovaných, nemyelinizovaných a demyelinizovaných vláknech". Archivy neurologie. 34 (10): 585–9. doi:10.1001 / archneur.1977.00500220019003. PMID 907529.
